芋头多酚氧化酶的分离纯化与酶学特性
2021-07-08崔晓颖彭新颜贺红军张晓彤
崔晓颖,彭新颜,,*,贺红军,张 敏,张晓彤
(1.烟台大学生命科学学院,山东 烟台 264005;2.鲁东大学生物纳米技术研究院,山东 烟台 264025)
芋头(Colocasia esculenta(L.) S.chott)属于块茎植物[1-2],富含淀粉、酚类化合物、蛋白质、多糖、维生素和多种矿物质[3-5],具有健脾消食、预防龋齿、降低胆固醇水平、提高机体免疫力、改善便秘等诸多生理功能[6-7]。近年来,鲜切是食品工业重要加工方式之一[8]。然而,鲜切果蔬在贮藏和加工过程中很容易发生褐变,致使产品的质地、风味和适销性变差,甚至失去产品原有的营养价值[9-10]。酶促褐变是果蔬加工和贮藏过程中的常见现象,其褐变程度与果蔬中多酚氧化酶(polyphenol oxidase,PPO)活性及含量密切相关。PPO是一种含铜的酶类,可以在分子氧存在下催化酚类物质,并氧化成邻醌,这些醌类与内源性氨基酸或蛋白质自发聚合成复杂的棕色色素[11-12]。目前有许多防止PPO褐变的方法,包括调节pH值、加热、冷冻、除氧和干燥等方法[13-15]。此外,越来越多的研究表明[16-18],添加抗坏血酸、柠檬酸、亚硫酸钠、植酸、氯化钠和L-半胱氨酸等抑制剂能有效控制食品加工过程中的褐变现象。国内外对果蔬中PPO的分离纯化及其特性的研究深入而广泛,包括香蕉[19]、硬粒小麦[20]、芒果[21]、山药[9]和茶叶等[22]。然而,对芋头PPO分离、纯化和特性表征方面的研究较少。因此,本实验以鲜芋头为原料,通过缓冲液粗提、硫酸铵分级沉淀、透析、超滤和柱层析等步骤对芋头PPO进行分离纯化,探究其酶学特性和抑制剂对PPO的影响规律。以期为芋头PPO作用机制和加工贮藏过程中褐变的控制提供理论依据,提高芋头的商品价值。
1 材料与方法
1.1 材料与试剂
山东烟台产“鲁芋1号”芋头的子芋,采收于2019年10月,选购自山东烟台惠安小区市场,挑选新鲜、无腐烂变质、无机械伤、色泽正常的为实验材料。
磷酸二氢钠、磷酸氢二钠、硫酸铵、聚乙二醇辛基苯基醚(TritonX-100)、聚乙二醇6000(polyethylene glycol 6000,PEG 6000)、交联聚乙烯吡咯烷酮(crosslinked polyvinylpyrrolidone,PVPP)、邻苯二酚、间苯二酚、间苯三酚、焦没食子酸、L-酪氨酸(电泳纯)、牛血清白蛋白(bovine serum albumin,BSA)(色谱纯)、抗坏血酸、L-半胱氨酸(电泳纯)、柠檬酸、偏亚硫酸氢钠、三羟甲基氨基甲烷(tris(hydroxymethyl)methyl aminomethane,Tris)、考马斯亮蓝G-250、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸铵(ammonium persulphate,AP)、四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED)烟台鲁杰试剂公司。其他试剂均为分析纯。
1.2 仪器与设备
超滤离心管(10 kDa) 德国Millipore公司;AKTA蛋白质层析纯化系统 美国General Elecric公司;DEAE-Sepharose Fast Flow(DEAE-SFF)层析柱 英国Waterman公司;Superdex G-75凝胶柱 瑞典Amersham Pharmacia Biotech公司;CR22N/21N冷冻离心机 日本日立公司;UV-5500紫外-可见分光光度计 上海元析仪器有限公司;GJ-18S冷冻干燥机 北京松源华兴科技发展公司;低温冰箱(-80 ℃) 日本Sanyo公司;WH-600-LCD型电泳仪 北京市六一仪器厂;HHS型数显式电热恒温水浴锅 上海博迅实业有限公司医疗设备厂;Biodoc-IT 220普通凝胶成像系统 Analytik Jena美国有限责任合伙公司;iMark全自动酶标仪 美国Bio-Rad公司;BL35A11多功能料理机 中国美的集团股份有限公司;XHF-D匀浆机 宁波新芝生物科技股份有限公司;101FA-2电热鼓风干燥箱 上海一恒科学仪器有限公司;Delta 320 pH计 瑞士梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1 PPO粗酶液的提取与纯化
参考Zhou Xiran等[23]的方法进行修改。4 ℃预冷24 h的500 g新鲜芋头去皮切小块,加入到所配制的500 mL的预冷磷酸盐缓冲液中,冰水浴匀浆3 min,匀浆液4 ℃提取2 h,过滤后离心(4 ℃、10 000 r/min、20 min),弃渣取上清液得粗酶液,30%~80%饱和度的硫酸铵分级沉淀,pH 6.8的磷酸盐溶液再溶解沉淀,透析,采用10 kDa膜超滤(8 000 r/min、20 min)浓缩2 次,DEAE-SFF离子交换柱层析,Superdex G-75凝胶柱层析,得到电泳纯芋头PPO。
1.3.1.1 提取缓冲液的配制
称取10 mg PVPP、体积分数0.50%的TritonX-100、体积分数0.34%的PEG6000,充分溶解在500 mL的0.1 mol/L磷酸盐缓冲液中冷藏备用。
1.3.1.2 30%~80%硫酸铵分级沉淀
将硫酸铵用研钵磨细后烘干备用,根据提取所得粗酶液的量,查表计算4 ℃达到30%饱和度所需要硫酸铵的量,然后在0 ℃的冰水浴,向粗酶液中慢速加入所称量的硫酸铵,沉淀24 h后离心(4 ℃、10 000 r/min、20 min)取上清液,用同样的方式继续用30%~80%的硫酸铵沉淀,弃上清液后取沉淀用于后续实验。
1.3.1.3 透析与超滤
用0.1 mol/L磷酸缓冲液(pH 6.8)将硫酸铵沉淀的粗酶液复溶,然后装入透析袋中,用超纯水透析4 次(3~4 h更换1 次去离子水)后,再用0.1 mol/L磷酸缓冲液(pH 6.8)脱盐透析24~48 h。透析结束后用10 kDa超滤离心管离心(4 ℃、8 000 r/min、20 min)2 次,得超滤浓缩粗酶。
1.3.1.4 DEAE-SFF阴离子交换层析
利用DEAE-SFF柱将超滤处理后的粗酶液进行分离纯化。将超纯水、1 mol/L NaCl溶液、0.1 mol/L磷酸盐缓冲溶液(pH 6.8)、体积分数20%的乙醇溶液过0.22 μm膜备用。先利用过膜的超纯水清洗系统和DEAE-SFF层析柱,再使用0.1 mol/L磷酸盐缓冲溶液(pH 6.8)清洗系统和平衡柱子。超滤后样品经过0.22 μm膜过滤后上样,洗脱流速为1.0 mL/min,收集速度5 mL/管,并按收集顺序从标记管号,测定所收集各峰组分的PPO活性和蛋白质浓度。
1.3.1.5 Superdex G-75凝胶柱层析
为了进一步纯化,收集DEAE-SFF色谱柱层析后酶活性高的部分,继续用Superdex G-75色谱柱纯化。利用0.1 mol/L磷酸缓冲液(pH 6.8)进行平衡,通过进样环上样2 mL,用含有0.2 mol/L NaCl的磷酸缓冲液以1 mL/min的速度洗脱,收集速度5 mL/管,并按收集顺序从1开始标记管号;绘制洗脱曲线,测定所收集各组分的PPO活性和蛋白含量。
1.3.2 聚丙烯酰胺凝胶电泳
实验采用非变性聚丙烯酰胺凝胶电泳(native polyacrylamide gel electrophoresis,Native-PAGE)检测以上步骤分离的样品;利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)变性凝胶电泳法检测经DEAE-SFF层析柱、Superdex G-75凝胶色谱柱纯化后PPO的纯度及其分子质量。配制体积分数为5%的浓缩胶和体积分数为12%的分离胶,设定起始电压为80 V,电泳一段时间至指示剂进入分离胶时,改变电压至100 V继续电泳,结束电泳后用考马斯亮蓝G-250染色。最后凝胶在10%乙酸-20%甲醇-70%去离子水中脱色。脱色开始1 h换1 次脱色液,连续换3 次后,再脱色过夜。
1.3.3 PPO活性和蛋白质含量的测定
将0.3 mL PPO液和2.7 mL 14 mmol/L邻苯二酚溶液混匀,30 ℃测定混合溶液在420 nm处的吸光度,空白对照为3 mL的底物溶液。以每分钟反应混合液在420 nm波长处吸光度变化0.001为1 个酶活力单位,即1 U/mL。以BSA为标准试剂,按Bradford法测定PPO蛋白浓度。
1.3.4 芋头PPO特性分析
1.3.4.1 底物特异性和特征吸收波长的确定
通过全波长扫描确定PPO的特征吸收波长。以邻苯二酚、间苯二酚、间苯三酚、焦没食子酸和L-酪氨酸共5 种溶液为反应底物,待酶液和底物反应完全后,用分光光度法测定混合液在300~900 nm之间的吸光度变化,将得到的最佳吸收波长用于后续实验。
分别以不同浓度(2、4、6、8、10、12、14、16、18、20、22 mmol/L)的邻苯二酚、间苯二酚、间苯三酚、焦没食子酸和L-酪氨酸为底物与粗酶反应,通过检测PPO活性确定芋头PPO的底物特异性。测定不同底物浓度[S]对应PPO的反应速率V,求出二者对应的倒数,参照Lineweaver-Burk作图法,将数据按照1/V和1/[S]绘制作图,拟合线性方程为y=ax+b,按式(1)、(2)、(3)分别计算最大反应速率(Vmax)、米氏常数(Km)、底物亲和力(substrate affinity,SA)[24]。
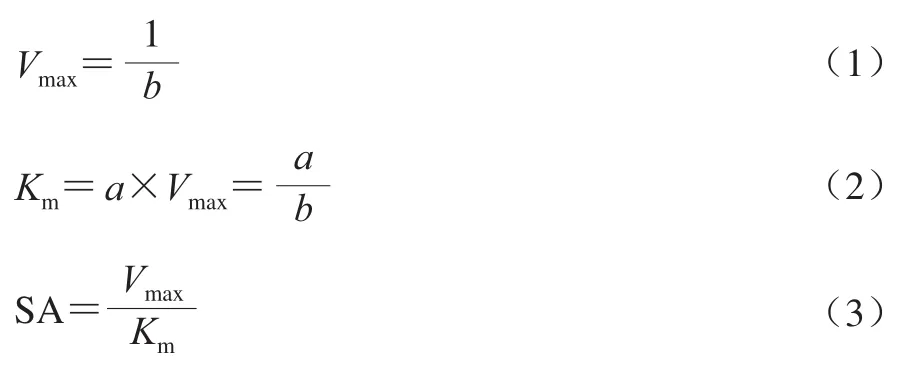
1.3.4.2 最适pH值的确定
用0.1 mol/L磷酸盐缓冲液将PPO活性测定体系的pH值范围调整到4.0~8.0之间,并按照0.4的pH值衡量单位以确定PPO的最适反应pH值。以邻苯二酚溶液为底物,待邻苯二酚溶液在指定pH值(pH 4~8)平衡后,迅速加入PPO,测定其420 nm的吸光度,后续实验均采用最佳pH值。
1.3.4.3 反应时间对PPO活性的影响
为确定PPO的最适反应时间,以邻苯二酚为底物,加入0.3 mL含0.1 mol/L磷酸盐缓冲液(pH 6.8)的粗酶液,在10~210 s的时间内进行反应,在设定的反应时间每间隔10 s取样测定PPO活性。
1.3.4.4 最适反应温度和热稳定性的确定
将含有2.7 mL 14 mmol/L邻苯二酚作为底物的0.1 mol/L磷酸缓冲液(pH 6.8)在指定温度(20、30、40、50 ℃)分别保温3 min后,加入相同温度中保温3 min的粗酶液0.3 mL,每隔10 s检测420 nm波长处吸光度的变化以确定温度对酶活性的影响。为了确定PPO的热稳定性,按照上述方法将底物溶液分别在60、70、80、90 ℃的条件中保温1 min后加入0.3 mL粗酶液,每隔10 s取样,并置于0 ℃冰水浴以冷却样品,然后用吸光度表征PPO活性的变化。
1.3.4.5 抑制剂对PPO活性的影响
为了测定PPO在不同浓度抑制剂存在时的活性,以14 mmol/L邻苯二酚溶液为底物,探究不同浓度(0.5、1.0、1.5、2.0 mmol/L)的抗坏血酸、L-半胱氨酸、柠檬酸和焦亚硫酸钠对PPO活性的抑制作用。同样参照Lineweaver-Burk作图法,根据Zhou Xiran等[23]的方法可求得最大反应速率Vmax、米氏常数Km。
1.4 数据统计分析
2 结果与分析
2.1 PPO分离纯化结果
实验的分离纯化步骤主要包括:利用提取缓冲液进行简单的提取得到粗酶液770 mL,进而测定了PPO的总活力、蛋白含量、比活力等指标;30%~80%的硫酸铵对粗酶液进行分级沉淀后,得到117 mL酶液;磷酸盐溶液透析后,得到302 mL酶液;将粗酶液进行超滤处理得到的蛋白液为45 mL;将超滤之后的粗酶液通过DEAE-SFF纯化,得到27 mL酶液;再通过Superdex G-75处理后得到5 mL目的蛋白酶。由表1可知,大部分杂蛋白在DEAE-SFF、Superdex G-75色谱柱的纯化过程中被去除,PPO比活力从初始值4 312.60 U/mg增加到27 471.26 U/mg,纯化倍数达到粗酶的6.37 倍,回收率为5.29%。说明整个纯化步骤,特别是运用DEAESFF、Superdex G-75色谱柱的方法是纯化PPO的有效方法。与其他果蔬比,芋头PPO比活力(27 471.26 U/mg)明显低于黄金梨(519 895.73 U/mg)[23]、富士苹果(370 004.30 U/mg)[24]以及琉璃苣(410 090 U/mg)[25],而高于金银花(4 458.24 U/mg)[26]和茄果(5.95 U/mg)[27],可见果蔬的PPO活性存在品种依赖性。
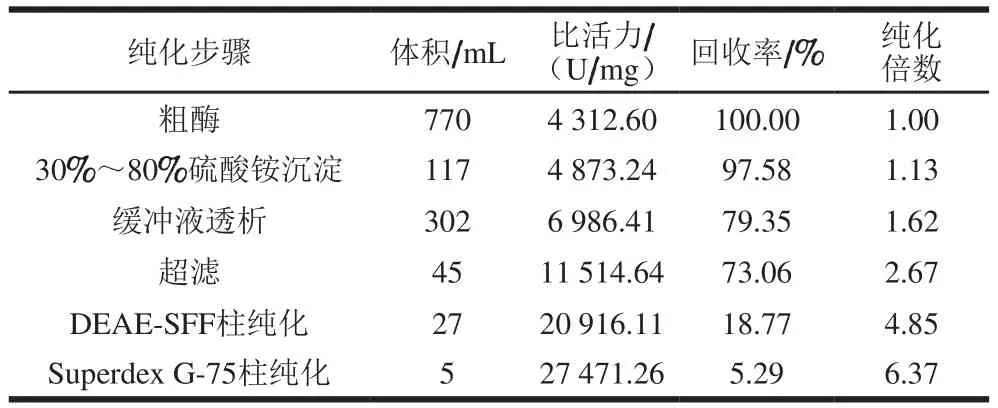
表1 芋头中PPO的分离纯化结果Table 1Summary of the isolation and purification of PPO from taro
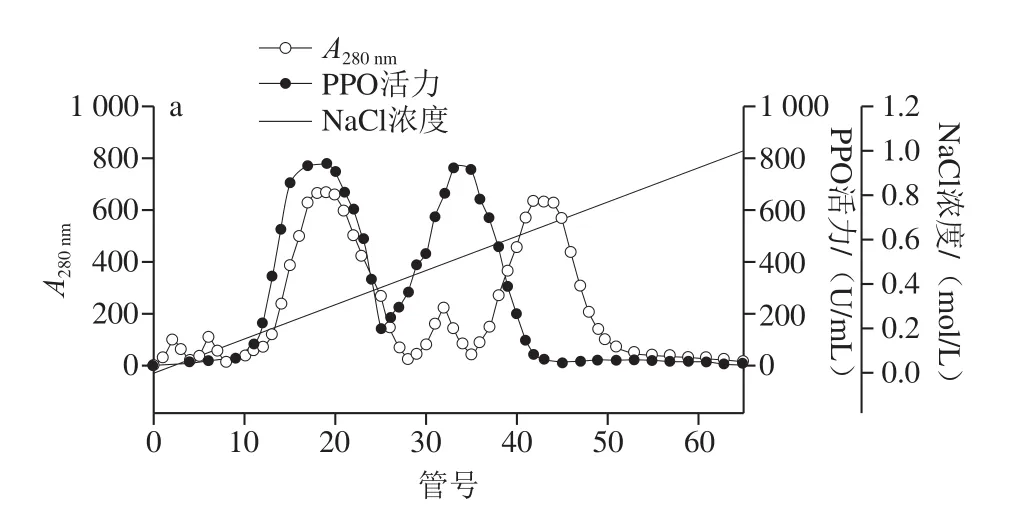
由图1a可以看出,利用NaCl梯度洗脱后从DEAESFF色谱柱得到5 个蛋白峰,洗脱曲线在第3、4个峰具有较高的酶活性。其中第3个峰时活性最高,达到761.752 U/mL,因此将活性峰组分(9~42管)合并,并利用Superdex G-75色谱柱进一步纯化。如图1b所示,通过对洗脱液的收集以及对每管洗脱液的酶活力检测可以发现,第2峰收集的洗脱液检测到的酶活性最高,达到674.285 U/mL,证明第30~65管收集的是目的蛋白。第1个蛋白峰(1~29管)和最后一个蛋白峰(66~100管)的活性很低,说明这2 部分的主要成分不是纯蛋白,本实验结果与Zaini等[13]的洗脱结果相似。
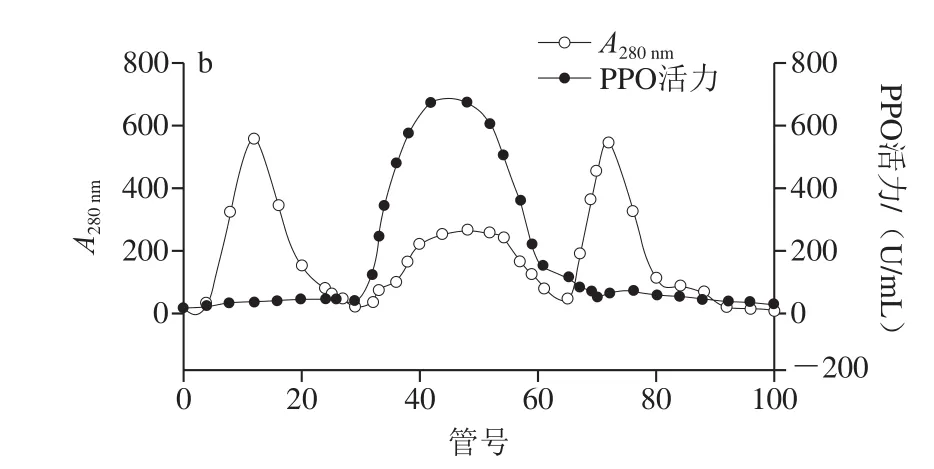
图1 芋头PPO粗酶经DEAE-SFF色谱柱处理的离子交换层析图(a)和Superdex G-75凝胶色谱柱(b)洗脱曲线Fig.1 Chromatographic elution profiles of crude PPO on DEAE-SFF column (a) and Superdex G-75 column (b)
2.2 PPO纯度及分子质量的确定
实验通过Native-PAGE和SDS-PAGE对6 步分离纯化得到的PPO样品进行分析,结果如图2所示。利用Native-PAGE检测到泳道2、3、4、5均有3 个蛋白条带,其分子质量分别约为12、24、66 kDa。SDS-PAGE分析了经DEAE-SFF柱和Superdex G-75柱洗脱后的PPO样品。泳道6有2 个蛋白条带,这表明PPO样品尚未完全纯化。因此,通过Superdex G-75柱进一步纯化PPO,结果泳道7出现单一条带,此现象说明Superdex G-75柱洗脱后得到了电泳纯PPO。说明Superdex G-75柱对芋头PPO纯化十分有效,达到了去除杂蛋白、纯化目的酶的作用。由SDS-PAGE变性电泳可以判定芋头PPO的分子质量约为24 kDa。目前,关于果蔬中PPO分子质量的研究比较广泛,如Waliszewski等[28]发现香草豆PPO分子质量为34 kDa,Navarro等[29]发现柿子PPO分子质量为60 kDa,Mishra等[30]发现茄子PPO分子质量为56 kDa。
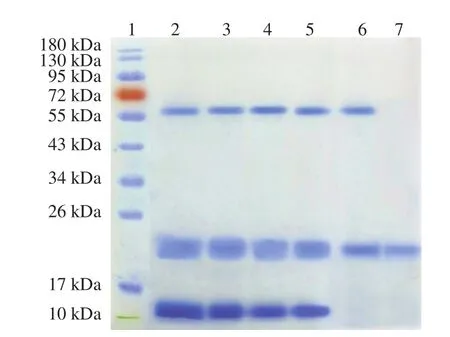
图2 芋头不同分离提取和纯化阶段PPO的Native-PAGE和SDS-PAGE图谱Fig.2 Native-PAGE and SDS-PAGE patterns of crude and purified PPO
2.3 芋头PPO主要参数的确定
本实验以邻苯二酚、间苯二酚、间苯三酚、焦性没食子酸和L-酪氨酸为底物,探究了芋头PPO粗酶的底物特异性。实验以邻苯二酚共5 种底物与芋头PPO粗酶反应,将产物在300~900 nm范围内进行全波长扫描,如图3a所示,得到产物的最大吸收波长为420 nm。蓝莓[18]和西兰花[31]中PPO的最大吸收波长也为420 nm。然而,栗子仁PPO的最大吸收波长为470 nm[32],而黄金梨PPO的最大吸收波长为412 nm[23],酚类化合物是PPO的重要底物,PPO的底物特异性因植物来源而异。因此,果蔬PPO的最大吸收波长随其来源而变化。底物种类以及浓度对芋头PPO活性的影响关系,侧面反映了不同底物与芋头PPO的亲和力。
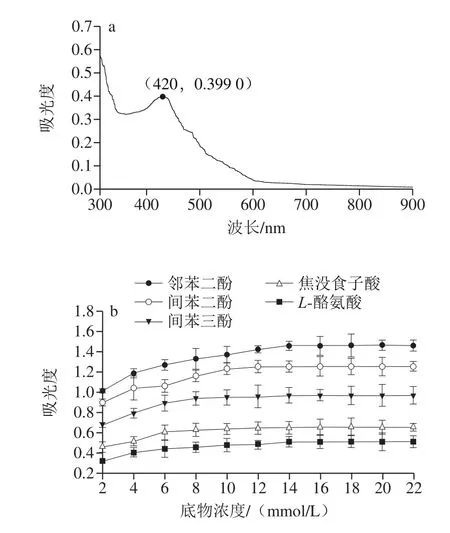
图3 PPO参数的确定(a)及底物特异性分析(b)Fig.3 Confirmation of PPO parameters (a) and substrate specificity of PPO (b)
如图3b所示,以邻苯二酚为底物时,芋头PPO活性远高于以其他酚类物质为底物时的活性。当邻苯二酚浓度在2~8 mmol/L时,PPO活性随着底物浓度的增大而呈现明显的上升趋势,在8~14 mmol/L时PPO活性上升缓慢,当底物浓度大于14 mmol/L时,PPO活性不再上升,因此邻苯二酚的最佳浓度为14 mmol/L;当间苯二酚和间苯三酚为底物时,变化趋势与邻苯二酚相似,但PPO活性较邻苯二酚低。以焦没食子酸和L-酪氨酸为底物时的芋头PPO活性很低,且其活性随底物浓度增大而几乎没有显著变化。此结果与洋蓟头[33]、欧芹[34]PPO的结果一致。然而,茄果PPO对4-甲基邻苯二酚的亲和力比邻苯二酚高[27]。因此,可以通过减少相应的酚类底物控制食品加工过程中的酶促褐变。
一般而言,Vmax/Km比值可以表征PPO SA的大小,比值越大表明亲和力越大[34]。由表2可知,本实验的5 种底物对芋头PPO的亲和能力差异明显,该酶与底物的结合能力顺序为:邻苯二酚>间苯二酚>间苯三酚>焦性没食子酸>L-酪氨酸,说明芋头PPO对邻苯二酚的亲和力最大。
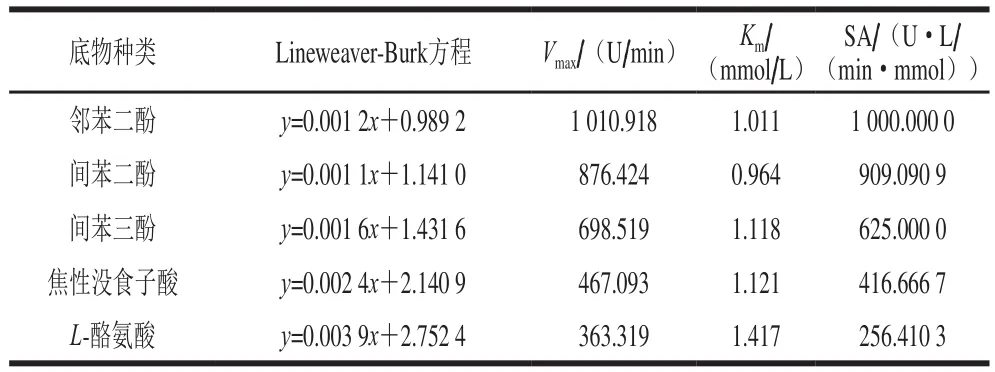
表2 芋头PPO与不同底物反应的动力学参数Table 2 Kinetic parameters for the reaction between taro PPO and different substrates
2.4 pH值、温度和反应时间对PPO粗酶活性的影响
图4a表明,PPO活力在pH 4.0~6.0之间几乎保持不变,从pH值大于6.0才开始急剧增加,在pH 6.8时,活性最高,因此芋头PPO的最佳反应pH 6.8。此发现与其他学者的研究结论一致,每种果蔬的PPO都有最佳的pH值,如栗仁[32]和巴巴多斯樱桃[35]的最佳pH值均为7.0,板栗[36]、枇杷果[37]和马拉蒂亚杏[38]PPO的最佳pH值分别为5.0、4.5和8.5。
由图4b可以看出,PPO活力随反应时间的延长而显著增加。在反应初期,PPO活力呈线性趋势上升,表明反应速率在此阶段达到最大值。当反应时间超过60 s时,增加速率变得缓慢,并且斜率在120 s后显著变小且几乎不再变化,说明此时PPO酶促反应已经结束。因此,芋头PPO最佳反应时间为60 s。此外,反应温度对PPO的反应动力学和酶液中氧溶解度有一定影响,因此研究温度对PPO活性的影响也是至关重要的。如图4c所示,芋头PPO活力在30 ℃达到最大值,再升高或降低温度,酶活性均逐渐降低,说明芋头PPO的最佳反应温度为30 ℃。温度低于30 ℃时,底物分子的动能随温度的升高而增大,PPO活性保持稳定增加的趋势;当温度超过30 ℃,特别是高于40 ℃时,过高的温度破坏了PPO活性中心的稳定性,导致蛋白分子本身结构或结合底物的构象被破坏,使得芋头PPO变性。在80 ℃加热80 s或90 ℃加热70 s后,PPO完全变性失活。因此,在加工过程中可以通过冷藏或热烫的方法抑制褐变的产生。综合已有报道可知,PPO的最佳温度一般在10~60 ℃范围内,如Unal[19]和Doğan等[39]报道了香蕉和迷迭香的最佳反应温度均为30 ℃。然而Lin Haibin等[40]发现,香菜PPO在90 ℃加热40 min后,其活性仅降低到15%,说明其耐热性较强,此现象与芋头PPO的实验结果差距较大。
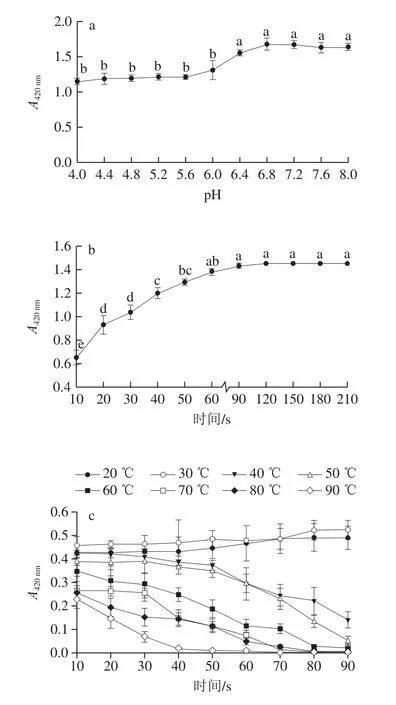
图4 不同实验条件对PPO特性的影响Fig.4 Influence of different conditions on enzymatic characteristics of PPO
综上,PPO活性的最佳pH值和温度取决于果蔬种类、底物以及提取方法。在芋头加工和保鲜时,可以通过严格地控制反应温度、时间和pH值,抑制芋头加工过程中褐变的发生。
2.5 抑制剂对芋头粗酶PPO活性的影响
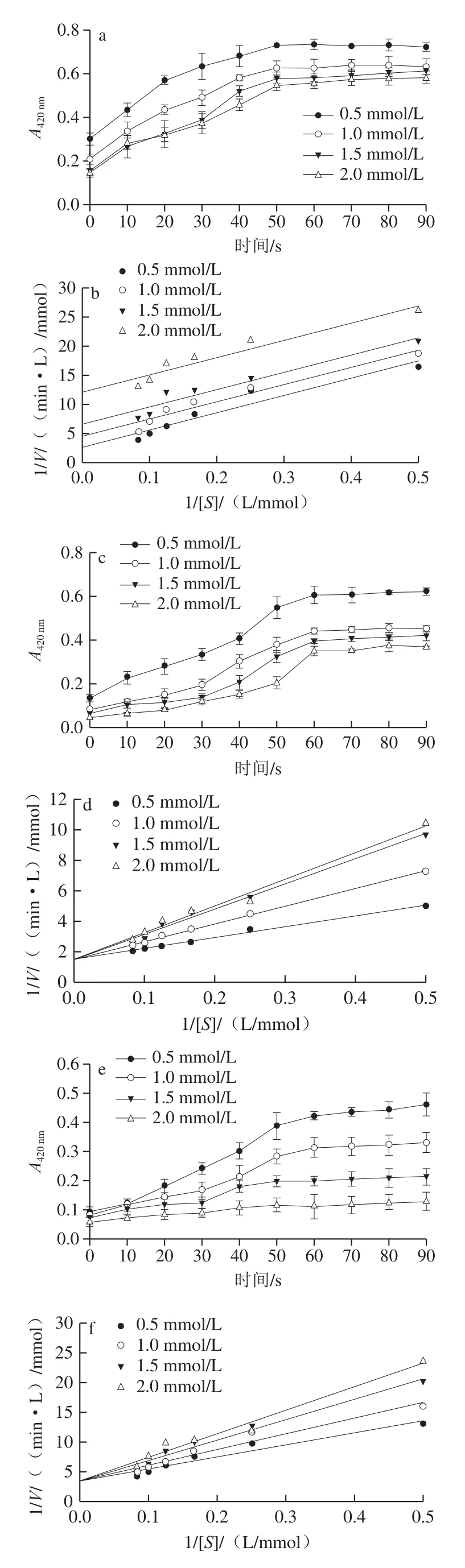
加工过程中添加适量抑制剂是防止果蔬酶促褐变的有效方法,抑制剂的作用方式取决于抑制剂种类和底物类型,抑制剂主要通过形成无色产物或防止邻苯醌的积累以阻碍黑色素的产生[41]。目前已发现许多化合物具有抑制PPO活性的功能,本实验研究了不同浓度的抗坏血酸、L-半胱氨酸、柠檬酸和焦亚硫酸钠对芋头PPO活性的抑制作用。
从图5可以看出,反应混合物的吸光度均随着抑制剂浓度的增加而降低。以酶的反应初速度对底物浓度作Lineweaver-Burk双倒数图,用于判定不同抑制剂对芋头PPO的抑制机理。由图5a可知,抗坏血酸浓度(0.5、1.0、1.5、2.0 mmol/L)增加时,得1 组斜率不变的平行直线,Km值减小,Vmax也减小,说明抗坏血酸是反竞争性抑制剂。反竞争性抑制剂不能与游离的酶分子结合,而只能通过与酶底物络合物结合,阻断酶促反应,抑制褐变的发生,而且随着浓度增大,结合力也增强。由图5d、f可知,L-半胱氨酸和柠檬酸所得双倒数曲线在纵轴分别交于相同点,即2 种抑制剂不改变最大反应速度Vmax,而直线的斜率随抑制剂浓度的增大而增加,Km随抑制剂浓度的增大而增加,所以二者的抑制机理属于竞争性抑制。与反竞争性抑制不同,L-半胱氨酸和柠檬酸只能与游离酶结合,从而阻止底物与酶的反应,而不能与酶底物络合物结合。图5d得到1 组相交于横轴上1 点的直线,说明酶促反应的Km不变,但Vmax随着抑制剂浓度增大而下降,其抑制机理表现为非竞争性类型,即焦亚硫酸钠和底物都能与游离酶结合,而且2 个结合过程相互不影响。
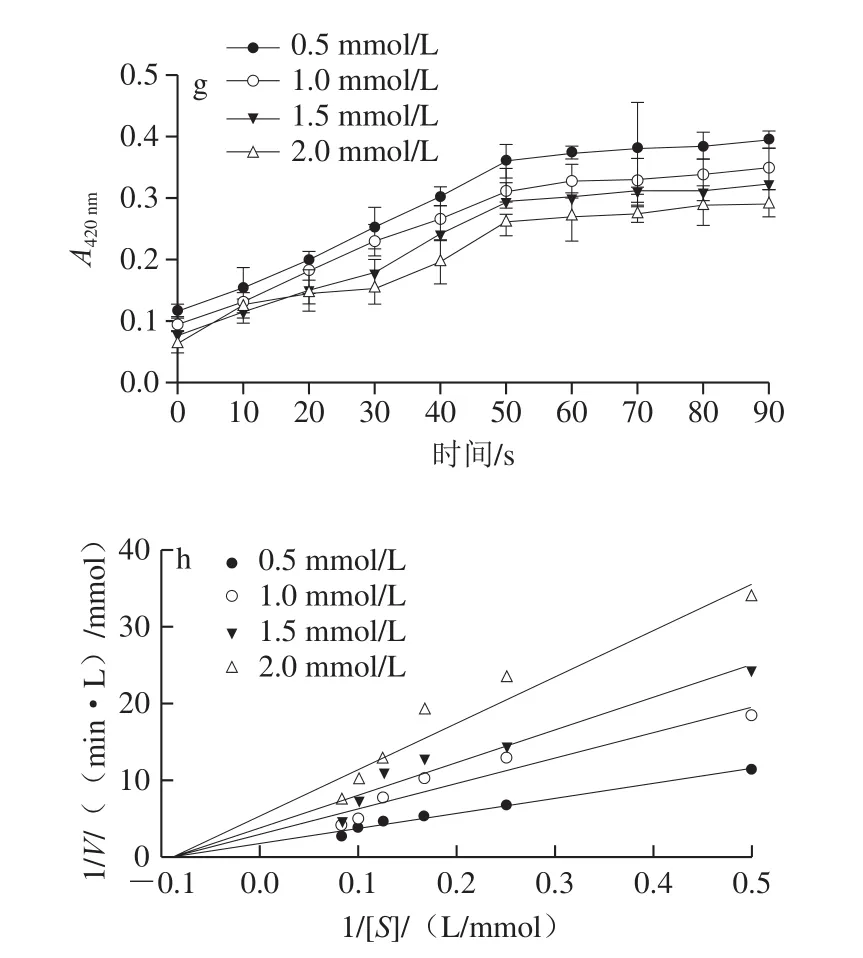
图5 不同抑制剂对芋头PPO活性的影响Fig.5 Effect of different inhibitors on PPO activity from taro
Km的能够反映抑制剂对PPO的作用效果,Km越小,抑制剂越有效。本实验中,抗坏血酸Km值最低(2.458 5 mmol/L),其次为L-半胱氨酸(4.754 6 mmol/L)、柠檬酸(5.997 4 mmol/L)和焦亚硫酸氢钠(11.203 9 mmol/L)。因此,对于芋头PPO,抗坏血酸比其他抑制剂更有效,L-半胱氨酸抑制效果仅次于抗坏血酸,而焦亚硫酸钠最弱。如图5a所示,即使在0.5~2.0 mmol/L的低浓度条件,抗坏血酸也会明显抑制芋头PPO活性。这可能是因为抗坏血酸的强还原作用,将PPO生成的邻醌还原为酚类化合物,阻止醌类物质的进一步氧化聚合,并作为抗坏血酸酶的底物把溶解的氧分子消耗掉,从而起到良好的抑制褐变效果。Derardja等[42]也发现,0.1 mmol/L和0.2 mmol/L的抗坏血酸对杏PPO有良好的抑制效果,PPO的相对活性分别降低至66%和55%,这说明抗坏血酸是PPO较理想的抑制剂。因此,可以根据芋头加工过程的实际条件选择合适的抑制剂。
3 结 论
新鲜芋头在加工和贮藏时,切片白度下降,表观颜色褐变明显。大量报道证实,果蔬褐变必须具备多酚物质、氧气及PPO共3 种物质,其中控制PPO活性相对比较容易,所以通过研究芋头PPO的酶学特性抑制褐变可行。本实验研究表明,采用提取液匀浆提取、硫酸铵沉淀、透析和超滤浓缩得到PPO粗酶液,再将粗酶液经过DEAESFF色谱柱的离子交换层析和Superdex G-75凝胶柱的层析处理是提取和纯化芋头PPO的有效方法。纯化后芋头的PPO分子质量约为24 kDa,能够达到电泳纯。PPO的比活力为27 471.26 U/mg,纯化倍数达到6.37 倍。芋头PPO对邻苯二酚的亲和力最高,当反应时间为60 s时,PPO活性最大。以邻苯二酚为底物时,PPO的最适检测波长、最佳pH值和温度分别为420 nm、pH 6.8和30 ℃。另外,在所检测的抑制剂中,抗坏血酸对芋头PPO的抑制效果最好,其抑制类型为反竞争性抑制。综上可知,为控制芋头加工和贮藏过程中的褐变,应从抑制其PPO活性的方面采取措施,如低温贮藏、在低温贮藏前进行短时间高温处理、调节pH值、利用效果较好的抑制剂对其切片进行护色处理等。本实验为进一步提升芋头加工和贮藏过程的品质提供了理论参考。
