醛酮还原酶AKR1C3介导乳腺癌阿霉素耐药的作用及其机制
2021-07-08王凯振杨婉婉徐晟瑶郭青龙
王凯振,杨婉婉,徐晟瑶,郭青龙,赵 丽
(中国药科大学基础医学与临床药学学院,南京210009)
乳腺癌(breast cancer,BC)是女性中最常见的肿瘤[1-2]。其治疗方案包括手术切除、化疗、放疗和联合治疗[3]。化疗的耐药性一直是困扰BC患者临床治疗的难题[4]。阿霉素(doxorubicin,DOX)是被广泛使用的一线化疗药物,可以显著降低乳腺癌的复发风险和病死率[5]。但是,乳腺癌患者在化疗过程中会对阿霉素产生耐药性。当细胞暴露于累积剂量的阿霉素时,细胞会产生多药耐药表型,而且阿霉素耐药细胞通常也会对其他化疗药物表现出显著的交叉耐药[6]。
AKR1C3是醛酮还原酶家族(aldo-keto reduc⁃tases,AKRs)的一员,是体内类固醇代谢的关键酶,AKR1C3异常表达会导致类固醇代谢紊乱,从而引起各种疾病。AKR1C3参与了体内性激素的合成,在性激素依赖性的疾病中起着举足轻重的作用。它可以作用于雄激素受体(AR)、雌激素受体(ER)和孕激素受体(PR)来调节雄激素、雌激素和孕激素的含量[7]。近年来,AKR1C3在多种肿瘤中的促癌作用已被证实[8-9],但在乳腺癌发生与发展中的作用及作用机制却存在争议[9]。为进一步研究AKR1C3在乳腺癌耐药中的作用和内在机制,本研究构建了乳腺癌阿霉素耐药细胞株及AKR1C3高表达和敲低细胞株,以此为研究对象,揭示其对阿霉素耐药的介导作用,为临床乳腺癌的治疗提供新思路与方法。
1 材料
1.1 药品和试剂
阿霉素(上海阿拉丁生化科技股份有限公司);DMEM培养基,RPMI 1640培养基,胎牛血清(FBS)及0.25%胰蛋白酶溶液(美国Gibco公司);β-catenin特异性抑制剂XAV939(上海基屹生物科技有限公司);嘌呤霉素(无锡纳奥生物医药有限公司);AKR1C3过表达质粒OE(北京安诺伦生物科技有限公司);AKR1C3敲低质粒shRNAAKR1C3(苏州吉玛基因股份有限公司);质粒提取试剂盒(北京康为世纪生物科技有限公司);慢病毒转染试剂盒(上海翊圣生物技术股份有限公司);DAPI染色试剂盒(上海碧云天生物技术股份有限公司);核浆分离试剂盒(南京凯基生物技术股份有限公司);Bcl-2,Bax一抗(武汉Abclonal公司);AKR1C3(英国Abcam公司);Wnt3a,p-GSK-3β,β-catenin,LaminA/C,β-actin一抗(武汉protein⁃tech公司);HRP山羊抗兔IgG和HRP山羊抗鼠IgG(武汉Abclonal公司)。其余试剂均为市售分析纯。
1.2 仪器
正置荧光显微镜(德国Leica公司);化学发光成像仪(上海天能科技有限公司);多功能酶标仪,PCR扩增仪(美国Thermo公司)。
1.3 细胞株
人乳腺癌细胞MCF-7(中国科学院上海细胞所)。
2 方法
2.1 细胞培养
将MCF-7细胞接种于含10%FBS,1%青霉素-链霉素溶液的DMEM高糖培养基中,置于37℃、5%CO2恒温细胞培养箱中培养,每2~3天传代1次,取对数生长期细胞进行实验。
2.2 建立耐药细胞系
采用浓度梯度递增法[10],建立阿霉素乳腺癌MCF-7耐药细胞系并命名为MCF-7/DOX。首先,在无菌避光条件下称取一定量的阿霉素固体粉末于EP管中,加入无菌水,避光超声使之充分溶解,使母液浓度为10 mmol/L,过滤除菌后于-20℃避光保存。然后,将接种的MCF-7细胞在0.5μmol/L阿霉素的DMEM培养基中培养,洗掉死亡细胞,稳定细胞后增加阿霉素药物剂量,逐步筛选,最终得到的耐药细胞株命名为MCF-7/DOX。
2.3 构建稳定过表达和敲低AKR1C3细胞株
将AKR1C3过表达质粒OE和AKR1C3敲低质粒shRNA-AKR1C3用慢病毒转染试剂盒进行转染,收集病毒上清液,过滤分装于-80℃保存。用病毒上清液侵染MCF-7和MCF-7/DOX细胞,然后用2μmol/L嘌呤霉素进行抗性筛选两周后,选出一个稳定生长的细胞进行单克隆培养,最终得到稳定高表达AKR1C3的MCF-7细胞株(MCF-7/AKR1C3)和稳定低表达AKR1C3的MCF-7/DOX的细胞株(MCF-7/DOX-KD)。
2.4 CCK-8法检测细胞活力
取对数期生长状态良好的MCF-7和MCF-7/DOX细胞,消化后以每孔1×104个细胞的密度接种于96孔板上,24 h后,加入含有不同浓度的阿霉素的培养基,继续培养24 h或48 h后,每孔加入CCK-8溶液10μL,37℃孵育1 h,使用酶标仪在450 nm处检测吸收度,计算细胞活力,实验平行测定3次。耐药指数(RI[10])=耐药细胞IC50/亲本细胞IC50。
2.5 DAPI染色检测细胞凋亡
取对数生长期状态良好的MCF-7和MCF-7/DOX细胞,消化后以每孔1×105个细胞的密度接种在提前放置好玻片的6孔板中,待细胞爬片稳定后加入不同浓度含有阿霉素的培养基,培养24 h后,取出细胞爬片按照DAPI染色试剂盒操作进行染色,最后用荧光显微镜拍照观察凋亡情况。
2.6 集落形成实验检测细胞的增殖
将对数生长期状态良好的MCF-7和MCF-7/DOX细胞置于6孔板中,每孔1 000个细胞,用阿霉素处理后培养12~14 d。存活细胞克隆用4%甲醛固定20 min后,用0.1%结晶紫染色20 min,冲洗干净晾干后进行拍照观察细胞增殖情况。
2.7 Western blot检测Wnt/β-catenin通路蛋白及凋亡蛋白的表达
将对数生长期状态良好的MCF-7、MCF-7/AKR1C3、MCF-7/DOX以及MCF-7/DOX-KD的细胞,消化后以每孔6×105个细胞的密度接种于6孔板上,培养至细胞覆盖率为80%以上,收集细胞。用细胞裂解液提取各组细胞蛋白,BCA蛋白定量法测定细胞蛋白浓度,在样品中加入4×蛋白质上样缓冲液使用100℃金属浴加热10 min进行蛋白变性;进行SDS-PAGE电泳(浓缩胶:90 V,30 min;分离胶120 V,90 min),电泳后转膜2 h至硝酸纤维素膜(NC膜)上,使用5%脱脂奶粉溶液封闭60 min;一 抗(β-actin、LaminA/C、β-tubulin、AKR1C3、Wnt3a、p-GSK-3β、β-catenin、Bax、Bcl-2,1∶1 000)4℃孵育过夜;使用PBST清洗3次,每次10 min,加入HRP山羊抗兔IgG和HRP山羊抗鼠IgG二抗(1∶5 000)摇动孵育1 h;PBST清洗3次,使用蛋白成像系统进行检测。
2.8 QRT-PCR检测AKR1C3基因的表达
将对数生长期状态良好的MCF-7、MCF-7/AKR1C3、MCF-7/DOX以及MCF-7/DOX-KD的细胞均匀接种在6孔板上,培养至细胞覆盖率为80%以上。收集细胞,使用Trizol法提取RNA,逆转录得到cDNA,加入SYBR Green,使用实时PCR系统进行实时扩增。扩增条件为:95℃15 s,60℃1 min,95℃1 min,65℃10 s,一共35个循环。采用GAP⁃DH作为内参,所用引物序列如表1。
2.9 核浆分离检测β-catenin的入核变化
将对数生长期状态良好的MCF-7、MCF-7/AKR1C3、MCF-7/DOX以及MCF-7/DOX-KD细胞,消化后以每孔6×105个细胞的密度接种于6孔板上,继续培养至细胞覆盖率为80%以上。收集细胞,用核浆分离试剂盒提取与分离核浆蛋白,得到蛋白样品后按照“2.7”项方法进行实验。
2.10 免疫荧光检测β-catenin在细胞核内外的分布
取对数生长期状态良好的MCF-7、MCF-7/AKR1C3、MCF-7/DOX以及MCF-7/DOX-KD细胞,接种于提前放置好玻片的6孔板上,加入培养基培养24 h后取出6孔板。用PBS洗3次,每次5 min。4%多聚甲醛固定5 min后,加入0.3%Triton反应5~15 min,PBS洗3次,每次5 min。然后,加入3%BSA封闭2 h;PBS洗3次,每次5 min。加入βcatenin一抗80~100μL(1∶100)后,置于37℃,1 h后,4℃过夜。然后,PBST洗3次,每次5 min。避光,加入HRP山羊抗兔IgG二抗溶液,常温反应30~40 min,PBST洗4次,每次5 min。最后,加入含抗荧光淬灭剂的DAPI封片液进行封片;封片后,在荧光显微镜下观察并拍照。
2.11 统计学分析
所有实验至少重复3次,结果以xˉ±s表示。实验数据使用GraphPad Prism 5软件进行统计学分析。以P<0.05为差异有统计学意义。
3 结 果
3.1 阿霉素耐药乳腺癌细胞株的建立
本研究采用浓度梯度递增法,成功建立了对阿霉素耐药的乳腺癌细胞株MCF-7/DOX。用CCK-8细胞药物敏感实验,检测到阿霉素对MCF-7细胞的IC50为(2.865±0.042 13)μmol/L,而对MCF-7/DOX细胞的IC50为(171.0±0.027 23)μmol/L(图1-A,图1-B)。MCF-7/DOX细胞对阿霉素的耐药指数(RI)约为60倍。
为了进一步验证耐药细胞株MCF-7/DOX对阿霉素的耐药性,用DAPI染色检测凋亡细胞情况。如图1-C所示,1.0、2.0μmol/L阿霉素处理对数生长期的细胞24 h后,相比于耐药细胞MCF-7/DOX,敏感株细胞MCF-7可以明显观察到核质浓缩,核膜核仁破碎,大小不一内含核碎片的凋亡小体,表示细胞发生更多的凋亡。

Figure 1 Effects of different concentrations of doxorubicin(DOX)on cell viability and apoptosis in MCF-7 and doxorubicin-resistant cell line MCF-7/DOX(xˉ±s,n=3)
3.2 AKR1C3在耐药乳腺癌细胞中表达水平上调
已有报道表明,在乳腺癌细胞中AKR1C3的表达水平较正常乳腺细胞中高[8],而且AKR1C3的上调常常与不良预后有关[11]。在本研究中,Western blot实验发现,在乳腺癌耐药细胞株MCF-7/DOX中,AKR1C3的表达水平较敏感株乳腺癌细胞MCF-7明显升高(图2-A)。同时,QRT-PCR实验结果也显示,耐药细胞株MCF-7/DOX中,AKR1C3水平升高了约251.3倍(图2-B)。上述结果表明,在乳腺癌耐药细胞中,AKR1C3表达水平上调可能与阿霉素耐药的产生有关。
3.3 AKR1C3介导乳腺癌细胞MCF-7对阿霉素耐药
为了进一步研究AKR1C3在乳腺癌阿霉素耐药中的作用,本研究在MCF-7细胞中稳定过表达AKR1C3蛋白,构建过表达细胞株MCF-7/AKR1C3。实验结果表明,过表达细胞株MCF-7/AKR1C3中AKR1C3蛋白表达明显上调(图3-A),AKR1C3的mRNA水平提高了157倍(图3-B)。
本研究通过CCK-8实验验证MCF-7/AKR1C3细胞对阿霉素的敏感性。结果显示,阿霉素对MCF-7/AKR1C3和MCF-7细胞的IC50分别为(14.460±0.043)μmol/L和(2.425±0.034)μmol/L。MCF-7/AKR1C3细胞对阿霉素的耐药指数(RI)约为6(图3-C)。集落形成实验结果显示,1μmol/L和2μmol/L的阿霉素对于MCF-7/AKR1C3细胞的集落形成能力几乎无影响,却可以显著地抑制MCF-7细胞的集落形成(图3-D)。DAPI染色结果也发现,阿霉素对MCF-7/AKR1C3细胞凋亡几乎无影响,而低浓度的阿霉素却可以诱导MCF-7细胞发生明显的核膜核仁破碎,染色质固缩成新月形聚集,凋亡小体形成,细胞发生更多的凋亡(图3-E)。
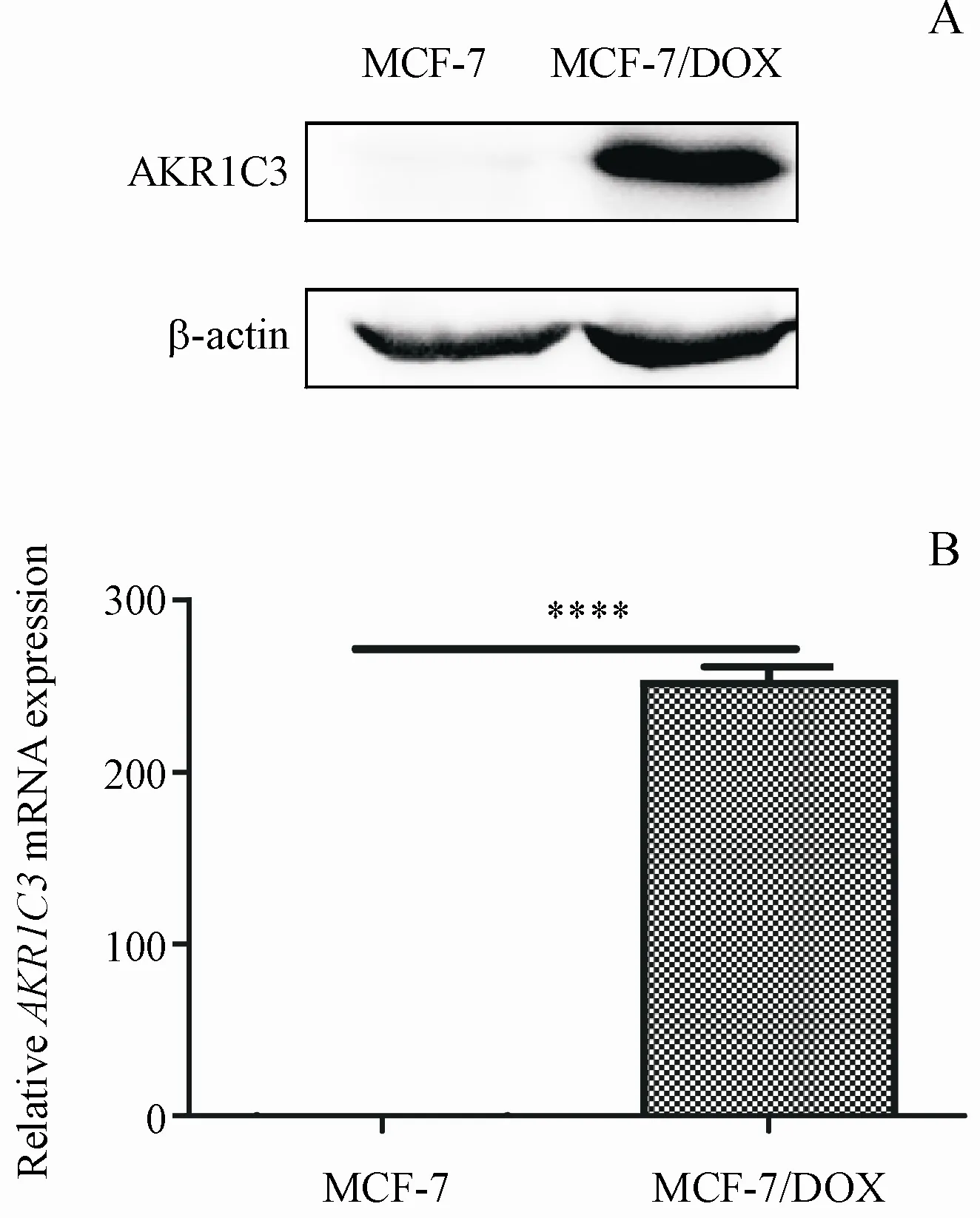
Figure 2 Expression of AKR1C3 in MCF-7 and MCF-7/DOX cells(xˉ±s,n=3)
为了进一步确证AKR1C3介导乳腺癌细胞耐药的作用,本研究构建了敲低MCF-7/DOX的AKR1C3的细胞株MCF-7/DOX-KD,并检测了其对阿霉素的敏感性(图3-F,3-G),CCK-8实验结果显示,阿霉素对MCF-7/DOX和MCF-7/DOX-KD细胞的IC50分别为(186.5±0.021 17)μmol/L和(95.16±0.036 46)μmol/L,降低了约50%(图3-H)。
以上结果表明,过表达AKR1C3可增加乳腺癌细胞对阿霉素的耐药性,低表达AKR1C3会增加细胞对阿霉素的敏感性,证实了AKR1C3在乳腺癌细胞阿霉素耐药中具有介导作用。
3.4 β-catenin通路参与AKR1C3介导乳腺癌细胞阿霉素耐药的过程
有报道称β-catenin与许多肿瘤的耐药性密切相关[12-13]。为了研究AKR1C3介导的乳腺癌细胞阿霉素耐药与β-catenin的关联性,本研究检测了在AKR1C3高表达细胞MCF-7/AKR1C3中Wnt/βcatenin通路蛋白表达情况。如图4-A所示,Wnt3a和p-GSK-3β均高表达,说明MCF-7/AKR1C3细胞中该通路被激活。核浆分离结果发现,MCF-7/AKR1C3细胞中胞质β-catenin含量减少,核内表达增多(图4-B),同时免疫荧光结果也印证MCF-7/AKR1C3细胞中β-catenin入核增多(图4-C)。
在敲低AKR1C3之后,免疫荧光结果表明胞质β-catenin含量增多,核内表达减少(图4-D),这与Western blot结果中的Wnt/β-catenin通路受到抑制,核内β-catenin含量减少一致(图4-E,4-F)。以上结果表明,β-catenin可能参与了AKR1C3对乳腺癌细胞阿霉素的介导作用。
3.5 β-catenin抑制剂XAV939能够逆转AKR1C3介导的阿霉素耐药
为了进一步确证β-catenin在AKR1C3诱导的阿霉素耐药中的作用,本研究使用β-catenin特异性抑制剂XAV939来抑制胞内β-catenin的表达水平。结果表明,XAV939不仅会抑制β-catenin总蛋白水平,也会其降低核内的表达水平(图5-A)。CCK-8实验结果显示,10μmol/L XAV939与阿霉素联用能显著提高阿霉素对MCF-7/AKR1C3乳腺癌细胞的抑制率(IC50=5.340±0.065μmol/L),与单用阿霉素相比IC50降低了约70%(图5-B)。同时,凋亡相关蛋白的检测也发现XAV939能显著提高阿霉素对MCF-7/AKR1C3细胞中凋亡蛋白Bax的表达,并减低抗凋亡蛋白Bcl-2的表达(图5-C)。以上结果说明,AKR1C3诱导的阿霉素耐药部分由β-catenin通路介导。
4 讨 论
本研究探讨了AKR1C3/β-catenin轴在乳腺癌阿霉素耐药中的作用,证明了AKR1C3可能通过Wnt/β-catenin介导了MCF-7细胞的阿霉素耐药。关于AKR1C3参与乳腺癌阿霉素耐药虽然已有报道,但大多数报道认为,AKR1C3是作为氧化还原酶,将阿霉素还原成低毒性的阿霉素醇,从而降低了阿霉素的毒性作用。本研究主要探讨AKR1C3在生物调控网络中的作用,旨在阐明其酶活之外的阿霉素耐药的介导作用。
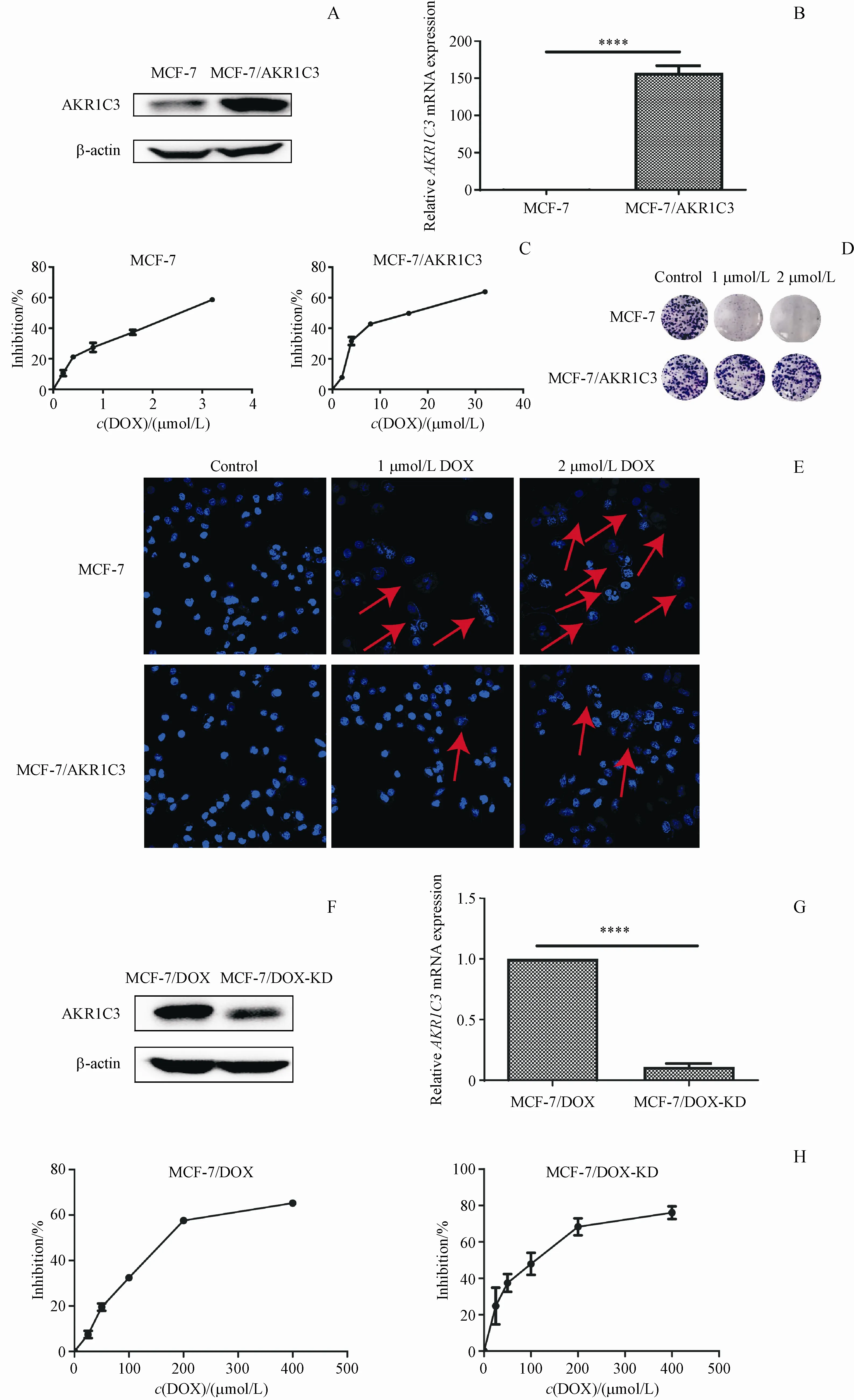
Figure 3 Effect of AKR1C3 on thesensitivity of DOX in MCF-7 cells(xˉ±s,n=3)

Figure 4 Effect of AKR1C3 on the Wnt/β-catenin pathway in MCF-7 and MCF-7/DOX cells(xˉ±s,n=3)
本研究发现AKR1C3在阿霉素耐药的乳腺癌细胞中高表达。AKR1C3基因过表达或敲低可增强或抑制乳腺癌细胞的阿霉素耐药性,这反映在细胞活力、集落形成能力和凋亡的结果上。深入研究发现,AKR1C3诱导的阿霉素耐药性可能与βcatenin信号通路相关。过表达的AKR1C3促进βcatenin的入核,增强肿瘤细胞集落形成能力,增强乳腺癌细胞的阿霉素耐药性;敲低AKR1C3减少β-catenin的核转位,降低乳腺癌细胞活力,减弱癌细胞的耐药性。然而,相比于敏感株细胞MCF-7,即使敲低AKR1C3的细胞株MCF-7/DOX-KD对阿霉素的敏感性仍然较低,提示在阿霉素耐药过程中,除AKR1C3之外,还有其他通路影响耐药细胞的敏感性,具体机制有待进一步探讨。XAV939是一种有效的端锚聚合酶(TNKS)1和2小分子抑制剂,通过抑制TNKS活性,增加肿瘤细胞中Axin-GSK3β复合物的蛋白水平,并促进β-catenin的降解[14]。当用XAV939处理MCF-7阿霉素耐药细胞之后,β-catenin核内含量降低,增强阿霉素对MCF-7/DOX的凋亡诱导作用。但AKR1C3是如何调控β-catenin的核内表达水平,以及β-catenin是如何发挥其耐药作用仍需进一步的研究。已有研究报道,芳香烃受体(AhR)可增强三阴性乳腺癌中AKR1C3启动子活性,调控AKR1C3的表达进而影响对阿霉素的敏感性[11]。也有报道AhR可以激活Wnt/β-catenin信号通路,进而调控肿瘤干细胞的特征[15]。那么,AhR是否通过影响AKR1C3介导的β-catenin入核来调控乳腺癌阿霉素耐药,有待进一步研究。
综上所述,在阿霉素耐药乳腺癌MCF-7细胞模型中,AKR1C3/β-catenin是阿霉素耐药的原因之一,靶向AKR1C3/β-catenin在乳腺癌阿霉素耐药的治疗中可能具有良好的应用前景。

Figure 5 Effects ofβ-catenin inhibitor XAV939 combined with DOX on the cell viability and apoptosis in MCF-7 and MCF-7/AKR1C3 cells(xˉ±s,n=3)
