VHL抑制剂对鱼藤酮所致帕金森病秀丽隐杆线虫模型的影响
2021-07-08高向东
查 倩,高向东,陈 松
(中国药科大学生命科学与技术学院江苏省生物药物成药性研究重点实验室,南京211198)
帕金森病(Parkinson′s disease,PD)是一种与年龄相关的神经退行性疾病,目前全球有600多万患者,随着世界人口老龄化加剧,PD患者数量将逐年增加[1]。PD与线粒体质量控制途径的异常调节密切相关,线粒体未折叠蛋白反应(mitochondrial unfolded protein response,mito-UPR)作为线粒体质量控制机制之一,激活的mito-UPR途径能够促进细胞存活和受损的细胞器恢复,但mito-UPR的长时间过度激活会导致缺陷的线粒体异常积累,从而破坏线粒体稳态平衡[2-3]。秀丽隐杆线虫作为神经生物学研究的理想模式生物,其神经网络简单,仅有302个神经元,共4对多巴胺能神经元,其中头部有2对CEPs(cephalic neurons)和1对ADEs(anterior deirid neurons),尾部有1对PDEs(posterior deirid neurons)。由于线虫身体透明,荧光蛋白可以在活体线虫中可视化,可直接观察神经元中目的蛋白的表达情况[4]。同时,线虫基因组是第一个被完全测序的多细胞生物的基因组,据统计,60%~80%的人类致病基因在线虫基因组中具有直系同源物[5-7]。目前,已建立的线虫帕金森病模型包括表达α-突触核蛋白(α-synuclein,α-syn)或富含亮氨酸的重复激酶2(leucine-rich repeat kinase 2,LRRK2)的转基因线虫,以及PRKN/pdr-1,PINK1/pink-1,DJ-1/djr-1.1/djr-1.2和ATP13A2/catp-6缺失的线虫模型等[8-9]。此外,有研究表明,神经毒素如鱼藤酮、1-甲基-4-苯基吡啶离子(MPP+)和6-羟基多巴胺(6-OHDA)可诱导线虫线粒体DNA损伤,导致线虫多巴胺能神经元退化[10-11]。线虫PD模型均能表现出多种表型缺陷,包括多巴胺能神经元的丢失,多巴胺依赖性行为异常等[12]。
本课题组于前期研究中建立了转基因线虫zcIs9;otIs181,发现线粒体复合体Ⅰ亚基NDUF7突变导致ADE多巴胺能神经元特异性退化,出现PD样症状,同时基于该线虫模型,进一步研究发现线虫VHL-1功能缺失能显著缓解ADE多巴胺能神经元退化情况[13]。在此研究基础上,本研究采用鱼藤酮建立PD线虫模型,分析VHL抑制剂对PD线虫模型神经元退化及行为学异常的影响。
1 材料
1.1 试剂与溶液
鱼藤酮(纯度:98.12%)、VHL抑制剂VH298(纯度:99.83%,美国MCE公司);胆固醇(上海麦克林生化科技有限公司);琼脂粉、酵母粉、蛋白胨(美国Oxoid公司);柠檬酸钾(上海阿拉丁生化科技股份有限公司);次氯酸钠溶液(国药集团化学试剂有限公司);其他试剂均为市售分析纯。
NGM培养基、M9溶液、S培养基、LB液体培养基、线虫裂解液等溶液按照文献[14]进行配制。
1.2 仪器
高速冷冻离心机、低温培养箱(美国Thermo公司);体视显微镜、荧光体视显微镜(日本Nikon公司);倒置荧光显微镜(日本Olympus公司);高压灭菌锅(日本Panasonic公司)。
1.3 动物
线虫品系:转基因线虫zcIs9;otIs181(本课题组前期构建[13])。
1.4 菌株
尿嘧啶缺陷型OP50大肠埃希菌(福建上源生物科学技术有限公司)。
2 方法
2.1 线虫培养
将线虫接种于涂布有尿嘧啶缺陷型OP50大肠埃希菌的线虫固体生长培养基(NGM培养基)平板上,于20℃低温培养箱中培养[15]。
2.2 线虫同步化处理
使用M9溶液1 mL将处于产卵期的线虫从直径为6 cm的NGM平板上冲洗下来,加至1.5 mL EP管中,2 000 r/min离心30 s,吸除上清液700μL,再加入线虫裂解液700μL,混匀5 min左右,4 000 r/min离心30 s,吸上清液至管内剩余液体约100μL,再加入M9溶液900μL,轻吹混匀,重复清洗3次后,4 000 r/min离心30 s,吸除上清液900μL,轻吹混匀剩下的虫卵溶液,吸至未接种OP50大肠埃希菌的NGM平板上,放置20℃低温培养箱培养,次日即可得到L1期线虫幼虫。
2.3 鱼藤酮暴露试验及线虫死亡和多巴胺能神经元退化情况分析
将同步化处理得到的L1期线虫接种至涂布有OP50大肠埃希菌的NGM培养基上,放置低温培养箱生长1 d后进行实验。鱼藤酮诱导PD线虫模型试验采用96孔板进行,每孔溶液终体积为100μL,设置鱼藤酮最终浓度为8.0,4.0,2.0,1.0,0.5,0μmol/L共6组,每组4个孔,用S培养基重悬OP50大肠埃希菌,保证每孔加入10 mg/μL OP50大肠埃希菌5μL,之后加入含有20~30只幼虫的S培养基10μL,次日观察并记录各组线虫死亡情况,并且观察各组生长至L4期线虫的多巴胺能神经元退化情况。对于判断线虫是否死亡,在体视显微镜下观察,当线虫身体呈现僵直状态且无运动行为时,用铂丝针刺激其身体,无反应的线虫则视为死亡。对于观察线虫多巴胺能神经元退化情况或mito-UPR情况,滴25 mmol/L左旋咪唑溶液5 μL于含有3%琼脂糖垫的载玻片上,将处理后的线虫放置溶液中进行麻醉,之后将盖玻片轻轻压住线虫,于荧光体视显微镜或荧光倒置显微镜下观察头部ADE多巴胺能神经元退化情况或mito-UPR激活情况。对于判断线虫ADE多巴胺能神经元是否退化,在正常情况下,线虫头部ADE多巴胺能神经元mCherry红色荧光斑点清晰可见,而当暴露于一定浓度的鱼藤酮后,线虫ADE多巴胺能神经元mCherry红色荧光斑点缺失则视为ADE多巴胺能神经元退化。在正常情况下,线虫虫体GFP绿色荧光微弱,而当mito-UPR激活后,线虫虫体GFP绿色荧光明显增强。
2.4 抑制剂VH298干预PD线虫模型试验
抑制剂干预试验采用96孔板进行,每孔溶液终体积100μL,每孔20~30只L1期幼虫,设置抑制剂VH298终浓度为400,200,100μmol/L进行提前干预,每组4个孔,1 d后使用M9溶液清洗线虫3次,再将线虫加入新鲜配制的含有鱼藤酮和不同浓度VH298的96孔板中进行共孵育,1 d后使用M9溶液清洗线虫3次,将线虫转移至NGM培养基上进行各项指标分析。观察线虫死亡和多巴胺能神经元退化情况的方法,参见“2.3”项。
2.5 线虫运动行为指标的测定[16-17]
2.5.1 头部摆动频率分析 抑制剂VH298干预PD线虫模型参见“2.4”项。在未接种OP50大肠埃希菌的NGM培养基上滴加M9溶液80μL,用铂丝针挑取处理后的线虫置于M9溶液中,待其恢复1 min后,在体视显微镜下观察并记录线虫在1 min内头部摆动的次数(线虫头部从一侧摆向另一侧又摆回来的次数)。
2.5.2 身体弯曲频率分析 抑制剂VH298干预PD线虫模型见“2.4”项。用铂丝针挑取处理后的线虫于未接种OP50大肠埃希菌的NGM培养基上,待其恢复1 min后,在体视显微镜下观察并记录其在30 s内身体弯曲的次数(线虫在爬行过程中沿着身体长轴方向上1个波长变化作为1次身体弯曲)。
2.6 线虫觅食行为的分析[16]
抑制剂VH298干预PD线虫模型见“2.4”项。在直径为9 cm的未接种OP50大肠埃希菌的NGM培养基中央滴大肠埃希菌OP50菌液5μL,形成直径为1 cm的圆形菌苔,将线虫放入距离培养皿中心位置4 cm处,每个培养皿放置20条。分别记录4,12,24 h后接触菌落的线虫数,计算接触菌落线虫占线虫总数的比例。
2.7 统计分析
实验数据采用GraphPad Prism 8.0统计软件进行分析,各项指标以xˉ±s表示,采用Two-Way ANOVA检验对线虫觅食行为数据进行分析,采用One-Way ANOVA检验对其他数据进行分析,P<0.05时表明差异有统计学意义。
3 结 果
3.1 不同浓度鱼藤酮导致转基因线虫zcIs9;otIs181死亡率变化
本研究选用带有zcIs9和otIs181两个遗传标记的转基因线虫,其中zcIs9[hsp-60p∷GFP]用于监测线虫mito-UPR,otIs181[dat-1p∷mCherry+ttx-3p∷mCherry]用于标记4对多巴胺能神经元和1对非多巴胺能神经元AIY。转基因线虫zcIs9;otIs181同步化处理后生长2 d,采用不同浓度的鱼藤酮损伤线虫,次日在体视显微镜下观察并记录各组线虫死亡情况。结果如图1所示,低剂量鱼藤酮处理线虫1 d即可导致线虫死亡,当鱼藤酮浓度上升至4.0和8.0μmol/L时,线虫死亡率分别为49.24%和88.14%。以上结果说明,鱼藤酮能导致转基因线虫zcIs9;otIs181死亡,并且呈现一定的浓度依赖性。

Figure 1 Evaluation of death in C.elegans strain with zcIs9;otIs181 with exposure to different concentrations of rotenone(xˉ±s,n=20-30)
3.2 不同浓度鱼藤酮导致转基因线虫zcIs9;otIs181多巴胺能神经元退化情况
转基因线虫zcIs9;otIs181同步化处理后生长2 d,采用不同浓度的鱼藤酮损伤线虫,1 d后在荧光体视显微镜下观察并记录各组L4期线虫多巴胺能神经元退化和mito-UPR激活情况。结果如图2所示,与对照组相比,0.5,1.0和2.0μmol/L的鱼藤酮损伤组线虫ADE退化率分别为27.87%,29.17%和39.71%,鱼藤酮浓度上升至4.0和8.0 μmol/L时,线虫ADE退化率分别为84.17%和93.16%。以上结果说明,鱼藤酮能导致转基因线虫zcIs9;otIs181的多巴胺能神经元退化,且与对照组相比,鱼藤酮损伤组线虫mito-UPR均被激活,说明鱼藤酮可能通过诱导转基因线虫zcIs9;otIs181线粒体损伤,破坏线粒体稳态,进而导致多巴胺能神经元退化及线虫死亡。
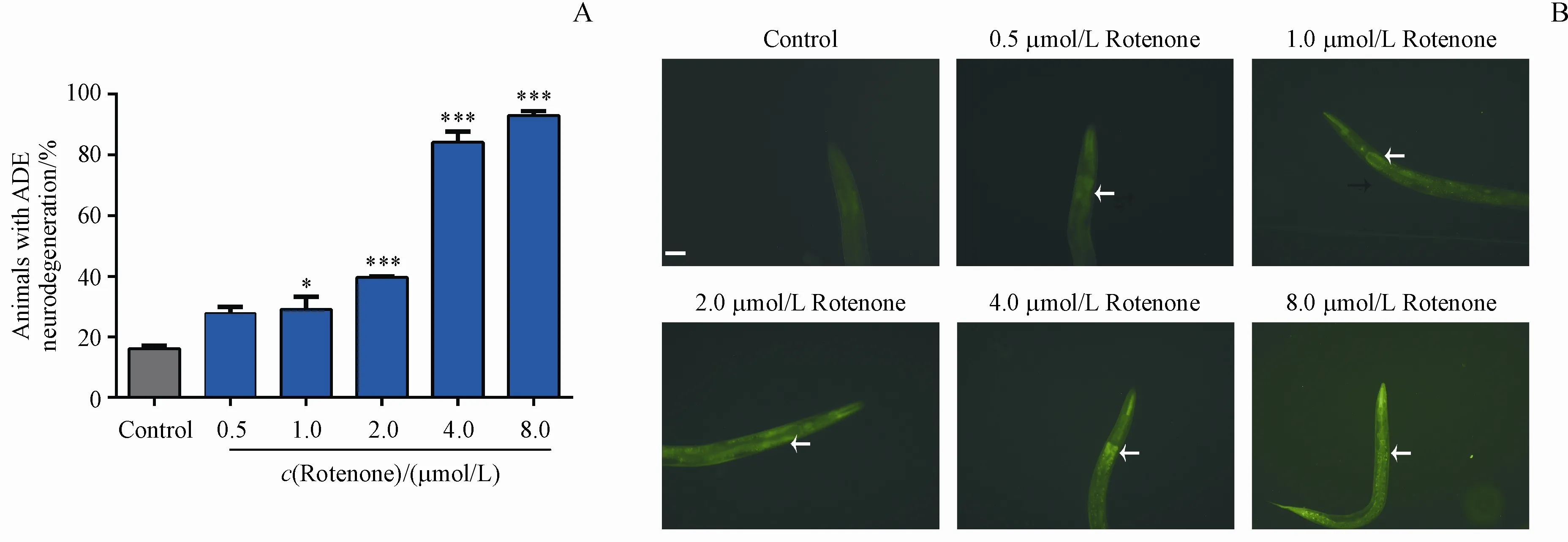
Figure2 Evaluation of neuronsand mito-UPRin C.elegans strain with zcIs9;otIs181 with exposuretodifferent concentrationsof rotenone(xˉ±s,n=20-30)
3.3 VHL抑制剂对PD线虫模型存活情况的影响
采用不同浓度的VHL抑制剂VH298(400,200和100μmol/L)进行提前干预,次日采用终浓度为2.0μmol/L鱼藤酮与不同浓度的VH298共同孵育线虫,1 d后在体视显微镜下观察并记录各组线虫死亡情况。结果如图3所示,与模型组相比,100,200和400μmol/L的VH298均能在一定程度上降低2.0μmol/L鱼藤酮诱导的线虫死亡率,说明VHL抑制剂能够缓解鱼藤酮导致线虫模型的死亡。
3.4 VHL抑制剂对PD线虫模型多巴胺能神经元退化情况的影响
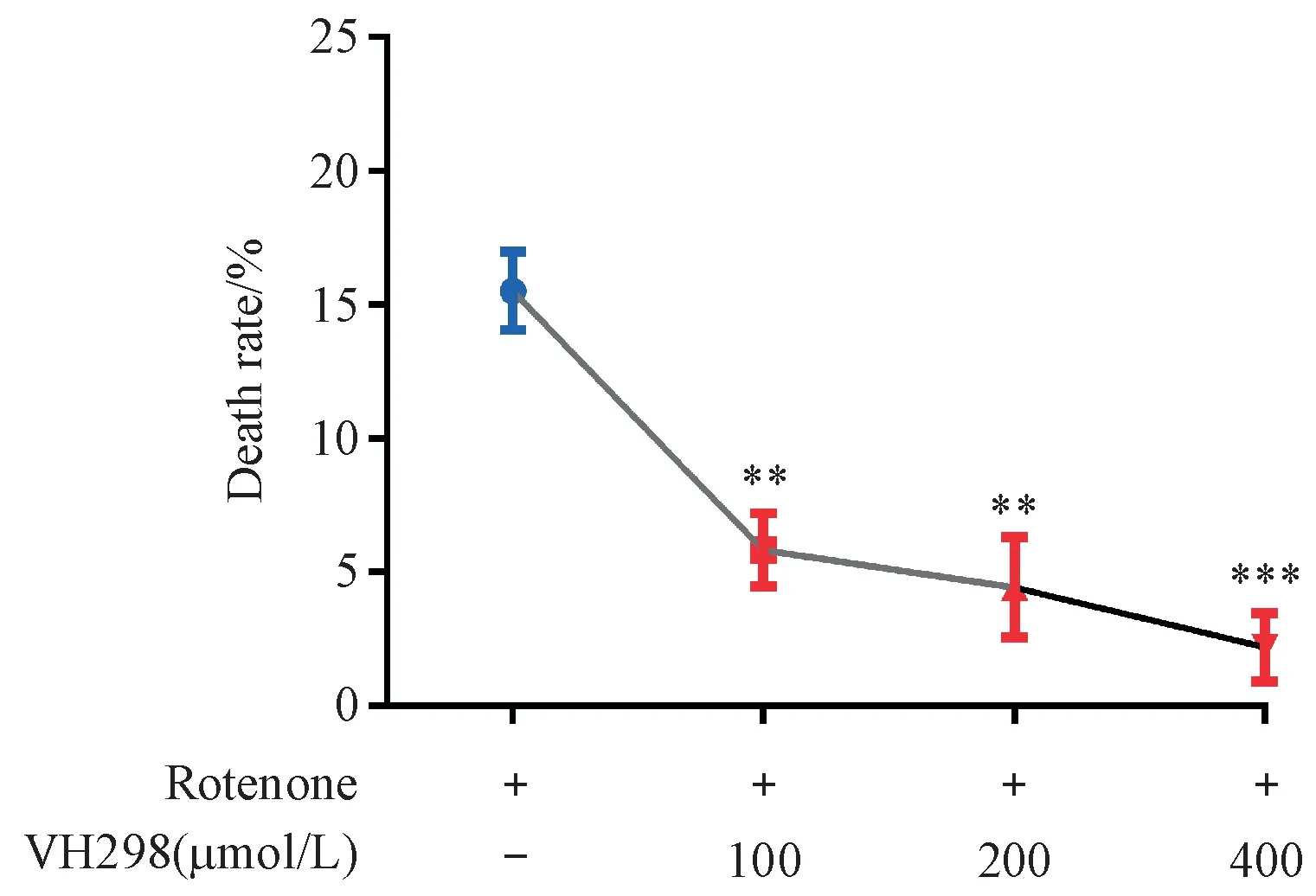
Figure 3 Effects of VHL inhibitor VH298 on death in C.elegans strain with zcIs9;otIs181 with exposure to 2.0μmol/L rotenone(xˉ±
首先采用不同浓度的VHL抑制剂VH298(400,200和100μmol/L)进行提前干预,次日采用终浓度为2.0μmol/L鱼藤酮与不同浓度的VH298共同孵育线虫,1 d后在体视显微镜下观察并记录各组L4期线虫多巴胺能神经元退化情况。结果如图4所示,与模型组相比,400μmol/L的VH298有效缓解鱼藤酮诱导的ADE神经元退化情况,说明VHL抑制剂对鱼藤酮所致线虫模型具有一定的多巴胺能神经元保护作用。

Figure4 Effects of VHL inhibitor on neurons in C.elegans strain with zcIs9;otIs181 with exposure to 2.0μmol/L rotenone(xˉ±s,n=20-30)
3.5 VHL抑制剂对PD线虫模型运动能力的影响
采 用VHL抑 制 剂VH298(400,200和100 μmol/L)和鱼藤酮(2.0μmol/L)处理线虫,体视显微镜下观察L4期线虫头部摆动、身体弯曲情况。结果如图5所示,VH298能在一定程度上缓解鱼藤酮导致的线虫头部摆动频率和身体弯曲频率异常情况,说明VHL抑制剂能够减少鱼藤酮所致PD线虫模型的行为学异常。

Figure 5 Effects of VHL inhibitor VH298 on head thrashes and body bends in C.elegans strain with zcIs9;otIs181 with exposure to 2.0μmol/L rotenone(xˉ±s,n=20-30)
3.6 VHL抑制剂对PD线虫模型觅食行为的影响
采 用VHL抑 制 剂VH298(400,200和100 μmol/L)和鱼藤酮(2.0μmol/L)处理线虫,体视显微镜下观察线虫觅食情况。结果如图6所示,与模型组相比,VH298处理后线虫的菌落接触率在4,12和24 h均有一定程度的增加,其中400μmol/L VH298处理后线虫的菌落接触率在12和24 h时显著增加。以上结果说明,VHL抑制剂能改善鱼藤酮所致PD线虫模型的觅食行为异常情况。
4 讨 论
本研究采用神经毒性剂鱼藤酮处理转基因线虫zcIs9;otIs181,该转基因线虫出现异常死亡、神经元异常退化以及异常激活mito-UPR的情况,模拟了类PD样症状如多巴胺能神经元丢失和运动障碍;通过VHL抑制剂VH298干预PD线虫模型,发现VH298能促进PD线虫模型存活,缓解ADE多巴能神经元退化情况,并且改善PD线虫模型运动障碍如头部摆动频率和身体弯曲频率以及多巴胺依赖性行为如觅食行为异常等情况。综上,鱼藤酮可能通过引起转基因线虫zcIs9;otIs181线粒体损伤,导致线粒体稳态失衡,进而诱发线虫异常死亡及神经元退化;VHL抑制剂VH298能减少鱼藤酮导致的转基因线虫zcIs9;otIs181异常死亡;可通过保护多巴胺能神经元进而改善由多巴胺能神经元丢失所导致的运动行为异常和觅食行为异常。本研究为VHL抑制剂治疗帕金森病奠定了一定的理论基础。
