基于p53信号转导网络数学模型研究热疗联合放疗在肿瘤治疗中的协同效应
2021-07-08孙廷哲
孙廷哲
(安庆师范大学生命科学学院,安庆246133)
在对DNA损伤的应答中,维持基因组稳定性对多细胞生物至关重要。细胞内的信号转导网络受到不断变化的生理状态和环境因素影响,其中温度是一个重要因素。研究表明,细胞内的部分信号转导网络(如昼夜节律)具备补偿机制,可对温度变化不敏感[1],而NF-κB信号转导网络动力学特征则表现出对温度变化的较高敏感性[2]。最近,Jentsch等[3]通过单细胞荧光实验发现DNA损伤刺激下,p53信号网络对也对温度变化产生应答,其脉冲振幅和频率随温度变化,甚至发生由脉冲到非脉冲的转变。
转录因子p53是重要的网络节点,可对多种刺激产生响应,并诱导细胞产生一系列应答反应,如细胞周期阻滞、衰老或细胞凋亡[4]。在生理状态下,细胞内的p53蛋白水平较低,这主要是通过一种E3泛素连接酶MDM2介导的p53降解实现的[5]。mdm2mRNA又受到转录因子p53诱导,因此形成一条重要的负反馈环路[6]。而PPM1D/Wip1介导的另一条负反馈环路同样影响p53的脉冲发生[7]。p53蛋白介导的信号转导是一个动态过程,p53的动力学特性受到内源性和外源性刺激类型和总量的影响,进而调控细胞对刺激的应答,对细胞命运产生影响[8]。在多数肿瘤细胞中都可以观察到p53蛋白的失活,这可以通过TP53基因突变、减弱的DNA结合能力或扩增p53的负调控因子MDM2/Wip1[9]。功能性p53水平的不足将会产生药物抗性并与较低的生存率相关联[10]。
在静息状态下,人体维持相对稳定的核心温度(约37℃)。然而,受环境温度影响,体表温度(尤其在肢端)可降低至约33℃[11]。另外,体温也受到其他因素影响,如年龄、性别和运动状态,进而偏离静息体温[12]。而在心血管疾病或感染、自身免疫类疾病诱发的发热状态下,由于正常血液传输和散热机制受阻,体内核心温度可能会大幅超过40℃[13]。温度对机体的影响是多方面的,在分子水平上,温度可对酶活性产生影响。在细胞水平上,高热可对代谢、蛋白质合成等过程产生显著影响[14]。临床上,热疗辅助常规抗肿瘤疗法是一种常用的治疗手段。有临床证据表明,持续(超过1 h)40~42℃热疗结合放疗可有效地减小局部肿瘤体积,提高患者生存率[15]。过热(hyperther⁃mia)可对p53信号转导网络动力学产生显著影响[3],但温度变化如何影响p53信号网络尚缺乏理论研究。
本文通过构建微分方程模型,结合随机模拟方法系统模拟了温度对p53动力学的影响。模型也模拟了细胞过热处理后,当温度降至正常体温时p53脉冲的重现。同时,本研究也揭示了温度与辐射剂量的协同效应。此协同性可能为热疗辅助放疗的有效性提供一种新的解释。
1 材料
1.1 软件
数值模拟使用美国MathWorks公司MATLAB软件实现(版本R2018b)。
2 方法
2.1 构建p53网络模型
基于之前的10变量p53网络模型[16],描述p53通路对DNA损伤刺激的应答,形成时滞微分方程(表1)。电离辐射(ionizing radiation,IR)可诱导DNA双链断裂损伤(DNA double strand break,DSB)并磷酸化激活共济失调毛细血管扩张突变(ataxia-telangiectasia mutated,ATM)[17]。将总ATM水平设为常量[18]。活化的ATM(变量ATM*)可以磷酸化p53和MDM2,磷酸化的p53(变量P53p)变得更加稳定而磷酸化的MDM2(变量MDM2p)则加速 降 解[19]。模 型 中 整 合 了p53-MDM2[6]和p53-Wip1-ATM[7]两条负反馈环路,故p53蛋白(变量P53),MDM2蛋白(变量MDM2)和Wip1蛋白(变量WIP1)蛋白计3个变量引入模型。考虑转录过程,p53mRNA分子(变量p53),MDM2mRNA分子(变量mdm2)和Wip1mRNA分子(变量wip1)也予以考虑并整合入模型。过热状态下,细胞内Hsp70的水平显著上升,作为分子伴侣抑制p53和MDM2的结合,从而提高p53的稳定性[20]。通过运用Arrhenius[21]方程项,表示温度对MDM2降解p53的影响(表1和表2)。基于最近的研究,磷酸化的MDM2与p53mRNA的结合(变量p53MDM2p)以及翻译增强效应也整合进入了模型(表1)[22]。出于简化模型目的,未考虑所有分子的亚细胞定位。降解、磷酸化和去磷酸化反应使用质量作用(mass action)定律进行描述,较之Michaelis-Menten方程可显著减少未知参数个数。另外,Michaelis-Menten方程较之质量作用定律具有更强非线性,更易产生复杂动力学行为[16]。参数取值见表2。

Table1 Delayeddifferentialequationsforp53model
2.2 随机模拟
由于模型中最大分子个数超过105,因此使用加速τ-leap算法并引入时滞项τ[23]。在随机模拟过程中,所有τi(i=1,2,3,4)均围绕参考值产生±3%扰动。
2.3 协同性
温度和辐射剂量的协同通过Loewe和Bliss协同 指 数(combinationindexes,CI)进 行 度 量[24]。Loewe协同指数(CILoewe)定义为:

其中d1(温度)和d2(DNA双链断裂DSB)指等效线图(isobologram)中达到40%最大效应时所对应的剂量。GC(1)x和GC(2)x分别代表单独变化温度或DSB的取值并使效应值增加40%时,所需的温度或DSB量。在等效线图中,若图像呈下凸形态,表明系统存在协同性。
Bliss协同指数(CIBliss)定义为:

其中R1(x),R2(y)和R12(x,y)分别指温度为x、DNA双链断裂数量为y,温度-DNA双链断裂组合剂量为[x,y]时,p53效应的相对变化。p53的效应为总p53蛋白水平在时间上的积分和总p53蛋白的最大值。
3 结 果
3.1 温度对p53脉冲的影响
此模型主要包含两条负反馈环路(p53-MDM2和p53-Wip1-ATM)。模型中,温度(T)影响MDM2和p53的结合,即MDM2对p53的降解作用(表达式见表1)。用10 Gy辐射刺激系统,模拟Jentsch等[3]的实验条件,方程(9)中初始DSB取值设定为300,即依据文献报道1 Gy辐射剂量平均产生30个DNA双链断裂损伤[30]。当温度设置为33℃时,总p53蛋白(磷酸化和未修饰p53总和)呈现持续的无衰减脉冲,脉冲的周期约为5.9 h(图1-A)。当增加温度至35℃和37℃时,持续的脉冲仍能被观测到。注意到随着温度的升高,p53首个脉冲的振幅逐渐增加,同时持续脉冲的周期进一步缩短(图1-C),模拟的脉冲周期与Jentsch等[3]的实验结果一致。值得注意的是,当继续增加温度至39℃,首个脉冲的振幅进一步增加。系统虽在24 h内能进行持续脉冲,但脉冲的振幅呈现逐渐衰减趋势(图1-C)。注意到p53首个脉冲的出现时间随着温度的增加而逐渐加速,表现为脉冲峰值的提前(图1-B)。当温度增加到41℃时,p53的持续脉冲完全消失,p53蛋白水平在首个脉冲回落以后呈持续增长的趋势(图1-C)。综上所述,温度对p53的动力学特征产生影响,过热状态下p53的脉冲将被破坏。在Jentsch等[3的实验中,当温度达到41℃时,10 h后p53的水平具有明显的下降趋势。另外,信号转导网络中的生化反应发生本身是一个随机过程[28],需要进行随机模拟。因此,后续将对模型进行一定的修正,从而更好拟合。

Table2 Descriptions and values for variables or parameters in p53 model

Figure1 Effect of temperatureon p53 pulses
3.2 随机模拟重现p53的动力学特征
如上所述,在41℃过热处理下,确定性常微分方程中总p53的水平在10 h后未有下降趋势。为修正此不足,在随机模拟中,引入DNA损伤修复作用。根据Mönke等[31]报道,将模型中DSB修复设置为(Ns−Nb)e−rt+Nb,其中Ns为辐射诱导DSB数量(即30 DSB/Gy),Nb为细胞中本底DSB数量。模型中设定为Nb=3,r=0.004。将DNA损伤修复过程整合入模型后,给予10 Gy辐射刺激(计300 DSB),在41℃下,发现在此25 h观察窗口内的晚期,p53水平即总p53分子数逐渐下降(图2-A)。由于辐射诱导的DSB被不断修复,因此DSB对ATM活化的作用减弱,进而导致41℃下后期p53水平降低(图2-A)。值得注意的是,即使未予外源性辐射刺激(0 Gy),较之33~39℃,在41℃时,细胞中的p53水平也呈现较为明显的上升(图2-A)。此模拟结果与Jentsch等[3]的实验结果是吻合的。另外,通过基音试别(Pitch detection)计算p53脉冲特征基音所在位置。结果显示,在33℃时,p53首个脉冲出现较37℃晚,而39℃时,p53首个脉冲基音则较之37℃时更早出现(图2-B)。虽然从中位数水平可比较基音出现的时间次序,但总体而言,各个温度下p53第一个脉冲基音分布具有较大的重叠。另外,p53第2和第3个脉冲的基音分布特征与第一个脉冲具有相似随温度变化的趋势(图2-B)。脉冲的振幅随温度的变化趋势如图2-C所示。对p53的首个脉冲而言,温度从33℃增加到37℃,振幅随温度升高而增大。而39℃时,首个脉冲的振幅和37℃比未见明显增加(图2-C)。而对于第2和第3个p53脉冲,温度对脉冲幅度的影响明显减弱(图2-C)。计算500组随机模拟中不同时间点的相关系数以进一步阐明p53脉冲随温度的变化。结果显示,时间点相关系数的特征随温度发生变化。在33~37℃下,可以观察到较为明显的周期性特征,而在41℃时,周期性特征则基本消失(图2-D)。值得注意的是,在41℃时,p53蛋白水平的强相关性较之在33~39℃时显著延长,表明细胞在过热条件下,早期给予强刺激能够保证细胞在较晚时期仍具有较强应答。这些结果表明,随机模拟结合DNA损伤修复可以更好的模拟温度对p53动力学特征的影响。
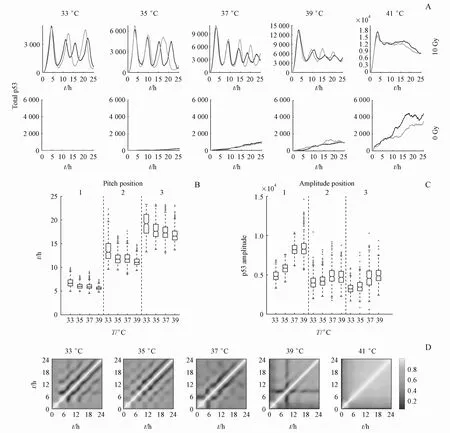
Figure 2 Characteristics of p53 pulses are varied with changingtemperature
3.3 温度和辐射刺激产生协同性
温度可以影响p53的动力学形态,进一步,通过等效线图绘制和计算Bliss协同指数探索温度影响p53信号转导的潜在意义。首先运用累积p53水平作为系统反应指标,计算Bliss协同指数。结果显示,温度和DSB刺激产生了协同效应(CIBliss<1,图3-A)。协同性的变化受到温度和DSB数量的影响,其中温度的影响更为显著,表现为Bliss协同指数沿温度升高方向快速下降(图3-A)。若以最大p53蛋白水平作为系统反应指标,也得到了类似的变化趋势(图3-B)。进一步,利用Loewe等效线图研究温度和辐射刺激的协同作用。Loewe等效线图显示,温度和DSB数量同样产生了协同效应(图3-C)。以最大p53蛋白水平作为反应指标的等效线图同样表明温度和辐射刺激两者间的协同效应(图3-D)。

Figure3 Synergy between temperatureand irradiation-induced DNA damage
从p53的累积值响应平面上,可以观察到当温度较低时,累积p53水平沿DSB数量的增加方向上升缓慢;而当温度增高时,辐射刺激的增加可以更为显著提升累积p53水平(图4-A)。p53最大值的响应平面也具有类似的趋势(图4-B)。以上分析结果表明,温度可以增强p53对辐射刺激的应答,同时过热状态可有效引发温度与辐射刺激的协同效应。
3.4 模拟p53对温度应答的可逆性
为进一步模拟实验中发现的p53对温度应答的可逆性[3],首先设定模型初始温度为41℃。在6 h后,重新设定模型中系统温度为37℃。随机模拟结果显示,总p53蛋白水平首先迅速上升并达到峰值(图5-A)。如上所述,若系统温度持续设为41℃,p53将不会出现后续脉冲(图2)。但6 h后降低系统温度至生理温度37℃,模拟显示经历短暂时滞后,p53脉冲重新出现。后续p53脉冲持续时间可能较长,也可能迅速衰减(图5-A)。就群体水平而言,总p53蛋白水平首先经历急速上升过程,达到峰值后下降。在温度降至37℃后,p53的脉冲重现,但其脉冲峰值随时间不断衰减,直至p53脉冲消失(图5-B)。500组随机模拟结果表明,降低温度至37℃后细胞会重启p53脉冲(图5-C)。以上模拟结果显示,p53脉冲对温度变化具有可逆性,与Jentsch等[3]的实验结果一致。

Figure4 Responsesurfaceof p53 featurestotemperatureand DSBnumbers

Figure 5 Dynamical p53 response to hyperthermiais reversible
4 讨论
p53信号转导网络介导的信息传递过程是机体对环境刺激应答的重要环节。为了探讨温度对p53动力学性质的影响,本研究构建了p53信号通路常微分方程模型。对微分方程的数值求解表明电离辐射刺激下,p53的动力学形态随温度增加发生转变,由脉冲转变为持续累积。同时在33℃~39℃下,p53脉冲的振幅和周期分布也和温度变化具有强相关性。p53的脉冲也具有一定的异质性(heterogeneity)。模拟结果揭示温度对p53动力学形态调控的生理学意义,即合适的温度和辐射刺激组合具有很强的协同效应,能有效的增强系统中p53的应答反应。p53的脉冲周期[32]和持续累积的幅度[33]是对刺激信号的重要编码,直接对细胞命运产生决定性影响。因此,温度对p53动力学形态的影响将直接关系到细胞的命运选择。p53对温度变化的敏感性特征表明p53信号网络并不具有温度代偿机制,这与最近关于NF-κB的发现相类似[2]。在NF-κB的网络中,环境温度信息被编码成RelA振荡的频率,通过RelA的核转位影响下游基因表达,从而形成对温度的应答[2]。因此,温度依赖的p53动力学性质变化可能会诱导差异化基因表达,进而影响下游细胞反应。温度影响的p53下游靶基因表达可能只限于早期[3]。模型模拟显示p53首个脉冲表现出对温度的强敏感性,而后续脉冲对温度的响应会逐渐减弱。此结论为Jentsch等[3]的实验发现提供一个可能的解释。进一步的实验和模型研究可能会更好的揭示温度对基因表达时程的影响。
在过热条件下,p53脉冲消失,在一定时间内p53呈持续累积的动力学行为。持续的p53累积可能会诱导高水平的关键靶基因表达(例如CD⁃KN1A/p21)从而导致细胞周期阻滞或衰老[34]。因此,p53动力学反应的可逆性至关重要。在过热条件下,持续累积的p53可以诱发暂时的细胞周期阻滞以修复损伤DNA,维持基因组稳定性。而当细胞恢复至生理温度后,p53脉冲将重现并保证细胞重新进入细胞周期,维持细胞更新及稳态。利用MDM2小分子抑制剂Nutlin-3改变p53动力学形态,Purvis等[35]发现脉冲形态或持续高水平表达的p53蛋白对细胞命运具有显著影响,p53脉冲促进细胞生存而持续高水平p53表达则诱导永久性细胞周期阻滞。较低温度可诱发p53脉冲而较高温度则会促使p53蛋白维持高表达状态,这与不同剂量Nutlin-3对p53动力学的影响相似[3]。所以,温度可模拟抑癌小分子Nutlin-3改变p53动力学形态进而对细胞命运产生影响。
热疗辅助放疗已被广泛用于临床肿瘤治疗,且此组合疗法具有不良反应小的优点[36]。但在分子水平上,热疗(过热状态)是如何影响肿瘤治疗的效果仍旧是一个未解决的问题。通过计算Bliss协同指数和绘制Loewe等效线图发现,温度和辐射刺激产生了协同效应。在适度过热条件下,温度和辐射刺激的协同效应显著增强。过热状态通过抑制MDM2对p53的降解,削弱p53-MDM2负反馈对p53的负向调控作用,从而诱导p53水平的升高。另外,温度对协同效应的影响可能更高效,表现为Bliss协同指数图中CIBliss沿着温度升高方向急剧降低。所以,热疗辅助放疗中设置适当的温度将更有利于产生高协同效应。但同时应注意到,在一定的范围内,温度和辐射刺激的协同效应较弱(如低于生理温度区域)。此分析表明运用合适的过热温度辅助放疗才可能引起强协同效应,进而提高肿瘤治疗的效果。但本研究所揭示的协同效应依赖于细胞中存在野生型或功能型p53蛋白。若TP53发生突变以致失活,或负调控蛋白MDM2在肿瘤中过表达[37],那么温度的协同效应可能不再适用。在TP53突变细胞中的进一步实验和理论研究将有助于解决这一问题。
此模型仍有不足,如随机模拟过程中主要考虑了内源性噪声(intrinsic noise),未对模型初值和参数进行随机化,而初值和参数的随机化将更多的引入外源性噪声(extrinsic noise)[38]。外源性噪声的引入可能会更好的拟合实验数据。本模型仅考虑温度对p53蛋白降解的影响,其他机制的发现将有助于提高模型的精度。总之,此模型模拟了温度对p53的动力学形态影响,揭示了温度和辐射刺激的协同效应,为热疗辅助放疗提供了一个有益的理论参考。
致谢:穆丹老师帮助本论文顺利完成。
