传染性支气管炎病毒nsp4和nsp15通过调节NF-κB和IRF3信号通路抑制I型干扰素表达
2021-07-07马淑慧
徐 刚 , 马淑慧
(天津农学院动物科学与动物医学学院 天津市农业动物繁育与健康养殖重点实验室 , 天津 西青 300392)
传染性支气管炎(Infectious bronchitis,IB)是由传染性支气管炎病毒(Infectious bronchitis virus,IBV)引起鸡的一种急性、高度接触性传染病,目前已流行于全球各地,是危害世界各国家禽养殖业发展的重要动物疫病[1-2]。IBV属于γ冠状病毒属,基因组主要编码4种主要的结构蛋白、4种辅助蛋白以及至少15种非结构蛋白[3-4]。冠状病毒的多种蛋白成分可参与病毒的感染、复制和抵抗机体的抗病毒反应,其中α冠状病毒和β冠状病毒都可以有效地拮抗I型干扰素(Interferon,IFN)的产生[5]。I型干扰素反应是机体先天免疫应答的重要组成部分,主要针对并抵抗病毒的入侵,具有很高的抗病毒活性和广泛的免疫调节作用[6-7]。而对于γ冠状病毒属的IBV来说,病毒与宿主I型干扰素反应的相关性目前研究甚少。
本试验首先通过IBV感染原代鸡胚肾细胞并利用双链RNA类似物poly(I∶C)进行刺激,确定IBV对I型干扰素的抑制作用,然后通过构建IBV的各非结构蛋白真核表达载体,利用实时荧光定量PCR(qRT-PCR),在DF-1细胞上筛选拮抗I型干扰素的IBV非结构蛋白,并研究其在抑制干扰素生成相关通路中的作用机理,为深入探索IBV的致病机理以及免疫机制提供科学依据。
1 材料与方法
1.1 IBV毒株与鸡胚 IBV JS株由本实验室分离,经纯化后获得全基因组序列。SPF鸡胚,购自北京勃林格殷格翰维通生物技术有限公司。
1.2 主要试剂、质粒和细胞 DMEM培养基、胎牛血清(Gibco,美国);Lipofectamine 2000(Thermo,美国);总RNA提取试剂盒(TP-01111,福际,成都);荧光定量反转录试剂、荧光定量染料(TaKaRa,日本);poly(I∶C)(Invivogen,法国)。真核表达质粒pCMV-Myc和鸡胚成纤维细胞(DF-1)由本实验室保存。
1.3 引物设计 根据IBV JS株全基因组序列,通过序列分析和比对,确定非结构蛋白nsp2~nsp16的具体位置,设计用于扩增nsp2~nsp16(不含nsp11/12)基因的特异性引物。参考GenBank数据库,设计鸡IFN-α、IFN-β、NF-κB、IRF3以及GAPDH基因的引物。
1.4 原代鸡胚肾细胞(CEK)的制备 取18~20日龄SPF鸡胚,无菌从胚中取出胚体后,摘取肾脏,剪碎后在37 ℃下胰酶消化30 min,经200/400目筛网过滤后计数,以4×105个细胞/cm2的量接种于细胞板备用。
1.5 病毒的细胞接种试验 制备CEK细胞接种于24孔板中,待细胞长至70%~90%,将IBV JS株病毒液以MOI=0.01的剂量接种CEK细胞,37 ℃培养箱培养24 h后添加poly(I∶C)(10 μg/mL),继续培养8 h,进行qRT-PCR试验检测IFN-α和IFN-β的表达,以GAPDH基因作为内参基因。
1.6 IBV非结构蛋白真核表达质粒的构建 取无菌收集的IBV JS株尿囊液,提取病毒基因组RNA并反转录获得cDNA。利用设计的引物,扩增IBV JS株的非结构蛋白基因片段,连接于pCMV-Myc载体,测序鉴定并保存序列正确的重组质粒。
1.7 IBV非结构蛋白对I型干扰素表达的影响 DF-1细胞接种于24孔板中,待细胞长至70%~90%,以每孔500 ng剂量转染IBV JS株各非结构蛋白重组质粒,转染后24 h,以500 ng/mL的剂量转染poly(I∶C),16 h后进行qRT-PCR试验检测IFN-β基因的表达,以GAPDH基因作为内参基因。
1.8 IBV nsp4和nsp15对NF-κB和IRF3表达的影响 DF-1细胞接种于24孔板中,待细胞长至70%~90%,梯度转染IBV JS株nsp4和nsp15重组质粒,转染剂量为50、250 ng和500 ng,以500 ng/mL的剂量转染poly(I∶C),16 h后进行qRT-PCR试验检测IFN-β、NF-κB和IRF3基因的表达,以GAPDH基因作为内参基因。
1.9 数据统计分析 试验数据使用GraphPad V8.1.0软件进行统计学分析,数据之间分析采用单因素方差分析,统计结果表示为:P<0.05(*)时有统计学差异,P<0.01(**)时差异显著,P<0.001(***)时差异极显著。
2 结果
2.1 IBV对poly(I∶C)诱导的I型干扰素表达的影响 由图1可知,单独添加poly(I∶C),可诱导细胞产生较高水平的I型干扰素,而IBV感染CEK细胞后产生的I型干扰素量较低。与单独添加poly(I∶C)组相比,IBV感染后再添加poly(I∶C),IFN-α和IFN-β的表达量分别降低63%(图1A)和61%(图1B),表明IBV感染可以拮抗I型干扰素的产生。
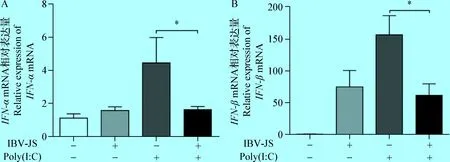
图1 IBV对I型干扰素表达的影响Fig.1 Effect of IBV on the expression of type I interferonA:IFN-α基因相对表达量; B:IFN-β基因相对表达量; *:P<0.05A:Relative expression of IFN-α gene; B:Relative expression of IFN-β gene; *:P<0.05
2.2 IBV非结构蛋白对I型干扰素表达的影响 由图2可知,与空载体转染组相比,转染IBV nsp3、nsp 4、nsp7、nsp14和nsp15重组质粒的细胞产生的IFN-β的量分别降低了58.5%、65.1%、60.7%、63.1%和55.7%,其他非结构蛋白重组质粒转染组未见统计学差异(P>0.05)。

图2 IBV非结构蛋白对poly(I∶C)诱导的IFN-β mRNA表达的抑制作用Fig.2 Inhibition of poly(I∶C)-induced expression of IFN-β mRNA by IBV nonstructural proteinsVector:空载体转染组; ***:P<0.001Vector:Cells were transfected with empty vector; ***:P<0.001
2.3 IBV nsp 4和nsp15对NF-κB和IRF3表达的影响 为了探究非结构蛋白在IBV抑制I型IFN表达过程中的作用机理,选取了抑制作用最强的nsp 4以及目前研究较少的nsp15进行进一步试验。首先将nsp 4和nsp15进行了梯度浓度转染,检测这2个蛋白对IFN的抑制作用是否具有剂量依赖性,结果由图3可见,与空载体转染组相比,随转染量增加,nsp 4转染组细胞IFN-β的表达量分别降低了9%、20.2%和60.2%(图3A),nsp15转染组细胞IFN-β的表达量分别降低了12.9%、39.9%和51.5%(图3B)。2种非结构蛋白对IFN的抑制作用均具有剂量依赖性。

图3 IBV nsp 4和nsp15对poly(I∶C)诱导的IFN-β mRNA表达的抑制作用Fig.3 Inhibition of poly(I∶C)-induced expression of IFN-β mRNA by IBV nsp 4 and nsp15A:nsp4转染组;B:nsp15转染组; Vector:空载体转染组; *:P<0.05; **:P<0.01; ***:P<0.001A:Cells were transfected with nsp4; B:Cells were transfected with nsp15; Vector:Cells were transfected with empty vector; *:P<0.05; **:P<0.01; ***:P<0.001
本试验还检测了不同浓度转染组细胞中NF-κB和IRF3基因的表达情况,结果由图4可知,与空载体转染组相比,随转染量增加,nsp 4转染组细胞NF-κB的表达量分别降低了13.8%、32.5%和41%(图4A),IRF3的表达量分别降低了6%、19.3%和24.7%(图4B);nsp15转染组细胞NF-κB的表达量分别降低了11.3%、22.4%和25%(图4C),而IRF3表达量的变化无统计学差异(图4D)。

图4 IBV nsp 4和nsp15对NF-κB和IRF3 mRNA的影响Fig.4 Effect of nsp 4 and nsp15 on the expression of NF-κB and IRF3 mRNA A、C:NF-κB基因相对表达量; B、D:IRF3基因相对表达量; Vector:空载体转染组;*:P<0.05; **:P<0.01; ***:P<0.001; ns:无统计学差异A,C:Relative expression of NF-κB gene; B,D:Relative expression of IRF3 gene; Vector:Cells were transfected with empty vector;*:P<0.05; **:P<0.01; ***:P<0.001; ns:No statistical differences
3 讨论
先天免疫反应是机体抵抗病毒感染的第一道防线,而I型干扰素(IFN-α和IFN-β)是其最重要的细胞因子之一[8-9]。许多冠状病毒进化过程中形成了一系列的机制来抑制或拮抗机体干扰素抗病毒免疫反应,SARS冠状病毒(SARS-CoV)和人类冠状病毒NL63(HCoV-NL63)等在感染过程中不能诱导IFN-β的表达,猪流行性腹泻病毒(PEDV)可通过抑制IRF3的活性来调控IFN-β的表达,小鼠肝炎病毒(MHV)只能在特定的细胞中激活IFN-β的表达[10-13]。此外,IBV感染的细胞中IFN转录水平滞后于病毒基因组的累积,形成的双层囊泡结构可以有效阻断感染细胞中干扰素的产生[14-15]。本试验利用IBV流行株感染CEK细胞,通过添加poly(I∶C)并进行qRT-PCR检测,证明了IBV可以有效的抑制由双链RNA诱导的I型IFN在CEK细胞中的表达。
冠状病毒可通过编码某种蛋白抑制或拮抗宿主的抗病毒先天免疫反应。有研究表明,SARS-CoV编码的nsp1、nsp3、nsp7、nsp15、S、M、N、3a、3b等都具有拮抗干扰素活性的功能[16-20];MHV编码的nsp1、nsp2、nsp3、5a蛋白以及N蛋白等,均可通过不同方式,抑制宿主干扰素的表达[21-22];体外表达PEDV编码的23个蛋白中有10个具有抑制干扰素表达的活性,其中包括nsp1、nsp3、nsp7、nsp14、nsp15、E、M、N和ORF3[23-24]。对于IBV来说,辅助蛋白3a和5b通过抑制IFN-β介导的抗病毒通路的激活,或诱导宿主蛋白翻译的关闭来抑制I型IFN的产生,从而抵抗机体抗病毒反应[15,25-26]。由此可见,冠状病毒拮抗IFN表达的蛋白绝大多数集中于非结构蛋白,其次是辅助蛋白和结构蛋白,而针对IBV的机理研究,目前没有确定是何种非结构蛋白在此过程中发挥关键作用,而且目前的研究多基于天然无毒力的Beaudette株或是疫苗株M41株,细胞多使用非鸡源的细胞系,不能很好的反应流行株对于天然宿主的抗病毒先天免疫情况。本试验通过构建IBV流行株的非结构蛋白真核表达载体,转染鸡源DF-1细胞,同时转染双链RNA类似物poly(I∶C)进行刺激,检测非结构蛋白对I型IFN表达的影响。结果显示,IBV JS株的nsp3、nsp4、nsp7、nsp14和nsp15均可显著抑制IFN-β的表达水平,其中nsp7、nsp14和nsp15与前人的结果一致,而nsp4对于IFN-β表达的抑制作用可能是IBV特有的。本试验筛选了nsp4和nsp15进行浓度梯度的质粒转染试验,结果验证了这2种蛋白对I型IFN的抑制作用呈剂量依赖性。
先天性免疫反应是一系列的信号级联反应,由模式识别受体(RIG-I或MDA5等)通过识别并结合进入细胞的病毒以及其复制产物来启动,激活下游IRF3信号通路或并行的NF-κB通路,从而诱导I型IFN的转录及表达[27-29]。许多冠状病毒编码的蛋白会以IRF3或NF-κB为靶点来逃避先天性免疫反应。PEDV的E蛋白和N蛋白可诱导内质网应激,可以导致NF-κB信号通路的激活;MERS-CoV以及蝙蝠冠状病毒编码的辅助蛋白4a,可以阻断NF-κB信号通路而抑制I型IFN的产生;SARS-CoV的nsp1可以阻断NF-κB、IRF3和IRF7的激活,并通过阻止STAT1的磷酸化抑制IFN依赖的信号通路的活化,SARS-CoV的木瓜样蛋白酶(PLP)可以通过调节NF-κB抑制剂IκBα,从而阻断NF-κB信号通路[21,24-25]。为了探究nsp4和nsp15抑制I型IFN的作用机理,本试验分别检测了2种蛋白对NF-κB和IRF3基因转录的影响,结果表明,nsp4蛋白可显著的抑制NF-κB和IRF3的表达,且呈剂量依赖性;而nsp15蛋白只能显著抑制NF-κB的表达,呈剂量依赖性,但对IRF3的表达无影响。上述内容说明,IBV nsp4蛋白可能是通过同时影响NF-κB信号通路以及IRF3信号通路来拮抗下游IFN-β的表达,而nsp15蛋白对IFN-β表达的抑制作用可能是通过阻断NF-κB而不是IRF3来实现的。这2种蛋白是如何影响NF-κB或IRF3的表达,仍需继续研究其上游蛋白的影响来进一步确认。
