外来种福寿螺(Pomacea canaliculata)对3种沉水植物的牧食偏好及水体理化因子的响应*
2021-07-07康玉辉张泽慧廖明军焦一滢赵以军
杨 诚,康玉辉,高 健,张泽慧,苗 滕,廖明军,焦一滢,赵以军
(1:湖北工业大学河湖生态修复与藻类利用湖北省重点实验室,土木建筑与环境学院,武汉 430068)(2:湖北省水利水电科学研究院,武汉 430070)
在浅水湖泊生态系统中,沉水植物通过防止再悬浮、吸收营养盐等方式减少水体营养盐、抑制藻类生长[1-4],最终提高水体透明度,并维持清水态的稳定性.然而,在浅水湖泊中,随着外源营养盐负荷的增加,会引起水体富营养化,湖泊逐步从以底栖沉水植物为优势的清水态(草型湖泊)转变为以浮游藻类为主的浑水态(藻型湖泊)[5-6],即稳态转换.在浅水富营养化湖泊的生态治理中,为了恢复清水态生态系统,在外源负荷削减、鱼类去除、底泥治理、沉水植物种植等措施实施后,沉水植物难以恢复或长期维持较高覆盖度[7-8],重新繁衍的草食性鱼类的牧食往往对沉水植物现存量或恢复重建产生威胁[9-11].外来种福寿螺(Pomaceacanaliculata)已经在亚洲、欧洲和非洲等地成功入侵并导致沉水植物生物量急剧下降或沉水植物重建失败[12-14],这可能是促使湖泊从草型清水态向藻型浑水态转变[15-16]的另一关键因素.
福寿螺原产自南美洲,属中腹足目、瓶螺科、瓶螺属,繁殖力很强,适应环境能力强,且耐寒性逐步提升[17],再加上气候变暖的影响[18],增加了福寿螺从热带亚热带地区向温带地区扩散的可能性.在我国,福寿螺的潜在适生区主要分布在30°N以南地区,部分地区跨过了30°N线;模型研究表明其扩散速度持续增长,在南方的分布区将会继续扩大,甚至会有向北扩散的趋势[12,19].目前,浙江、福建、江西、广东、广西、海南和台湾等省已成为我国福寿螺的高分布区,上海、湖北、湖南、四川、西藏、贵州、重庆和云南为中分布区,但也具有较高的潜在爆发风险[12].福寿螺啃食水稻等农作物,会严重破坏入侵地农业经济[20],因此2003年我国已把福寿螺列入首批16种“危害最大的外来物种”名单[21].不仅如此,福寿螺入侵自然水体会改变栖息地沉水植物群落结构,会对根茎叶有不同程度的牧食,甚至导致沉水植物群落消失[22].福寿螺幼年期以浮游藻类和碎屑为食,成年主要以水生植物为食物[23],然而不同植物对福寿螺牧食的响应存在差异,如气温15~30℃条件下在福寿螺优先牧食枝轮藻(Characontraria)、角果藻(Zannichelliapalustris)和Stuckeniastriata,而绿穗花狐尾藻(Myriphyllumquitense)和黄花水龙(Ludwigiapeploides)受到影响较小,但实验结束时生物量均显著降低[24].将福寿螺置于水温18~24℃共培养的苦草(Vallisnerianatans)、穗花狐尾藻(Myriophyllumspicatum)、轮叶黑藻(Hydrillaverticillata)中,能够显著降低沉水植物群落的总生物量[25].福寿螺牧食沉水植物的差异性会导致栖息地的水体营养盐响应变化不同[13,25].
现今,沉水植物重建工程在我国热带亚热带的浅水富营养湖泊尤其是城市湖泊中正在大量实施,沉水植物重建后的湖泊水质和景观效果多数得到改善[26-28].虽然大量研究证实底栖动物尤其是螺对水体中藻类、有机碎屑、无机颗粒有净化效果[29],其中福寿螺也能够有效控制水体中丝状藻的生长和藻类“水华”的暴发[30-31],间接有利于沉水植物的生长.然而,在一些成功恢复沉水植物的城市清水态湖泊和湿地中,福寿螺入侵导致重建的沉水植物消失,如暨南大学校内人工湖[32],沉水植物恢复覆盖度高达100%,但在福寿螺入侵并大量繁殖后沉水植物覆盖度大大下降,加大了富营养化湖泊修复的难度;而在温州三垟湿地,福寿螺入侵后几乎啃食了所有的水生植物[33].随着人为有意或无意的携带以及自然气候、水系流动等因素产生的自然扩散,福寿螺的分布将会继续扩大范围,因而应对其产生的负面影响更加重视.在我国,目前草甸型密刺苦草(V.denseserrulata)、冠层型轮叶黑藻和穗花狐尾藻因其景观效果好、耐污染能力强等特性已经作为浅水湖泊沉水植物重建的优先选择种[34-37].本文假设3种植物不同搭配对福寿螺牧食的响应及其系统变化存在差异,研究结果可以指导如何在生态修复工程中合理搭配植物种类抵御福寿螺牧食[38].基于以上背景,拟通过设置密刺苦草、轮叶黑藻、穗花狐尾藻两两组合系统,探究福寿螺的牧食偏好以及不同植物组合系统理化因子的响应变化.
1 材料与方法
1.1 实验材料
密刺苦草、轮叶黑藻、穗花狐尾藻均采集于湖北省武汉市内沙湖.沉水植物培养底泥采自武汉市南湖出水河道——巡司河,将底泥自然风干、混匀并剔除其中大块杂质后备用.福寿螺采集于野外自然水体,挑选均匀大小个体用于本实验(福寿螺重(26.0±6)g,壳高(3.25±0.75)cm,壳长(4.25±0.75)cm).在开始实验前,福寿螺饥饿处理24 h.
1.2 实验设计
实验在18个聚乙烯塑料圆形大桶(上部直径为60 cm,底部直径为50 cm,高度为70 cm)中进行,桶内放入约15 cm厚底泥(总氮(TN)=1.9 mg/g,总磷(TP)=0.52 mg/g),桶放置在带顶棚的室外实验水池内.将自来水(TN=1.08 mg/L;TP=0.11 mg/L)加入桶至65 cm,在桶中间采用45 cm×65 cm带孔(孔为边长5 cm正方形)不锈钢丝网把桶隔为两部分(钢丝网的作用把沉水植物分割为两部分,避免两种植物影响彼此生长,而螺可以两边自由移动).自来水放置48 h后,分别两两种植沉水植物,即密刺苦草+轮叶黑藻组、密刺苦草+穗花狐尾藻、轮叶黑藻+穗花狐尾藻组各6桶.沉水植物种植株数选择约相同生物量的密刺苦草25株、轮叶黑藻30株、穗花狐尾藻10株(轮叶黑藻和密刺苦草植株高约50 cm,穗花狐尾藻株高约60 cm,均带根),两种沉水植物分别种植在钢丝网两边.
培养5周后,3种植物在其种植空间的覆盖度约100%(每种植物各占桶表面覆盖度的50%).因植物生长速度差异,放福寿螺前初步观察实验桶中沉水植物生物量为轮叶黑藻>密刺苦草>穗花狐尾藻.在各组植物组合中分别选择3个桶各加入2只福寿螺,为实验组;各组另外3个桶作为对照组.
实验在2019年7月31日至9月3日期间进行,实验持续到部分桶内沉水植物被大量牧食甚至消失时终止,历时28 d.实验桶放置在用仅由立柱搭建的防雨顶棚内,顶棚材质为透明PVC材料,四周通风,光照为自然光照,水温(33±1.5)℃.
1.3 采样与分析方法
水质理化指标:每周从每个桶中采集表层下约10 cm处水样500 mL,用于分析TN、氨氮(NH3-N)、TP、正磷酸磷(SRP)、叶绿素a(Chl.a)浓度.TN、NH3-N、TP、SRP和Chl.a浓度检验方法依据《水和废水监测分析方法(第四版)》[39],TN浓度采用碱性硫酸钾消解紫外分光光度法测定,NH3-N浓度采用纳氏试剂分光光度法测定,TP浓度采用过硫酸钾消解紫外分光光度法测定,SRP浓度采用钼锑抗分光光度法测定,Chl.a浓度用90%丙酮避光提取后用分光光度法测定.
沉水植物指标:每两天统计一次密刺苦草、轮叶黑藻、穗花狐尾藻的断枝叶数量并称量湿重(捞出断枝后不放回),7 d为一个统计数据周期.实验前后测量沉水植物的高度变化(随机选择8~10株植株测量均值,密刺苦草测量根部到叶片顶端距离,轮叶黑藻测量根部到顶端最长距离,穗花狐尾藻测量根部到顶端最长距离).实验结束后统计每个实验水桶内剩余沉水植物湿重.
沉水植物总酚含量:植物整株采集后,洗净然后用剪刀剪下不同部位(叶、茎、根),80℃分别烘干至恒重后磨成粉末,测量沉水植物的根、茎、叶的总酚含量.其中苦草茎为地下茎,轮叶黑藻和穗花狐尾藻由于根样品量较少而没有测定.植物总酚含量采用Folin-Ciocalteu 比色法试验方法测定,在含有酚类物质的待测试样中加入一定量的FC试剂和一定量的10%碳酸钠溶液,定容至25 mL,在一定温度下避光反应一定时间,以蒸馏水为空白,测定试样液体的吸光度值,依据没食子酸标准工作曲线的拟合方程,计算试样中的总多酚含量[39].
福寿螺对3种沉水植物附着偏好统计:每天上午10:00和下午4:00观察该时间点福寿螺所附着的沉水植物种类并作记录,0~7、8~14、15~21、22~28 d分别为一个数据统计周期,计算每个周期的附着率.本研究通过记载福寿螺的附着偏好,拟作为指示福寿螺的牧食偏好的指标之一[40-41].
“有着殖民地半殖民地人民最可宝贵的性格,即没有丝毫的奴颜与媚骨”[1]698的鲁迅是一个无可非议的爱国者。人们注意到的更多的,或许是他在文学所展现的“格式的特别和表现的深切”,然而这些还远远不够,作为爱国者的鲁迅,救国才是其思想发展的主流,鲁迅的救国思想不断发展变化,经历了从科技救国到文艺救国到革命救国的转变。
1.4 数据处理及分析
水质理化指标和沉水植物指标在加入福寿螺后随时间变化的趋势分析,采用以时间为重复因子的重复测量方差分析(repeated measures analyses of variance with time as the repeated factor,RM-ANOVAs)方法进行,在进行方差分析之前使用Levene’s test检验数据是否满足方差齐性的假设.而实验组和对照组间的比较方差分析采用LSD多重比较法.
所有统计分析均采用SPSS 19.0软件(SPSS,USA)进行分析.数据以平均值±标准差表示.实验组与对照组有显著性差异用*在图上标示.
2 结果与分析
2.1 福寿螺对3种沉水植物的影响研究
2.1.1 3种沉水植物体内总酚含量分析 轮叶黑藻茎和叶片中总酚含量显著低于密刺苦草和穗花狐尾藻植物各部位的总酚含量(P<0.01);密刺苦草叶片中总酚含量显著低于茎和根内的总酚含量(P<0.01);穗花狐尾藻茎内总酚含量显著高于叶片内总酚含量(P<0.01),且均显著高于密刺苦草和轮叶黑藻植物各部分体内的总酚含量(P<0.01)(图1).

图1 密刺苦草、轮叶黑藻和穗花狐尾藻总酚含量
2.1.2 福寿螺对3种沉水植物的附着偏好 在轮叶黑藻+穗花狐尾藻组中(图2a),加入福寿螺后的前3周福寿螺主要附着在轮叶黑藻上(P<0.05);到加入福寿螺后的第4周,由于轮叶黑藻被牧食生物量大大减少,福寿螺对轮叶黑藻和穗花狐尾藻附着的选择比例趋于相当,结果表明福寿螺优先选择附着轮叶黑藻.在轮叶黑藻+密刺苦草组中(图2b),加入福寿螺后的前2周,福寿螺对轮叶黑藻、密刺苦草的选择附着性无显著差异,而在加入福寿螺后的3~4周,随着轮叶黑藻量的减少,福寿螺对密刺苦草的附着比例逐渐更高(P<0.05).在密刺苦草+穗花狐尾藻组中(图2c),实验期间福寿螺均主要附着在密刺苦草上(P<0.05),表明福寿螺优先选择附着密刺苦草.
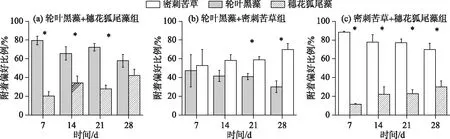
图2 福寿螺对不同沉水植物的附着偏好
2.1.3 福寿螺对3种沉水植物的牧食偏好比较 在轮叶黑藻+穗花狐尾藻组中(图3a),实验结束时轮叶黑藻生物量显著低于对照组(P<0.05),穗花狐尾藻生物量与对照组相比无显著变化;在实验过程和实验结束时均观察到,实验组轮叶黑藻和穗花狐尾藻均只剩下茎,表明福寿螺牧食的主要是叶片.在轮叶黑藻+密刺苦草组中(图3b),实验结束时实验组剩余密刺苦草和轮叶黑藻生物量相对于对照组显著减少(P<0.05).在密刺苦草+穗花狐尾藻组中(图3c),实验组密刺苦草生物量与对照组相比显著减少(P<0.05),而穗花狐尾藻生物量与对照组相比无显著变化;在实验过程和实验结束时均观察到,实验组密刺苦草叶片由于被牧食而变短,而穗花狐尾藻叶片也多数被福寿螺牧食.

图3 福寿螺对3种沉水植物的牧食偏好
在轮叶黑藻+穗花狐尾藻组中,实验结束时实验组沉水植物剩余生物量湿重均值为(56±83)g,而无螺组沉水植物剩余量为(810±209)g,相对减少了93.1%;在轮叶黑藻+密刺苦草组中,实验组沉水植物剩余生物量均值为(408±102)g,而无螺组沉水植物剩余量为(964±224)g,相对减少了57.7%;而在密刺苦草+穗花狐尾藻组中,实验组沉水植物剩余生物量均值为(387±178)g,而无螺组沉水植物剩余量为(826±210)g,相对减少了53.1%.
2.1.4 福寿螺放置前后3种沉水植物植株高的差异分析 在轮叶黑藻+穗花狐尾藻组中(图4a),实验结束时实验组轮叶黑藻株高降低约0.35 m,相对于对照组显著降低(P<0.05),而穗花狐尾藻株高相对对照组无显著变化;在实验过程中观察到福寿螺牧食易导致轮叶黑藻茎大量折断漂浮在水面,而穗花狐尾藻尽管叶片在实验结束时被福寿螺牧食,但其茎很少折断.在轮叶黑藻+密刺苦草组中(图4b),实验结束时实验组轮叶黑藻和密刺苦草的株高降低分别约0.44和0.36 m,相对对照组均显著降低(P<0.05).在密刺苦草+穗花狐尾藻组中(图4c),实验结束时实验组密刺苦草株高降低约0.27 m,相对对照组显著降低(P<0.05);而穗花狐尾藻实验组与对照组株高变化无显著区别.实验期间观察发现福寿螺主要是通过直接牧食叶片或牧食密刺苦草叶片中间部位导致叶片折断而显著降低植株叶片高度,而对轮叶黑藻是牧食或扰动导致轮叶黑藻茎折断而显著降低植株高度.尽管福寿螺会牧食穗花狐尾藻叶片,但对穗花狐尾藻茎的牧食很少,不会显著影响植株高度.

图4 福寿螺对3种沉水植物植株株高的影响
2.1.5 福寿螺对3种沉水植物形成断枝的比较分析 在轮叶黑藻+穗花狐尾藻组中(图5a),加入福寿螺后的前3周在水面收集的轮叶黑藻断枝量显著高于穗花狐尾藻(P<0.05),加入福寿螺后的第4周收集的轮叶黑藻和穗花狐尾藻断枝均大大减少且二者数量无显著差异;4周共收集轮叶黑藻和穗花狐尾藻断枝湿重均值分别为118和31 g.在轮叶黑藻+密刺苦草组中(图5b),加入福寿螺后的第1周、3周、4周时收集的轮叶黑藻断枝和密刺苦草断叶数量没有显著差异,仅在加入福寿螺后的第2周收集到轮叶黑藻断枝量显著少于密刺苦草漂浮叶片数量(P<0.05);4周共收集轮叶黑藻和密刺苦草断枝湿重均值分别为101和126 g.在密刺苦草+穗花狐尾藻组中(图5c),密刺苦草折断叶片漂浮数量显著高于穗花狐尾藻断枝量(P<0.05);4周共收集密刺苦草和穗花狐尾藻断枝湿重均值分别为126和18 g.

图5 福寿螺对3种沉水植物断枝数量的影响
2.2 福寿螺对水体营养盐影响
2.2.1 总磷和正磷酸盐 在加入福寿螺后,3个实验组中总磷和正磷酸盐浓度随时间递增呈升高趋势(图6).在轮叶黑藻+穗花狐尾藻和轮叶黑藻+密刺苦草实验组中,总磷和正磷酸盐浓度均随时间递增显著升高(RM-ANOVAs,P<0.05)(图6a,b,d,e).而在密刺苦草+穗花狐尾藻实验组中,总磷和正磷酸盐浓度在第14~21天期间有下降,其余时间段为总磷浓度随时间递增上升(图6c,f).
在轮叶黑藻+密刺苦草和密刺苦草+穗花狐尾藻实验中,加入福寿螺后的第3周和第4周总磷和正磷酸盐浓度实验组高于对照组(LSD,P<0.05),其余时间无显著差异(图6b、c、e、f).

图6 实验组和对照组水体总磷和正磷酸盐浓度的动态变化
2.2.2 总氮和氨氮 在加入福寿螺后,仅在轮叶黑藻+穗花狐尾藻实验组中,总氮浓度随时间递增呈显著升高(RM-ANOVAs,P<0.05),且在加入福寿螺后的第2周和第3周实验组总氮浓度显著高于对照组(LSD,P<0.05)(图7a).在轮叶黑藻+密刺苦草组中,仅第4周实验组总氮浓度显著高于对照组(LSD,P<0.05)(图7b).而在密刺苦草+穗花狐尾藻组中,实验组总氮浓度与对照组在实验期间均无显著(LSD,P>0.05)(图7c).
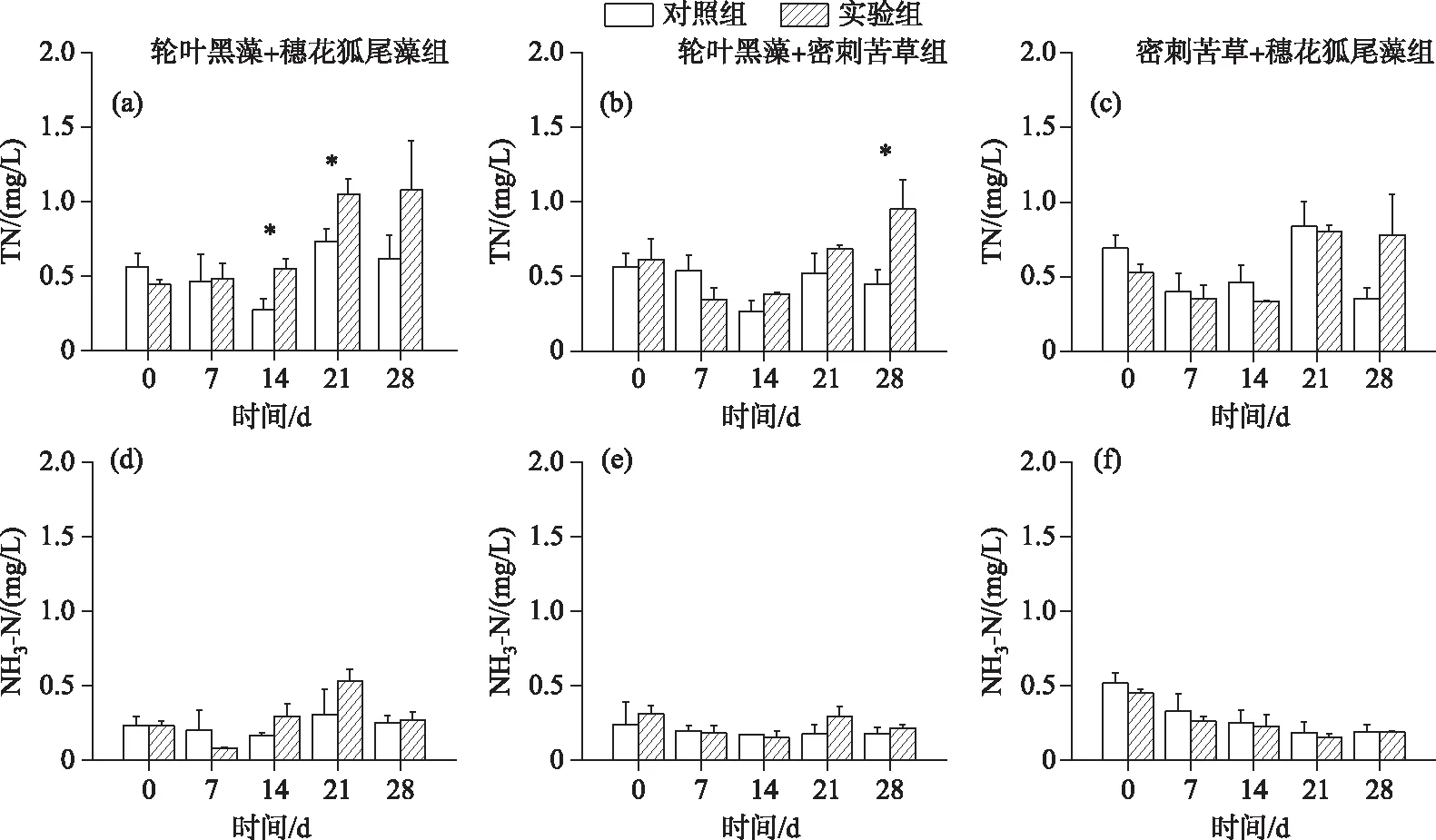
图7 实验组和对照组水体TN和NH3-N浓度的动态变化
在加入福寿螺后,3组实验中实验组和对照组在4周实验期间氨氮浓度均无显著差异(LSD,P>0.05).
2.2.3 叶绿素a在加入福寿螺后,仅轮叶黑藻+穗花狐尾藻组中,在加入福寿螺后的第4周实验组中叶绿素a浓度显著高于对照组(LSD,P<0.05)(图8).在轮叶黑藻+密刺苦草组和密刺苦草+穗花狐尾藻组中,实验组与对照组的叶绿素a浓度在实验期间均无显著差异(LSD,P>0.05).

图8 实验组和对照组水体Chl.a浓度的动态变化比较
3 讨论
本研究中福寿螺对3种沉水植物的生长均有显著的负面影响,但沉水植物及其不同植物组合系统理化因子对福寿螺的牧食响应却呈现较大的差异性.通过比较福寿螺对不同组合的沉水植物系统的影响,轮叶黑藻和密刺苦草被牧食破坏而降低的生物量最大,但是冠层型轮叶黑藻整体被牧食和穗花狐尾藻叶片几乎全部被牧食而导致其生存受到的负面影响最大,草甸型密刺苦草受到的负面影响相对较小.3种组合中沉水植物整体生物量均下降,系统中水体营养盐和Chl.a浓度均呈现不同程度的升高,不利于清水态系统的稳定,但不同沉水植物组合系统理化因子的变化存在差异性.
福寿螺对沉水植物的牧食具有偏好性,优先牧食轮叶黑藻或密刺苦草,其原因可能与福寿螺本身的牧食方式和植物的营养价值、防御机制和生长特性有关.福寿螺为舔刮式牧食,倾向于牧食高营养、低韧性、纤维素和酚类含量低的植物[38,42].植物的化学防御是影响福寿螺对其牧食的关键因子之一.研究已表明轮叶黑藻对牧食动物的化学防御能力低于密刺苦草和穗花狐尾藻[43-44],轮叶黑藻这种生长较快的水生植物更容易受到螺类的影响[45].与本研究不同的是,何日利在18.8~24.0℃条件下,研究福寿螺对密刺苦草、穗花狐尾藻和轮叶黑藻共存系统的牧食,结果表明其偏爱牧食密刺苦草和穗花狐尾藻,而较少牧食轮叶黑藻,何日利判断可能是因为轮叶黑藻酚类化合物含量较高[32],但该研究并没有实测轮叶黑藻酚类含量.本研究同期测定的总酚含量结果为穗花狐尾藻>密刺苦草>轮叶黑藻,其中穗花狐尾藻总酚含量显著更高.袁昌波等研究也表明穗花狐尾藻总酚含量((16.98±2.66)mg/g)显著高于密刺苦草((3.40±0.21)mg/g)和轮叶黑藻((5.22±1.30)mg/g),与本研究结果类似[43].Sun等研究也发现沉水植物体内酚类化合物——黄酮含量表现为穗花狐尾藻>密刺苦草>轮叶黑藻,而草鱼对其的牧食量表现为轮叶黑藻>密刺苦草>穗花狐尾藻,沉水植物被牧食的量与植物体内的黄酮含量呈显著负相关[44].除了酚类等次生代谢物高低可能影响福寿螺的附着和牧食喜好外,3种植物的茎/叶韧性、硬度及其纤维素、半纤维素和木质素含量等也对牧食起到机械防御作用,轮叶黑藻和密刺苦草相对穗花狐尾藻更加脆弱、机械强度更低[44],可能最易受到牧食的影响而消亡.本研究中福寿螺对3种沉水植物的附着偏好表现为密刺苦草>轮叶黑藻>穗花狐尾藻,也表明福寿螺更喜爱栖息于密刺苦草和轮叶黑藻上.无脊椎动物尤其是螺类往往会被沉水植物所释放的的化学信号所吸引而偏好牧食和栖息[42-43].需要说明的是,本研究中尽管在放入福寿螺时2种沉水植物生物量存在差异,但福寿螺在实验开始时均优先选择密刺苦草和轮叶黑藻附着,综合可以看出福寿螺相对更喜食密刺苦草和轮叶黑藻.
福寿螺对轮叶黑藻牧食为整体性牧食,包含叶片和茎,会导致轮叶黑藻整体消亡;对于密刺苦草,福寿螺多牧食叶片,密刺苦草根部在底泥中扎根较深,茎短不明显,福寿螺无法对密刺苦草其他部位造成过多影响[46],但是密刺苦草幼苗生长发育可能会受到牧食的影响[45];福寿螺主要牧食穗花狐尾藻的部位是叶片,原因可能是穗花狐尾藻茎较粗壮且总酚含量更高,福寿螺对其茎牧食较少,并且穗花狐尾藻再被牧食时会提高体内酚类的含量[47],这也会降低福寿螺对其牧食的可能性.综合分析,福寿螺牧食破坏对轮叶黑藻影响最为严重,其整体会因福寿螺牧食而很快消亡;穗花狐尾藻叶片几乎全部被福寿螺牧食,导致其生长及发育受到严重的不利影响;福寿螺对于密刺苦草只会导致其最顶层一部分叶片被牧食,但是根茎都保存完好,密刺苦草整体生长状态保持最好.但长期来说,福寿螺(尤其是在高密度条件下)对3种植物的牧食破坏均具毁灭性[32].
福寿螺入侵后对水体营养盐的影响一部分来自沉水植物生物量下降,导致沉水植物对水体净化能力减弱,但是螺自身排泄也会对水体营养盐浓度产生影响[48],并且螺类牧食会影响氮、磷的释放和同化[49].在本研究中,在放入福寿螺之前3组组合沉水植物覆盖度均高,植物生长良好,其水体营养盐较低且无显著差异.然而,放入福寿螺后,在轮叶黑藻+密刺苦草组和密刺苦草+穗花狐尾藻组,当植物被牧食后总磷和正磷酸盐浓度开始升高,并在实验结束时显著高于对照组;而轮叶黑藻+密刺苦草组和轮叶黑藻+穗花狐尾藻组,当植物被牧食后总氮浓度呈上升趋势.沉水植物对水体均具有非常强的净化能力,但不同种对水体营养盐净化能力还与水体和基质中的营养盐以及植株生物学特征等有关.例如,一些研究表明黑藻净化水体中氮和磷的能力强于金鱼藻[50-51],但另外一些研究结果却与之截然相反[52].金树权等研究结果显示对水体氮磷的吸收效率为:轮叶黑藻>金鱼藻>苦草>穗状狐尾藻>微齿眼子菜,且沉水植物吸附、提高微生物转化等作用对氮磷从水体去除的贡献率要大于直接吸收作用[53].而任文君等研究表明金鱼藻和黑藻对水体总磷主要为超量吸收,蓖齿眼子菜和马来眼子菜以吸附沉降为主[54],这与金树权等的结果不同.在本研究中,密刺苦草对氮、磷展现较强的固定能力[55],当密刺苦草被牧食后,实验组营养盐浓度显著高于对照组.此外,轮叶黑藻+穗花狐尾藻组合中植物生物量减少最高(93.1%),其在实验结束时Chl.a浓度也显著升高,而有密刺苦草的另外两组中Chl.a浓度未出现显著升高,其主要原因是沉水植物还保持一定的生物量,能够抑制藻类的增加[4].方玲[30]通过原位围隔实验研究发现(短期,33天)福寿螺入侵后水体中氮、磷的浓度均维持在低水平,而且与福寿螺的密度不相关;关于Chl.a浓度和浮游藻类的群落结构,二者变化与体系中的植物种类有关联,如在穗花狐尾藻实验中,随着福寿螺密度的增加,Chl.a浓度增加,隐藻逐渐成为优势藻群;而在凤眼莲实验中,随着福寿螺密度的增加,Chl.a浓度表现出无规律的变化,但浮游藻类却逐渐呈现出隐藻、绿藻和硅藻占优势的结构[30].
本研究结果能够为富营养湖泊的沉水植被重建和管理提供科学指导依据.在富营养化湖泊沉水植物重建过程中,选择适宜的植物是有效减少福寿螺对水生态修复结果产生负面影响的关键方法[44].此外,在一些湖泊修复工程中,轮叶黑藻和穗花狐尾藻因其冠层顶端优势,具有较强的环境适应及繁殖能力[26,56-57],常作为先锋种[45],利用其快速生长和植株较长的特点迅速提高水体透明度.然而,轮叶黑藻和穗花狐尾藻生物量主要集中于水体表面,容易引起水体底部的光照不足和缺氧[58],故湖泊水质改善后往往要去除轮叶黑藻和穗花狐尾藻,让苦草等草甸型沉水植物占据优势,有利于维持清水型系统稳定[59].除了人工调节轮叶黑藻和穗花狐尾藻的优势度外,水生动物如团头鲂、螺对沉水植物的偏好牧食破坏也能够用于沉水植物群落的管理[11,60-61].但对外来种福寿螺来说,尽管在巴西有利用其偏好牧食破坏来控制外来种轮叶黑藻的过度生长[62],但其在我国蔓延后危害大,因此不建议用来调控沉水植物结构.
4 结论
1)福寿螺对沉水植物具有明显的附着牧食偏好,其附着偏好为密刺苦草>轮叶黑藻>穗花狐尾藻,密刺苦草的叶片和轮叶黑藻的茎更易受到福寿螺的牧食而折断.福寿螺对沉水植物生长的破坏强度为轮叶黑藻>穗花狐尾藻>密刺苦草,轮叶黑藻最容易受到福寿螺牧食破坏而快速消亡,穗花狐尾藻叶片也会被全部牧食仅剩下茎而无法生长,密刺苦草的生长受到的影响相对较小.
2)福寿螺入侵密刺苦草、轮叶黑藻、穗花狐尾藻3种植物两两组合系统最终会降低系统植物总生物量,影响沉水植物对水体的净化能力,导致系统中水体营养盐和叶绿素a浓度呈现不同程度的升高,但不同沉水植物组合系统理化因子的变化存在差异.
3)福寿螺的偏好牧食损害能够抑制冠层型穗花狐尾藻和轮叶黑藻的优势地位,让密刺苦草生物量占比相对更高,但密刺苦草的绝对生物量也会因福寿螺的牧食而降低,甚至最后也会被牧食殆尽.
