3-硝基吡咯烷-1-羧酸叔丁基酯的合成*
2021-07-07王晓霞徐小娜
王晓霞,徐小娜
(咸阳职业技术学院 医药化工学院,陕西 咸阳 712000)
吡咯烷类结构单元常见于化学药物、生物活性物质、精细化学品[1-5]等分子结构中,在有机结构的构建中具有广泛的应用。吡咯烷酮衍生物及各种取代的吡咯烷衍生物是重要的化学合成原料及中间体,如促进智力发育药物吡拉西坦(Piracetam)[6]、急性骨髓性白血病治疗药物艾伏尼布(Ivosidenib)[7]、广谱性蛋白激酶抑制剂米哚妥林(Midostaurin)[8]、预防癌症化疗术后恶心呕吐药物罗拉吡坦(Rolapitant)[9]、抑制血糖作用的特力利汀(Teneligliptin)[10]、多发性骨髓瘤治疗药物来那度胺(Lenalidomide)[11]、抗菌作用的多尼培南(doripenem)[12]中都含有吡咯烷结构片段。吡咯烷酮及各种取代吡咯烷衍生物作为重要的化学中间体具有一定的开发价值。本文开发了3-硝基吡咯烷-1-羧酸叔丁基酯(1)的合成,并优化其合成工艺,为吡咯烷类物质的工艺优化、路线改造、新物质开发及药物研发提供一定参考。
1 实验部分
1.1 仪器与试剂
AV400型核磁共振仪(CDCl3为溶剂,TMS为内标 德国Bruker公司);Ultima Global Spectrometer型质谱仪(ESI源)(美国Waters公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);SHB-Ш循环水式多用真空泵(巩义市予华仪器有限责任公司)。
盐酸羟胺(NH2OH·HCl)、过氧化脲(UHP)、三氟乙酸酐(TFAA),百灵威科技有限公司;柱层析硅胶(300~400目 青岛海洋化工厂);Na2HPO4、NaHCO3、乙腈、乙醇等其他试剂均为市售分析纯。
1.2 实验方法
1.2.1 合成路线 以1-Boc-吡咯烷酮(2)为原料,在NaHCO3做碱的条件下与盐酸羟胺发生氨肟化反应,得1-Boc-3-吡咯烷酮肟(3),化合物(3)在三氟乙酸酐存在下,经过氧化脲(UHP)氧化反应可得目的物3-硝基吡咯烷-1-羧酸叔丁基酯(1),合成路线见图1。
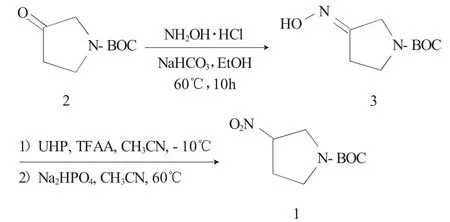
图1 3-硝基吡咯烷-1-Boc的合成路线Fig.1 Synthetic route for 3-nitropyrrolian-1-Boc
1.2.2 合成方法
(1)1-Boc-3-吡咯烷酮肟(3)的合成 在10L反应釜中加入4L EtOH,1-Boc-吡咯烷酮(2)(685g,3.7mol),混合均匀后加入NaHCO3(466g,5.55mol),黄色溶液变为白色浑浊液,加入NH2OH·HCl(283g,4.07mol),升温至60℃,反应过夜;TLC监测反应完毕,减压浓缩除EtOH溶剂,加EA,抽滤除去白色固体,滤液加H2O萃取(4L),有机相用饱和NaCl洗涤,无水Na2SO4干燥,减压浓缩,得白色固体729g,收率98.5%。1H NMR(CDCl3,400MHz):8.800~8.825(br,1H),4.024~4.117(dd,2H),3.565~3.588(dd,2H),2.668~2.776(m,2H),1.456(s,9H)。
(2)3-硝基吡咯烷-1-羧酸叔丁基酯(1)的合成 在3L三口瓶中加UHP(345g,3.75mol),乙腈(800mL),在N2保护下,用干冰丙酮浴控温在-10~0℃,滴加三氟乙酸酐TFAA(692g,3.3mol)的乙腈溶液(1.2L),体系澄清呈淡黄色,备用。在另一个10L反应釜中加入化合物2(300g,1.5mol),乙腈1.8L,Na2HPO4(1064g,7.49mol),N2保护,升温至60℃。将UHP体系缓慢滴加至化合物2体系中,边滴加边反应,TLC监测反应完毕,加水降温(6L),乙酸乙酯萃取(2L×2),有机相用饱和NaHCO3调pH值为7,再经饱和Na2S2O3溶液、饱和NaCl溶液洗涤,有机相减压浓缩,粗品经柱层析(PE∶EA=5∶1)纯化得白色固体193g,收率60%。1H NMR(CDCl3,400MHz):4.964~5.023(m,1H),4.019~4.062(m,1H),3.686~3.751(m,1H),3.521~3.569(m,1H),2.558~2.578(m,1H),2.282~2.330(m,1H),1.450(s,9H)。ESI-MS(m/z):161.0[M-56]+。
2 结果与讨论
2.1 物料比n盐酸羟胺∶n2对化合物(3)收率的影响
1-Boc-吡咯烷酮(2)和盐酸羟胺经肟化反应制备化合物(3),按照1.2.2第一步反应条件,在其他条件不变的情况下,考察了反应物料比,即n盐酸羟胺:n2对化合物(3)收率的影响,结果见表1。

表1 物料比对化合物(3)收率的影响Tab.1 Effect of mole ratio on the yield of compound 3
由表1可知,当物料比n盐酸羟胺∶n2=1.0∶1时,产物收率为88.5%。提高盐酸羟胺的用量,收率有所升高,当n盐酸羟胺∶n2=1.1∶1时,收率可高达到98.5%,反应基本完全,继续增大羟胺用量,结果变化不大。考虑到反应完全及试剂节约化,因而适宜的物料比为n盐酸羟胺∶n2=1.1∶1。
2.2 反应温度对化合物(3)收率的影响
反应温度对羟肟化反应有较明显的影响。按照1.2.2节第一步操作方法,固定n盐酸羟胺∶n2=1.1∶1,及其他条件不变的前提下,考察反应温度对化合物(3)收率的影响,结果见表2。

表2 反应温度对化合物(3)收率的影响Tab.2 Effect of reaction temperature on the yield of compound 3
由表2可看出,当反应温度为40℃时,收率为48.8%,温度为60℃时收率较高,继续升高温度,收率反而有所下降。可能是因为,温度升高反应速率加快,低温时反应不完全,温度过高又对产物有所破坏。因而适宜的反应温度确定为60℃。
2.3 物料比n UHP∶n3对产物(1)收率的影响
第二步氧化反应中,UHP作为氧化剂,其用量对反应有重要影响,按照1.2.2节第二步操作方法,在其他条件固定不变的前提下,考察了物料比nUHP∶n3对产物(1)收率的影响,结果见表3。

表3 物料比n UHP∶n3对产物(1)收率的影响Tab.3 Effect of mole ratio on the yield of compound 1
由表3可知,UHP用量对反应有较明显影响,氧化剂用量较低,反应不完全,随着UHP用量增大,收率有明显提高,可能是因为氧化剂体系UHP/TFAA相对不稳定,需加入过量的UHP以保证足够量的活性氧化剂参与反应。由此单因素水平反应可看到,在nUHP∶n3=2.5∶1时,收率较好,继续增大用量,作用不显著。因此,选定nUHP∶n3=2.5∶1为适宜的物料比。
2.4 溶剂种类对产物(1)收率的影响
第二步氧化反应中,用到了较多试剂参与和调节反应,如有机酸和无机盐,体系的溶解情况对反应有一定影响,因此,考察了溶剂种类对产物(1)收率的影响。按照1.2.2节第二步操作方法,在滴加反应温度为60℃等其他条件固定不变的前提下,考察了溶剂种类对反应结果的影响,结果见表4。

表4 溶剂种类对产物(1)收率的影响Tab.4 Effect of solvent on the yield of compound 1
由表4可知,用乙腈作溶剂,结果相对较理想,用氯仿和1,2-二氯乙烷作溶剂,产物收率较低。可能是因为乙腈对有机物及无机盐均有相对较好的溶解度,同时极性、挥发度以及可到达的温度满足反应的需求,所以,选择乙腈作为此步的反应溶剂。
2.5 反应温度对产物(1)收率的影响
第二步氧化反应中,边滴加边反应,反应活性较强,为放热型反应,反应温度影响产物收率。以乙腈为溶剂,其他条件按照1.2.2节第二步操作方法,在此条件下,考察了滴加时反应温度对结果的影响,见表5。
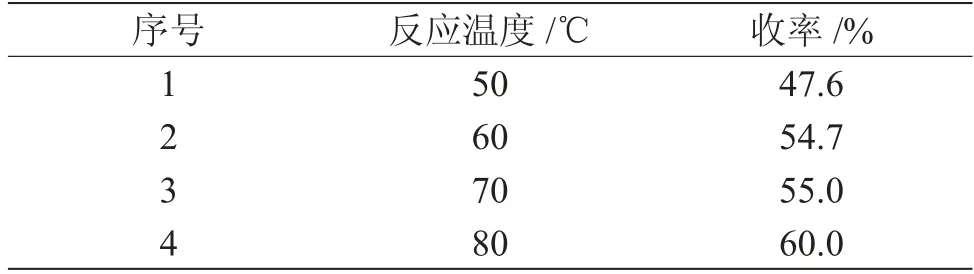
表5 反应温度对产物(1)收率的影响Tab.5 Effect of reaction temperature on the yield of compound 1
由表5可知,随着温度的升高,产物收率升高,到接近乙腈沸点温度80℃时,收率达60.0%。说明在稳定控制的情况下,升高反应温度对反应有利,但温度不宜再高,过高反应将不易控制。因此,选择控制在80℃下滴加氧化剂体系进行反应。
3 结论
以1-Boc-吡咯烷酮(2)为原料,在NaHCO3做碱的条件下与盐酸羟胺发生氨肟化反应,得1-Boc-3-吡咯烷酮肟(3),化合物(3)在三氟乙酸酐存在下,经过氧化脲(UHP)氧化,可得目标化合物3-硝基吡咯烷-1-羧酸叔丁基酯(1)。结构经1H NMR和LCMS表征确证。
优化了反应条件:第一步肟化反应中,物料比为n羟胺盐酸盐∶n1-Boc-3-吡咯烷酮=1.1∶1,反应温度60℃;第二步氧化反应中,物料比nUHP∶n3=2.5∶1,溶剂用乙腈,反应温度80℃。在优化条件下,氨肟化反应的最高收率达98.5%,氧化反应收率可达60%,总收率59.1%。此法合成途径简洁、条件温和、产品质量好、总收率高。该方法为此类物质的合成提供了一种可参考的工艺。
