新型偕胺肟基修饰杯[8]芳烃材料的制备及其吸附性能研究
2021-07-07孟德芹毛宽振李春艳于莉莉
明 强,孟德芹,毛宽振,李春艳,于莉莉
(1.青岛地质工程勘察院(青岛地质勘查开发局),山东 青岛 266100;2.青岛地矿岩土工程有限公司,山东 青岛 266100)
为了缓解全球能源危机,铀资源作为一种核能已被广泛开发。在自然界中主要以两种形式存在:(1)沉积在陆地的铀矿中,(2)以铀酰离子的形式溶解在海水中。从可持续发展的角度考虑,提取核工业及铀矿开采冶炼过程产生的废水中的核素铀,不仅可以降低在开采和处理过程中的铀损失,也可达到保护生态环境的目的。吸附法因操作简单,成本低,是一种较理想的从海水或核废水提取铀研究方法。因此,寻求吸附快速和高容量的吸附剂则是本研究要解决的关键科学问题[1]。目前,吸附剂主要的材料有无机纳米材料[2],生物质复合材料[3],金属有机骨架结构材料(MOFs)[4]、插层结构氢氧化物[5]、改性聚合物[6]等。
近年来,杯芳烃作为一类大环化合物,由于其合成简单,易修饰,低毒性和对金属离子独特的的识别性能,引起了主客体化学研究者的广泛关注。针对不同的金属离子萃取目标,通过改变腔体大小和上下缘功能化修饰,一系列具有不同分子结构参数的杯芳烃衍生物被设计合成。偕胺肟基官能团,由于其对铀酰离子独特的吸附性能而广泛应用于修饰无机或有机高分子聚合物等基体材料[7]。偕胺肟由一组亲核的氨基和羟基组成,其中的氨基氮和肟基氧的孤对电子可以进入UO2+2的空轨道,形成稳定的五元环螯合物,对铀酰离子具有潜在的吸附能力[8]。
1 实验部分
1.1 试剂与仪器
对叔丁基苯酚、二苯醚、二甲基亚砜、N,N-二甲基甲酰胺,均为分析纯,北京市通广精细化工公司;乙酸乙酯、丙酮、无水乙醇、无水MgSO4、NaOH、四氢呋喃,均为分析纯,北京化工厂;溴乙腈、盐酸羟胺,均为分析纯,阿拉丁试剂有限公司;铀原液、铀标准溶液,北京地质研究院;蒸馏水,实验室自制。
RE-2000B型旋转蒸发仪(北京欣旺德实验设备有限公司);JA5003A型电子天平(上海越平科学仪器有限公司);DHG-9070A型真空干燥箱(上海一恒科学仪器有限公司);SHZ-DL(Ⅲ)型循环水真空泵(上海亚荣生化仪器厂);DF101S型集热式恒温加热磁力搅器(巩义市予华仪器有限公司)。
1.2 材料的制备
偕胺肟基修饰亚甲基桥杯[8]芳烃的制备共分为3步:
(1)母体制备 以二甲苯为溶剂,分别向三口烧瓶中加入一定量的对叔丁基苯酚、多聚甲醛。N2保护下,加热回流6h。冷却、过滤,用水洗涤滤饼,烘干得到淡黄色粗产品。经过丙酮重结晶得到白色粉末状固体32g,产率59%,分子式:C88H112O8,分子量1297.8g·mol-1,记为C8A。
(2)亚甲基桥杯[8]芳烃的腈基化合成 将一定量的C8A和100mL丙酮依次加入到双口烧瓶中,加热回流5h,加入10mL溴乙腈,反应过程TLC检测,反应结束后,蒸出溶剂,加入100mL氯仿使固体溶解,分别用0.5mol·L-1HCl和水将氯仿溶液洗涤3次,静置分层,收集下层有机相,过滤、浓缩后,加入无水乙醇析出固体粉末并使用氯仿重结晶,得到白色固体2.01g,产率75%,分子式:C104H120O8N8,记为C8ACN。
(3)偕胺肟化过程 将C8A-CN溶解到60mL含氯仿的单口烧瓶中。同时,将1.7g盐酸羟胺溶解在100mL去离子水中。并向该水溶液中加入5g NaOH保持溶液pH值为10。搅拌下加热,回流8h。冷却后,将反应混合物转移到分液漏斗中。将上层有机相旋蒸所得固体在N,N-二甲基甲酰胺/甲醇下重结晶,得到C8A-AO 0.94g,产率81%,分子式:C104H144O16N16,分子量为记为C8A-AO。材料合成整体路线见图1。
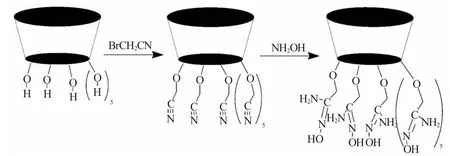
图1 C8A-AO的合成路线图Fig.1 Synthetic route of C8A-AO
1.3 吸附实验
配置不同酸度和浓度的铀酰离子溶液。采用静态吸附法,研究了C8A-AO粉末对水溶液中铀酰离子的吸附行为。铀酰离子溶液的pH值由浓HCl和NaOH调节。步骤如下:
在吸附实验中,取一定量的C8A-AO粉末分散到一定体积的铀酰离子溶液中,然后将该吸附体系置于恒温水浴振荡器中以200r·min-1的频率振荡一定时间。最后将悬浮液过滤分离即得到吸附后的铀酰离子溶液。铀酰离子溶液的浓度由微量铀分析仪测定。模拟海水中其他竞争离子浓度由无机质谱或原子发射光谱测试得到。所有测试结果均为3次测量的平均值,相对误差小于5%。材料对铀酰离子的吸附率(R%)、分配系数(Kd)和平衡吸附量(qe)可通过以下公式计算获得[9]:
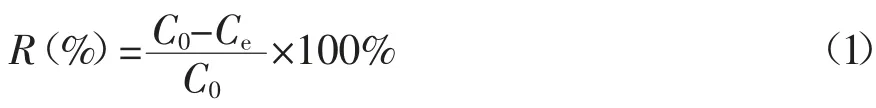

式中 C0、Ce:初始和平衡时的铀酰离子的浓度,mg·L-1;V:溶液的体积,mL;m:吸附剂的质量,g。
2 结果与讨论
2.1 表征与分析
(1)FT-IR分析 为了验证在合成过程中主要官能团的变化,以KBr压片法,测定了C8A、C8ACN、C8A-AO的FT-IR谱图分别对应图2中A、B、C。

图2 C8A(A)、C8A-CN(B)和C8A-AO(C)的FT-IR光谱图Fig.2 FT-IR spectrogram of C8A(A)、C8A-CN(B)and C8A-AO(C)
从图2中可以看出,2950~2800cm-1处的吸收峰为3种物质中的甲基和芳香烃的C-H键的峰。(A)中的3242cm-1处的吸收峰为C8A的羟基的伸缩振动峰;与C8A相比,C8A-CN的谱图(B)在3242cm-1处的羟基吸收峰完全消失,而在2248cm-1处出现了腈基的伸缩振动峰,说明杯芳烃下缘成功进行了腈基化修饰;而在TC4A-AO的谱图(C)中,2248cm-1处的腈基峰又完全消失,在3481、3367、1668和926cm-1处分别出现了N-H、O-H、C=N和N-O的伸缩振动峰[10],腈基峰的消失和其他新峰的出现说明在羟胺的还原作用下,腈基已经完全转化为偕胺肟基团。
(2)SEM分析 不同合成步骤下制备所得的C8A-AO样品的SEM结果见图3。

图3 C8A-AO的扫描电镜图Fig.3 SEM of C8A-AO
图3(A)和3(B)为合成的C8A-AO粗产品在DMF/CH3OH溶液中重结晶后的图像。从图3中可以清楚地看到重结晶所得的C8A-AO呈片状结构,且表面较为光滑。样品单层厚度约为100~300nm。图3(C)、3(D)展示的是经DMSO/H2O处理后所得到样品形态。从图3(C)可以发现,经过DMSO/H2O处理样品形貌变成了团簇状。图3(D)可以清晰地观察到此时的样品是由许多小颗粒粘连一起而成,且颗粒直径大约在50~100nm之间。
(3)TG分析 C8A、C8A-CN和C8A-AO的热重结果见图4。
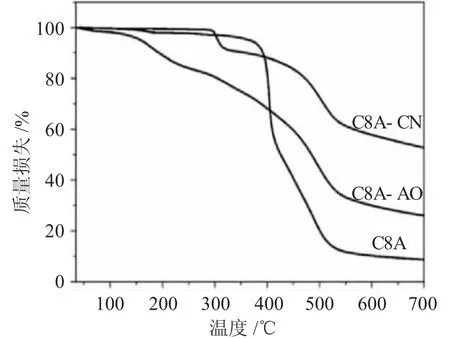
图4 C8A、C8A-CN和C8A-AO的热重图Fig.4 TG of C8A、C8A-CN and C8A-AO
C8A的热重曲线表明,从室温到380℃,C8A失重约为6.4%,主要由于物理吸附水的脱除。从380℃到550℃失重过程可以分两个阶段,主要由于杯[8]芳烃上下缘基团的断裂和杯芳烃骨架的分解。与C8A相比,C8A-CN的热重曲线300~340℃表现出明显的失重过程,归因于杯芳烃下缘修饰的腈基的损失。
C8A-AO的TG曲线与C8A和C8A-CN略有不同,其失重主要可分为3个过程。在第一阶段,从室温到155℃热重曲线略有下降,失重约为5.1%。主要由于物理吸附水和残余溶剂的蒸发[11]。在第二阶段,160~340℃内样品重量损失达19.4%,主要因为偕胺肟基C(NH2)=N-OH是由肟基和胺基组成,其化学结构比腈基更复杂。最后为340℃以上,失重约为43%,之后样品重量保持稳定。特别的是,3个样品均在550℃后重量基本保持稳定,主要因为在该温度下杯[8]芳烃及衍生物完成了骨架结构的热分解和共价键的断裂过程。热重分析结果表明,制备的材料具有良好的热稳定性。
2.2 pH值对吸附性能的影响
本实验考察了在温度为298K,铀酰离子的初始浓度为0.5mg·L-1,吸附剂用量为10mg/50mL,接触时间为48h,在pH值为3~9的范围内,C8A-AO对水溶液中铀酰离子的吸附性能的影响。结果见图5。
由图5可见,在pH值为3~8的范围内时,C8AAO的吸附效果随着pH值的增大而升高,吸附率从24%上升到95%,而当pH值在8~9时,吸附效率下降了约6%。在较低pH值的环境中,吸附效率较低可归因于酸性环境。在此时水溶液中存在大量的H+在吸附剂活性位点上与铀酰离子形成竞争吸附关系,同时,偕胺肟官能团质子化导致吸附剂表面拥有更多的正电荷,因而在较强酸性环境中不利于吸附剂对铀酰离子的吸附[12]。当pH值从3增加到7时,水溶液中H+的量逐渐减少,在吸附过程中没有其他阳离子能与铀酰离子竞争。同时,随着pH值的升高,偕胺肟基去质子化增加,因此,铀酰离子可以附着在吸附剂表面容易与偕胺肟基团通过螯合作用形成金属配合物,从而促进对铀酰离子的提取[13]。当pH值继续增加(从8到9),材料对铀酰离子吸附率略有下降,则由于pH值较高时,铀酰离子通过水解作用形成带负电荷的UO2(OH)3-和UO3(OH)7-,这些络合离子很难与偕胺肟基团络合。因此,为了消除高pH值下的水解影响,选择在pH值为7下进行吸附实验为最宜条件。
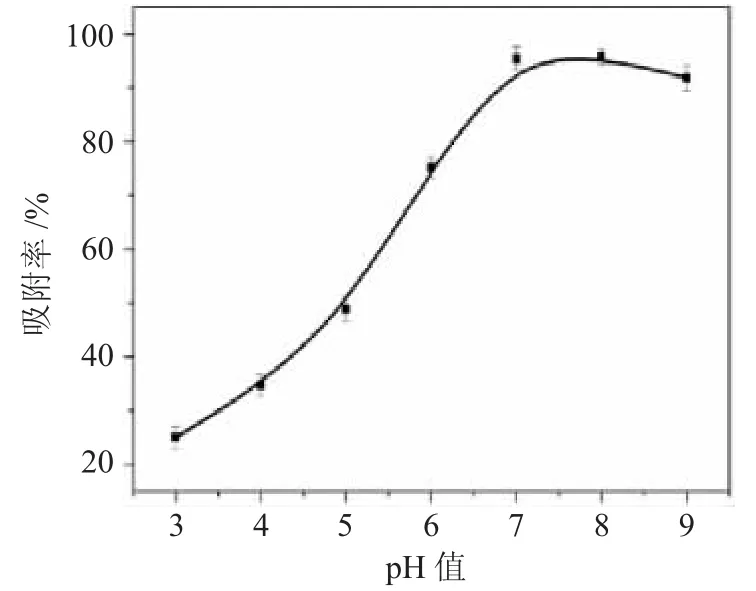
图5 pH值对C8A-AO吸附铀酰离子的影响Fig.5 Effect of pH on adsorption of uranyl ion by C8A-AO
2.3 接触时间对吸附性能的影响
本实验考察了在温度为298K,pH值为7,铀酰离子的初始浓度约为0.5mg·L-1,吸附剂用量为10mg/50mL,接触时间从1min到48h下C8A-AO对铀酰离子的吸附效果。具体结果见图6。
图6中,左轴qt为对铀酰离子的吸附量,右轴中Ct(mg·L-1)代表铀酰离子的浓度。从1min到6h的吸附过程中,C8A-AO对铀酰离子的吸附量迅速增加。从图6右轴可以发现,水溶液中大约70%的铀酰离子在吸附初始的30min内就迅速被吸附。接触时间达到6h后,材料对铀酰离子的吸附量增加缓慢,主要是因为材料的内表面和外表面已有大量的铀酰离子与偕胺肟官能团通过螯合作用,导致材料表面吸附位点的缺失引起扩散阻力的增加。24h后,吸附曲线趋于平缓,说明此时吸附过程达到了平衡状态,此时水溶液中超过90%的铀酰离子已经被C8A-AO成功吸附。因此,选择24h为最佳接触时间。

图6 接触时间对C8A-AO吸附铀酰离子的影响Fig.6 Effect of contact time on adsorption of uranyl ion by C8A-AO
2.4 铀酰离子浓度对吸附性能的影响
考察了铀酰离子的初始浓度范围为50μg·L-1~50mg·L-1,C8A-AO对铀酰离子的吸附性能的影响。结果见表1。
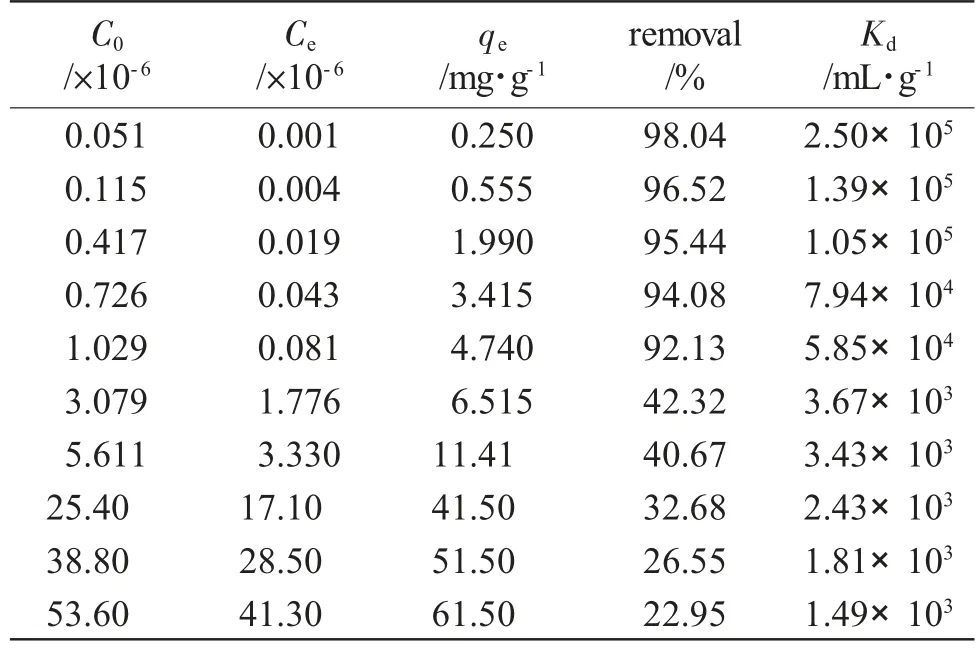
表1 不同初始铀酰离子浓度对C8A-AO吸附效果的影响aTab.1 Effect of different initial uranyl ion concentration on C8A-AO adsorption
由表1可见,C8A-AO对铀酰离子的吸附量随初始铀浓度的增加而增加。这主要是由于水溶液中铀酰离子浓度越高,吸附剂与铀酰离子接触的机会越大,吸附量也就越大。在初始铀酰离子浓度范围约为50~1000μg·L-1时,吸附剂对铀酰离子的吸附率均在90%以上。而当初始铀酰离子浓度超过3mg·L-1时,虽然材料对铀酰离子的吸附量较大,但吸附率均低于50%。分布系数(Kd)是评价吸附剂吸附性能的主要参数之一。一般来说,若材料具有较大的分布系数(Kd值超过104mL·g-1)被认为是一种潜在的优良的吸附剂。C8A-AO在不同铀酰离子浓度的溶液中的分布系数见表1。从表中可以看出,C8A-AO在约50~1000μg·L-1的铀酰离子浓度范围内时,其对铀酰离子的吸附效果不仅吸附率高而且分布系数值高达5.85×104~2.50×105。这表明C8A-AO吸附剂在水溶液中铀酰离子浓度低的溶液中吸附性能优良,因此该材料比较适合应用于海水等低浓度溶液中铀酰离子的提取工作。
2.5 温度对吸附性能的影响
考察了C8A-AO在293,298,303K和308K等温度下对铀酰离子吸附行为,研究了不同温度对其吸附性能的影响。在不同温度下的吸附结果见表2。
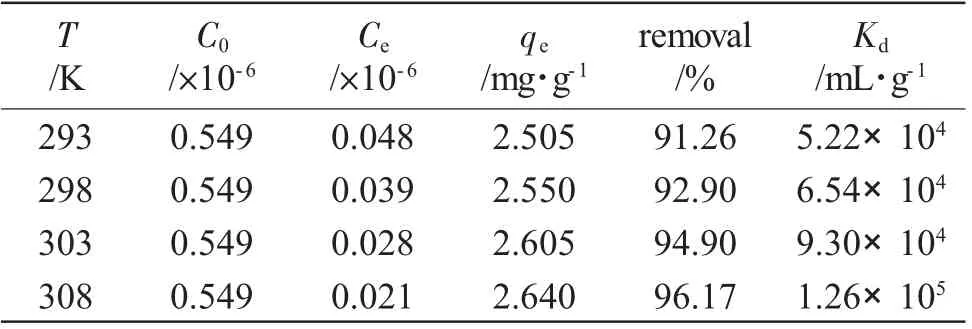
表2 不同温度下C8A-AO对吸附铀酰离子的吸附结果aTab.2 Adsorption results of C8A-AO for adsorbed uranyl ion at different temperatures
由表2可见,吸附剂在不同温度下对铀酰离子均保持了较高的吸附率和分布系数。C8A-AO对铀酰离子的平衡吸附量从293K时的2.505mg·g-1增加到308K时的2.640mg·g-1,吸附量随着温度的增加而增加,说明该吸附过程是吸热的。该现象的发生是由于随着温度的升高导致溶液的粘度降低而金属离子的扩散速度增加,铀酰离子与吸附剂上的官能团碰撞结合的机会增多,从而促进了吸附的进行。
2.6 C8A-AO对铀酰离子吸附选择性研究
为了缓解我国陆地铀资源的短缺,实现从海水中提铀的研究目标。本实验对C8A-AO吸附模拟海水中铀酰离子的行为进行研究。该实验首先以钠、镁、钙、锶等海水中大量存在的金属离子硝酸盐配置了模拟海水。在pH值为8,铀酰离子的初始浓度约为0.5mg·L-1,吸附剂用量为10mg/50mL,接触时间为24h,温度为298K条件下,考察了C8A-AO在模拟海水中对铀酰离子选择性吸附行为。模拟海水中的主要金属离子的初始浓度和平衡浓度见表3。分布系数(Kd)和选择性吸附系数(KU/M)可分别通过公式2和公式4计算获得,选择性吸附系数越大则说明该材料对目标离子的吸附选择性越好。

表3 C8A-AO在模拟海水中对各金属离子的吸附结果Tab.3 Adsorption of metal ions by C8A-AO in simulated seawater

式中 Kd(U)和Kd(M)分别代表铀酰离子和共存离子的吸附分布系数。
从表3可以看出,C8A-AO从模拟海水中吸附铀酰离子的分布系数值仅为6660mg·L-1,远低于同条件下从单一铀酰离子溶液中吸附铀酰离子的分布系数值(大于10000),这主要是因为其他金属离子占据了一定的材料表面的活性位点,导致吸附量下降。虽然所配制的模拟海水中铀酰离子的初始浓度低于其他共存的竞争金属离子的初始浓度,然而,在模拟海水中,相对于其他主要竞争金属离子的分布系数值,该材料对铀酰离子吸附的分布系数值要高的多。所以计算所得其他共存离子的选择性吸附系数(KU/M)要大于铀酰离子的1。该结果表明,在模拟海水溶液中C8A-AO对铀酰离子具有较高的选择性吸附能力,有望在从海水中提取铀的实际应用中发挥其潜在的价值。
2.7 C8A-AO对铀酰离子吸附机理的研究
通过在不同pH值、离子浓度、温度等条件下C8A-AO对铀酰离子吸附行为的研究,结合C8AAO的结构特点,对整个吸附过程的机理推测如下:首先,与杯[4]芳烃及其衍生物相比,C8A-AO具有更大的空腔结构,且结构柔韧性增加。实验中发现,C8A-AO重新从DMSO/水中析出后,其在水溶液中的分散性增强,从而促进了其在水溶液中吸附的进行。这很可能是由于柔韧性好的大环结构经过构象的重排,疏水性的烷基化的分子结构到内部,而亲水性好的偕胺肟基排到了结构表面。其次,杯芳烃,作为一种具有分子识别功能的大环化合物,可以方便地进行改性以获得提取目标金属离子所需的结构。其对金属离子的功能性识别是高度依赖于它们的功能基团和分子结构的尺寸效应。杯[8]芳烃具有较大的空腔,可以有利于小直径的金属离子(Na、Mg、Ca等)从其结构中通过而不包合,从而减少在吸附铀酰离子过程中对其他金属离子吸附的影响。最后,经偕胺肟基修饰后的杯芳烃结构表面拥有了更多偕胺肟基功能基团,从而材料表面可以提供更多的活性吸附位点,达到材料与铀酰离子通过螯合作用结合的目的,有助于提高其对铀酰离子的吸附容量。此外,丰富的醚键和空腔也有助于铀酰离子的配合物的形成。因此可以推断C8A-AO对铀酰离子的吸附是在杯芳烃大环结构的协助下,通过偕胺肟基团与铀酰离子的化学螯合作用从而提高吸附效果。
3 结论
通过修饰制备得到偕胺肟基修饰杯芳烃衍生物,并采用FT-IR、SEM等表征确认产品为目标产物。研究了C8A-AO在水溶液中对铀酰离子的吸附行为,考察了不同pH值、接触时间、铀酰离子初始浓度、温度等因素对吸附过程的影响,获得了该材料的基础吸附特性和吸附参数。理论最大吸附量为98.425mg·g-1。
考察了在模拟海水中C8A-AO对铀酰离子的吸附行为,研究发现,在竞争离子共存的模拟海水体系中其对铀酰离子有较好的选择性吸附能力。
