人羊膜间充质干细胞培养上清通过环状RNA-0001649/miR-203a/VEGFA/MMP9信号通路促进血管生成
2021-07-06胡丽萍肖轶婧唐子春
胡丽萍,肖轶婧,唐子春,孙 典,沈 铭*
1南京医科大学附属口腔医院综合诊疗科,2江苏省口腔疾病研究重点实验室,3江苏省口腔转化医学工程研究中心,江苏 南京 210029
新生血管能够给新生组织提供氧及必要的营养物质,进而在新骨生成过程中发挥重要作用[1-2]。研究表明,来自骨髓间充质干细胞条件培养基的外泌体可以通过增强血管生成促进骨再生[3]。但骨髓间充质干细胞在促进血管新生的广泛应用中受到以下因素的限制:需要一定的侵入性操作,以及供体年龄依赖性分化导致的不稳定性[4]。研究表明人羊膜源间充质干细胞(human amnion-derived mesenchymal stem cell,hAMSC)同样显示了较强的促进血管生成的能力[5],具有稳定的活性[6],且采集方便,对供者无风险。与通常用于分离种子细胞的其他组织类型相比,捐献的羊膜组织数量丰富,较少产生伦理问题[7]。因此,hAMSC 是一个具有发展前景的种子细胞。我们前期研究发现hAMSC 的培养上清具有较强的促血管生成作用[5],然而机制尚不十分明确。
环状RNA(circular RNA,circRNA)是一种在真核细胞中广泛表达的具有闭合环状结构的长链非编码RNA[8-10]。研究发现circRNA 不仅是转录的副产品,还可以在疾病和发展过程中介导细胞增殖、迁移、侵袭和凋亡[11-13]。目前发现circRNA 发挥功能的多种机制包括:①circRNA 可充当分子海绵,吸附miRNA 以减少其对mRNA 的降解和翻译的抑制[14-16];②部分circRNA 可调控基因转录[17];③circRNA可与功能蛋白相互作用[18-19];④circRNA可被翻译成蛋白[13]。我们前期研究发现,hAMSC培养上清(conditioned medium,CM)可促进人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)内多种circRNA的表达,其中包括circ-0001649。因此,本研究旨在探究circ-0001649 是否参与hAMSC促血管生成的作用以及潜在机制。
1 材料和方法
1.1 材料
胎牛血清、α-MEM 培养基、DMEM 培养基(Hy-Clone公司,美国),过滤器(Merck公司,美国),基质胶(BD 公司,美国),Image J(1.8.0 版本;http://imagej.nih.gov/ij/);Transwell 小室(北京康宁公司);Lipofectamine®2000 转染试剂、TRIzol®(Invitrogen 公司,美国),抗GAPDH、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、基质金属蛋白酶9(matrix metalloproteinase 9,MMP9)单克隆抗体(Santa Cruz 公司,美国)。
1.2 方法
1.2.1 细胞培养
hAMSC 从足月妊娠(健康怀孕女性、妊娠期为38~41 周)的女性供者胎盘中分离。本研究所有实验方法均通过南京医科大学伦理委员会批准(PJ2013-037-001)。本研究涉及的研究均遵循《赫尔辛基宣言》,招募的每位捐献者对实验条款内容均已知情同意。
细胞贴壁培养于含10%胎牛血清的α-MEM培养基中,青、链霉素终浓度为100 U/mL。HUVEC 贴壁培养于含10%胎牛血清的DMEM 培养基中,青、链霉素终浓度为100 U/mL。细胞均置于37 ℃含5%CO2的细胞培养箱中培养。
1.2.2 条件培养基的收集
当hAMSC 在15 cm 培养皿中生长至70%~80%融合时,去除培养液,并用1×PBS洗涤3次后,换成30 mL添加青霉素-链霉素(100 U/mL青霉素、100 g/mL链霉素)的DMEM∶α-MEM=1∶1 的混合培养基在含5%CO2的细胞培养箱中培养。24 h后收集30 mL的培养基,4 ℃离心。然后,培养基经0.45 μm 过滤器过滤,分装并储存在-80 ℃深低温冰箱作为CM 使用。后续实验使用的hAMSC-CM 含80% CM,我们之前的结果表明,这一比例理想地促进了HUVEC的生存能力。hAMSC 来源于3 个不同的供体,每个供体的hAMSC-CM进行了3次重复实验。采用无血清培养基作为对照。
1.2.3 血管生成实验
将HUVEC 接种在预先铺有基质胶的96 孔板上(50 μL 每孔,37 ℃静置30 min),接种密度为每孔4 000个细胞,用均添加了1%胎牛血清的hAMSC-CM 或对照培养基,在37 ℃含5%CO2的细胞培养箱中培养4~6 h。实验独立重复3 次,在100 倍的光学显微镜下获取成管图像,然后在每孔中随机选取3个视野,使用Image J软件定量分析总成管长度。
1.2.4 瘢痕愈合实验和Transwell穿梭实验
待HUVEC 在含有10%胎牛血清的DMEM 培养基中(6 孔板中每孔1×104个细胞)长满形成单层后用移液管尖端刮出一条直线形成一个间隙,用1×PBS 洗涤去除细胞碎片。换成含2%胎牛血清的hAMSC-CM(80%CM)或含2%胎牛血清的对照培养基培养13 h。在0 h 和13 h 使用光学显微镜观察细胞迁移状态并获得显微图像(标记位置每孔3 张)。对于每一幅图像,使用Image J 软件测量缝隙的面积。实验独立重复3次,对于每一组,测量每个间隔内的3个随机位置。细胞的迁移率计算为[(0 h的缝隙面积-13 h的缝隙面积)/0 h的缝隙面积],最终用各组与阴性对照组的比值显示,以对照组为标准化1。
Transwell 穿梭实验:准备8.0 μm的Transwell 小室和对数生长期的HUVEC。在下室中预先加入600 mL 含5%胎牛血清的hAMSC-CM(80% CM)或含5%胎牛血清的对照培养基,上室加入200 mL 无血清对照培养基(8 000个细胞)。小室放置在37 ℃培养箱孵育12 h后,将附着在小室下表面的迁移细胞在室温下用含10%甲醇的0.1%结晶紫固定染色1 h。实验独立重复3次,光学显微镜下观察并随机对3个视野的细胞进行计数和拍照。细胞的迁移率最终用各组与阴性对照组穿出细胞的比值显示,以对照组为标准化1。
1.2.5 细胞转染
针对circ-0001649的特异性小干扰RNA(siRNA)和miR-203a 抑制剂购于广州锐博公司。siRNA(50 nmol/L)或抑制剂(100 nmol/L)用Lipofectamine®2000转染试剂按照说明书步骤进行转染。
1.2.6 蛋白印迹实验
收集细胞进行裂解、离心收集总蛋白。使用10% SDS-PAGE 电泳分离蛋白,并电转移至PVDF膜。在室温下用5%脱脂牛奶封闭1 h 后分别加入相应的一抗:GAPDH、VEGFA、MMP9,4 ℃孵育过夜,加入对应二抗,室温孵育1 h。用ECL 发光液进行增强化学发光检测,使用Image Lab软件计算条带灰度值。
1.2.7 RNA提取与实时荧光定量PCR
使用TRIzol®提取总RNA 后,使用Nanodrop 2000 分光光度法测量RNA 的质量和浓度。用逆转录试剂盒将1 μg 总RNA 逆转录为cDNA,使用Hieff qPCR SYBR Green Master Mix 和PCR 检测系统进行实时荧光定量PCR(quantitative real-time PCR,qRTPCR)实验。分别用GAPDH 和U6 作为检测circ-RNA 和miRNA 的内参。用循环相对表达量计算阈值(Ct值)和2-ΔΔCt来表示目的基因相对表达量。
1.2.8 分组处理
CM 组:培养体系为hAMSC-CM(80%CM)培养基;CM+si-NC 组:先在DMEM 完全培养基条件下转染对照siRNA,再换成hAMSC-CM(80% CM)培养基;CM+si-circ-0001649 组:先在DMEM 完全培养基条件下转染siRNA 敲低circ-0001649,再换成hAMSC-CM(80%CM)培养基。使用miR-203a 的类似物miR-203a mimic 和抑制剂miR-203a-inhibitor 处 理HUVEL细胞,分为:mimic-NC组、mimic组、inhibitor-NC 组、inhibitor 组:在DMEM 完全培养基培养下进行相应的转染;si-NC+inh-NC 组、si-circ-0001649+inh-NC 组、si-circ-0001649+inh 组、si-NC+inh 组:在DMEM 完全培养基培养下进行相应的共转染后换成hAMSC-CM(80%CM)培养基。
1.3 统计学方法
采用SPSS15.0 进行统计分析。定量数据显示为平均值±标准差()。两组数据比较采用t检验。多组数据比较采用ANOVA-SNK 检验。所有的统计检验都是双尾检验,P<0.05 为差异有统计学意义。
2 结果
2.1 hAMSCs-CM 通过促进circ-0001649 表达诱导HUVEC的成管和迁移
与对照组相比,HUVEC与hAMSC-CM共同孵育24 h 后,细胞内circ-0001649 的表达水平明显升高(图1A),提示circ-0001649 可能参与了hAMSC-CM的促血管生成过程。为了验证这一猜想,转染siRNA来敲低HUVEC 中circ-0001649 的表达(图1B)。hAMSC-CM刺激组与对照组相比,HUVEC的成管能力和迁移能力均提高。然而当在HUVEC 中敲低circ-0001649 后,其成管能力和迁移能力均减弱(图1C、D、E)。说明circ-0001649 在hAMSC-CM 促血管生成过程中起着重要作用。同时也检测了成血管相关蛋白,得到的结果一致:hAMSC-CM刺激后HUVEC细胞内VEGFA和MMP9蛋白表达水平升高,敲低circ-0001649则抑制了蛋白表达(图1F)。
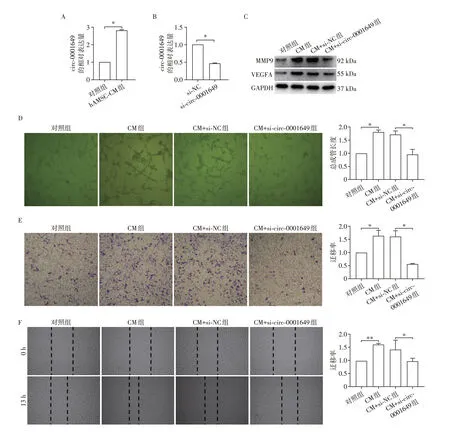
图1 hAMSC-CM通过促进circ-0001649表达诱导HUVEC的成管和迁移Figure 1 The up-regulation of circ-0001649 in HUVEC induced by hAMSC-CM promoted the angiogenesis and migration of HUVEC
2.2 circ-0001649 通过miR-203a 提高VEGFA/MMP9表达促进HUVEC的成管和迁移
circ-RNA 可作为内源性竞争性RNA 与miRNA结合而发挥作用,经circular RNA interactome 网站(https://circinteractome.nia.nih.gov/)预 测 circ -0001649 与miR-203a之间存在结合位点(图2A),提示两者可能结合。同时通过miRTarBase 网站(http://mirtarbase.cuhk.edu.cn/php/index.php)预测,VEGFA 和MMP9 是miR-203a 的靶基因。本研究结果显示,miR-203a的类似物miR-203a-mimic 和抑制剂miR-203a-inhibitor 分别抑制和促进VEGFA 和MMP9的蛋白表达(图2B),提示VEGFA和MMP9可能是miR-203a的靶基因。为了验证circ-0001649是否通过结合miR-203a 发挥作用,对circ-0001649 敲低的HUVEC细胞中分别转染miR-203a抑制剂miR-203a-inhibitor 和对照inhibitor-NC 来进行拯救实验。qRT-PCR检测结果显示转染miR-203a-inhibitor后并不影响circ-0001649 的敲低效率(图2C),但是与inhibitor-NC 相比,转染miR-203a-inhibitor却能部分逆转circ-0001649敲低引起的成管和迁移能力的降低(图2D、E、F)。同时与此一致的是,蛋白印迹实验结果同样显示:miR-203a-inhibitor能部分恢复因敲低circ-0001649而引起的VEGFA和MMP9蛋白水平的下降(图2G)。以上实验证实了hAMSCs-CM的促血管生成作用可部分通过上调HUVEC 细胞内circ-0001649的表达来实现,circ-0001649与miR-203a存在内源性竞争,促进下游VEGFA和MMP9表达。
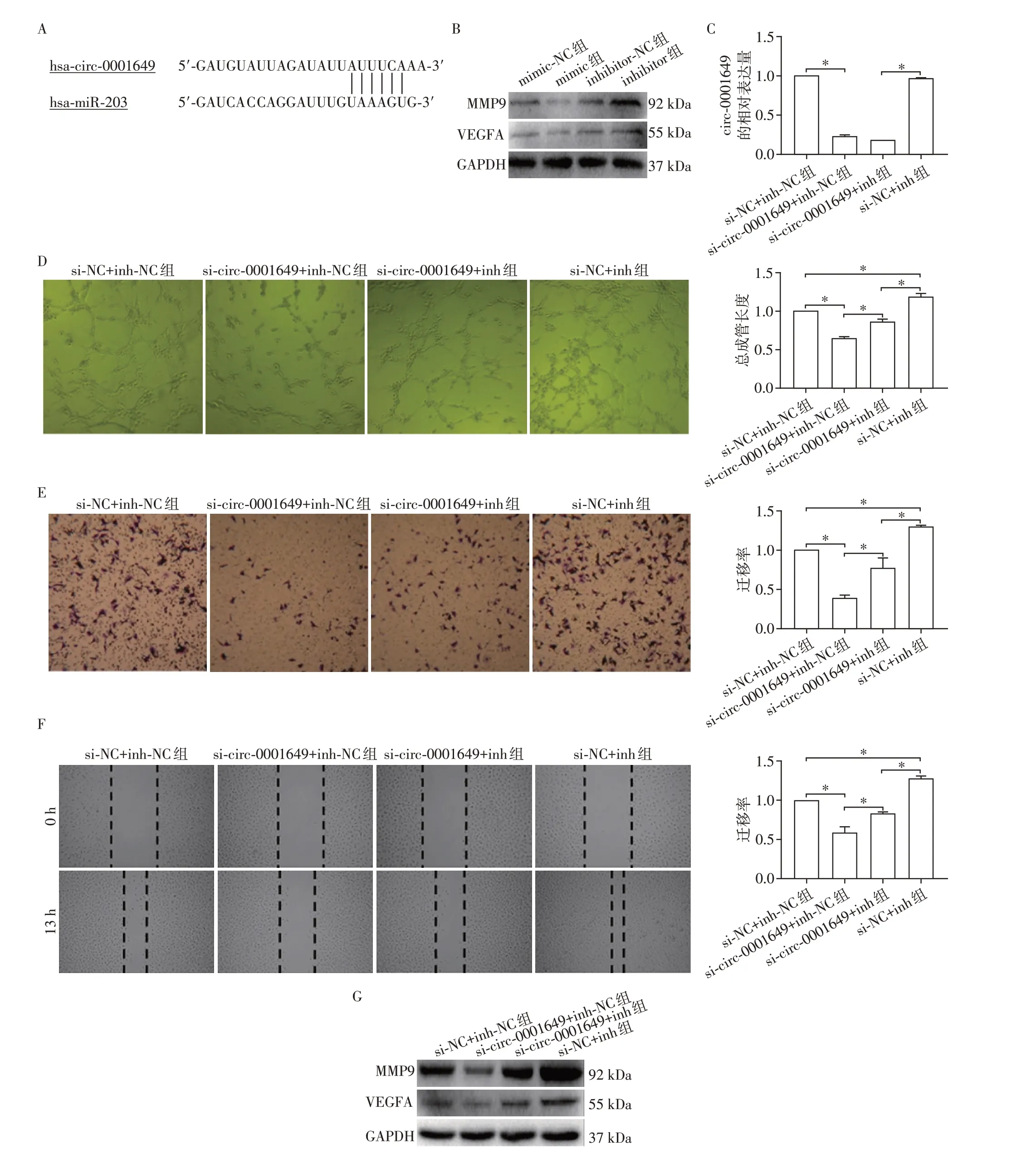
图2 circ-0001649通过miR-203a提高VEGFA/MMP9表达促进HUVEC的成管和迁移Figure 2 Circ-0001649 promoted angiogenesis and migration of HUVEC through increasing VEGFA/MMP9 by miR-203a
3 讨论
由于先天性原因和后天的外伤、肿瘤、炎症,颌骨缺损在临床中较为常见。其不仅可以导致咀嚼及语言功能障碍,还可导致颅颌面畸形,从生理、心理两方面对患者造成严重影响。近年来出现了一种新型的材料——组织工程化骨,给治疗颌面部骨缺损提供了新的思路。组织工程化骨通过采取合适的支架材料复合生物活性分子及种子细胞,于体外构建结构功能与自然骨相近的组织工程材料。
促进血管生成是促进骨再生及构建组织工程化骨的重要策略,因为骨的愈合或重塑都需要新生血管来提供氧和营养物质以维持正常代谢。通过干细胞促进血管新生已被认为是一种潜在的解决方案[20]。既往研究表明,骨髓间充质干细胞分泌多种相关生长因子和细胞因子,如VEGF、胰岛素样生长因子1、肝细胞生长因子等,以旁分泌方式促进骨再生过程中的血管新生[21]。但骨髓间充质干细胞在促进血管新生的应用中受到以下因素的限制:需要一定的侵入性操作,可能对供者产生一定损伤,以及供体年龄依赖性分化导致的不稳定性。于是较容易获得、稳定性较好、且涉及伦理问题较少的hAMSC具有更好的应用前景。同样,本课题组之前的数据显示,hAMSC 能明显增强HUVEC 的血管生成[5]。
近年来circRNA由于其在血管新生中发挥重要作用而备受关注。例如circRNA hsa_circ_0074834通过作为miR-942-5p 的ceRNA 进而增加ZEB1 和VEGF 的表达来促进骨髓间充质干细胞的成骨-血管生成耦合过程[22];circ-002136 通过与miR-138-5p结合缓解对转录因子SOX13的抑制,促进SPON2表达进而调控胶质瘤血管生成[23];circ-0003204 通过促进E-cadherin表达,降低N-cadherin和Vimentin的表达进而抑制氧化修饰低密度脂蛋白诱导的血管内皮细胞增殖和血管生成等。本研究探讨了circRNA 在促血管生成过程中的作用。结果表明,hAMSC-CM 可显著上调HUVEC 中circ-0001649 的表达。此前其他研究表明circ-0001649可通过与多个miRNA结合进而抑制肝细胞癌进展,在视网膜母细胞瘤中circ-0001649 的下调与其不良预后有关,并通过AKT/mTOR 信号通路调控细胞增殖和凋亡。本研究通过生物信息学分析和拯救实验,发现circ-0001649 可通过与miR-203a 结合上调VEGFA、MMP9的表达进而发挥促血管生成因子的作用。然而,hAMSC-CM 上调HUVEC 中circ-0001649 表达的具体机制尚不清楚。推测可能是hAMSC-CM 中含有的一些生长因子和细胞因子进入HUVEC 中,通过一系列信号转导,促进circ-0001649 转录。这些还需要通过后续实验进一步研究。
综上,本研究表明circ-0001649参与了hAMSCCM 诱导的HUVEC 的血管生成。这种促血管生成作用可能是部分通过上调HUVEC 细胞内circ-0001649 表达来实现的,circ-0001649与miR-203a内源性竞争,促进下游VEGFA和MMP9表达。本研究为探究hAMSC 促进血管新生的作用机制提供了新思路。
