吉非替尼抵抗致肺腺癌患者转化为小细胞肺癌1例
2021-07-06蔡锐杜安妮伍定勇王璇
蔡锐,杜安妮,伍定勇,王璇
(1.贵州省遵义市红花岗区人民医院药剂科,遵义 563000;2.遵义医药高等专科学校药理教研室,遵义 563000;3.陆军军医大学第二附属医院肿瘤科,重庆 400037;4.陆军军医大学第二附属医院药剂科,重庆 400037)
肺癌是全球死亡率最高的肿瘤之一,其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)是主要类型,占75%~85%。NSCLC分为腺癌、鳞状细胞癌和大细胞癌[1]。表皮生长因子受体酪氨酸激酶抑制药(epithelial growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)能明显改善EGFR敏感突变NSCLC患者预后,但最终几乎所有患者都会产生耐药性,导致肿瘤进展[2-3]。尽管有着良好的治疗效果,但大多数患者经过12个月治疗中位时间后都会出现疾病进展[4]。该病耐药机制中有一种较少见的耐药现象,即转化为小细胞肺癌(small cell lung cancer,SCLC)[5]。笔者在本文报道1例由于TKI耐药导致的肺腺癌转化为SCLC病例。
1 病例介绍
患者,男,63岁。2016年3月8日因“咳嗽、咯痰半年余,头晕、恶心10 d”来陆军军医大学第二附属医院就诊。肺部CT示右肺下叶背段肿块,考虑肿瘤性病变可能性大。头颅磁共振(MRI)提示左侧顶叶肿块,转移瘤可能性大。电子支气管镜检查及经皮穿刺活检,术后病理结果示:腺癌,间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)(-),诊断为右侧原发性支气管肺腺癌T3N3M1b,EGFR基因检测:19号外显子突变。2016年3月15日开始服用吉非替尼250 mg,qd。2016年6月肺部CT与2016年3月比较,肿瘤组织较前减小;头部MRI:较2016年3月缩小。癌胚抗原由18.87 ng·mL-1降至5.52 ng·mL-1,总体评价部分缓解(partial response,PR)。
2017年4月复查,神经元特异性烯醇化酶(neuron-specific enolase,NSE)56.4 ng·mL-1;与2017年2月MRI比较,头部肿瘤缩小。与2017年2月CT检查结果比较,肺部肿瘤稍增大。总体评价疾病稳定(stable disease,SD)。考虑病灶增大未超过20%,患者继续服用吉非替尼,2个月后,患者出现咳嗽、喘息加重。2017年6月入院,肺部CT示:与2017年4月比较,右肺下叶肿块影范围增大,并右肺下叶阻塞性肺不张,炎症;右肺少许胸腔积液。头部CT检查示:与2017年4月比较,左侧顶叶强化病灶变化不大。总体评价疾病进展(progressive disease,PD)。NSE 89.5 ng·mL-1,较前显著增高。再次行支气管镜,进行病理及免疫组化检测。病理检查提示:SCLC;免疫组化:甲状腺转录因子-1(thyroid transcription factor,TTF-1)(+),细胞角蛋白7(cytokeratin 7,CK7)(-),转录蛋白63(protein 63,P63)(-),转录蛋白40(protein 40,P40)(-),白细胞共同抗原(leukocyte common antigen,LCA)(-),钙结合蛋白(calretinin,CR)(+),细胞增殖核抗原-67(nuclcar- associated antigen,Ki- 67)(+60%),嗜铬素A(chromogranin A,CgA)(-),神经细胞黏附分子(CD56)(+),突触素(synaptophysin,Syn)(+),波形蛋白(vimentin,VIM)(-),内皮细胞标记(cluster of differentiation,CD34)(-);通过高通量测序技术("Next-generation" sequencing technology,NGS)并未检测到T790M突变。在吉非替尼治疗基础上,给予依托泊苷 160 mg (第1天)+奈达铂120 mg(第1天)(EP方案),2个周期后(2017年8月25日)肺部CT检查示:与2017年6月比较,右肺下叶肿块范围较前类似;右肺胸腔积液较前吸收。头部检查CT提示:与2017年6月比较,左侧顶叶强化病灶变化不大。总体评价SD。患者诉头晕、头痛,给予对症放射治疗(放疗)。患者CT检查结果见图1,NSE变化趋势见图2。
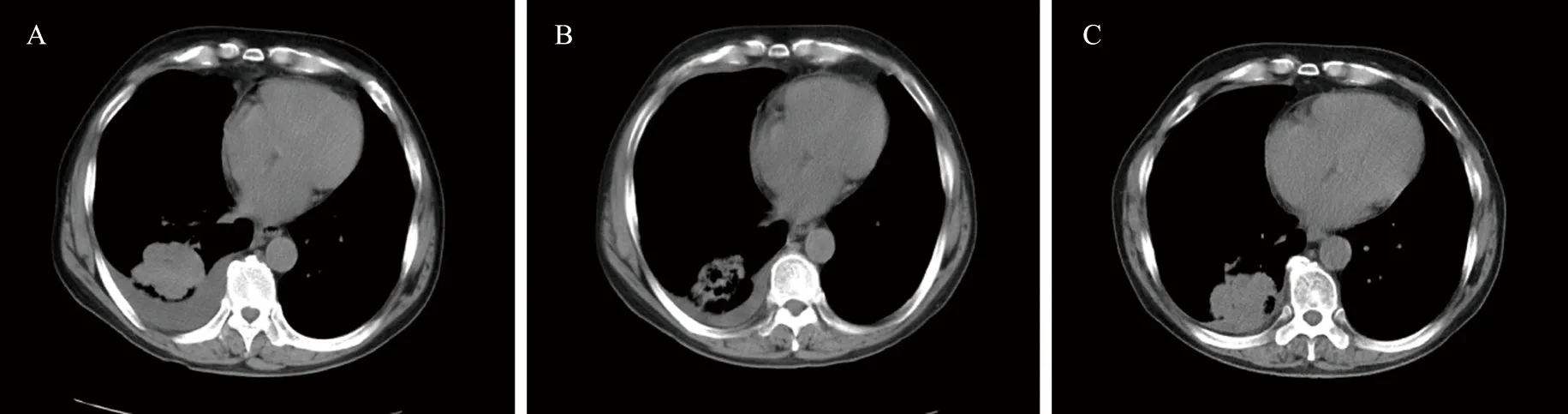
A.2016年3月;B.2016年6月;C.2017年4月。图1 患者治疗期间CT影像
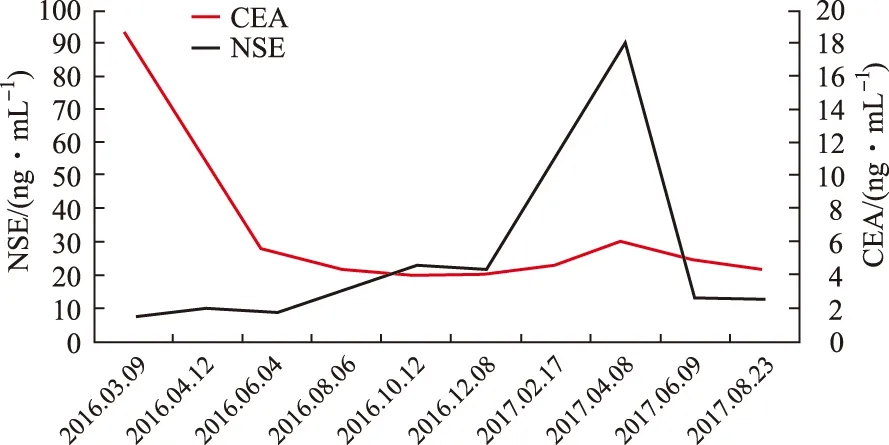
图2 血清NSE与CEA变化趋势
2 讨论
EGFR敏感突变患者服用EGFR-TKIs后无进展生存期和总生存期均显著改善[6]。但该患者服用吉非替尼11个月后,出现EGFR-TKIs耐药。TKI耐药机制有很多种:①T790M突变引起的继发耐药,占总患者50%以上[7];②酪氨酸激酶代偿,如c-MET扩增[8]和人表皮生长因子2(human epidermal growth factor receptor 2,HER-2)突变,也起着重要作用[9];③代偿信号通路激活,如PI3K/Akt信号通路[10]和TOPK-c-Jun通路[11];④组织病理转化,包括EMT表型转化[12]和SCLC转化[13-14]。无论由于哪一种机制发生,都提示重复活检的重要性。
患者血清NSE在服用EGFR-TKIs期间快速增长。文献提示,血清NSE快速升高通常意味着EGFR-TKIs导致腺癌向SCLC转化的迹象,提示血清NSE水平显著升高可能代表着肺腺癌细胞正向小细胞转化,更加确定重复活检的必要性。患者EGFR基因为19号外显子突变。有文献[15]报道,在肺腺癌中EGFR突变型比EGFR野生型更为常见,同时肺腺癌中相较于EGFR野生型,EGFR突变型更易转化为SCLC。进一步研究发现,肺腺癌EGFR第19外显子突变(50.0%,9/18)较第21外显子突变(27.8%,5/18)转化为SCLC的频率更高[13]。笔者查阅文献发现,国外一项包含39个病例的研究中,从肺腺癌转化为SCLC的中位时间为19个月,转化为SCLC后中位生存期6个月,女性生存期显著长于男性[15]。提示患者出现SCLC转化后,预后可能不佳。
制定个体化给药方案需进一步了解SCLC转化机制。JIANG等[13]研究发现,SCLC转化后大部分保留与原发肺腺癌(83.3%,15/18)相同的基因突变,只有一小部分(16.7%,3/18)失去原基因突变或获得另一种类型的基因突变,这种现象可能与SCLC转化不同机制有关。有研究报道,视网膜母细胞蛋白(reported that retinoblastoma protein,Rb)表达在NSCLC中较多,EGFR-TKI治疗后,Rb丢失是NSCLC转化为SCLC的分子机制之一[16]。因此,SCLC转化可能由于EGFR-TKIs抑制肿瘤作用,由原发性腺癌细胞转化而来或源于多潜能肿瘤干细胞。JIANG等[13]研究发现,大多数转化后的SCLC保留了原始EGFR突变。说明SCLC可能由原发性腺癌转化而来,可能来源于同一肿瘤干细胞,导致腺癌细胞向SCLC转化产生抗EGFR-TKI作用。
也有较小比例患者转化SCLC并没有与原发腺癌相同的EGFR突变[17]。再次进行肿瘤活检时,也可能出现与最初病理组织不一致的现象。在转化的SCLC组织中并未检测到原有的基因突变或者新的突变,这种现象可能与SCLC转化的不同机制有关[18-19]。SHI等[20]研究表明,肺泡II型细胞可能是腺癌和小细胞肺癌的前体细胞。在EGFR-TKIs治疗压力下,一些本应向腺癌转化的肺泡II型前体细胞,可能向小细胞肺癌转化。亦可能患者初始合并NSCLC和SCLC,随着TKI治疗NSCLC逐渐减少,SCLC组分开始占主导地位,而出现耐药现象。同时SCLC转化时,神经内分泌分化发生,可能增加化疗的敏感性[21-22],SCLC转化的多数病例,均以神经内分泌分化为特征,对EP方案化疗较敏感[13,18,23]。结合查阅文献,最后选择TKI+EP方案进行治疗,且化疗2周期后患者评价SD。
综上所述,该患者由肺腺癌转化为SCLC可能因为TKI耐药。换用一线SCLC化疗方案(EP方案)有效。NSE血清水平可用于早期组织学转化监测,再次活检对EGFR-TKIs耐药患者十分重要,可用于疾病进展组织及遗传学评价。
