参红通络方对大鼠动脉粥样硬化斑块的影响*
2021-07-06靳宏光朱星李铁王义强成光宇
靳宏光,朱星,李铁,王义强,成光宇
(1.长春中医药大学附属医院心病中心,长春 130021;2.长春中医药大学针灸推拿研究所,长春 130117;3.长春中医药大学附属医院中医药研究中心,长春 130021)
动脉粥样硬化(atherosclerosis,AS)是心血管疾病发病的重要病理基础,严重危害人类健康,降低患者生活质量。长期以来AS发病机制一直备受关注,目前多数学者认为AS是一种慢性炎症性疾病,CD40/CD40 配体(CD40/CD40L)是一对互补跨膜糖蛋白,是机体发生炎症反应过程中重要的信号通路[1],贯穿AS整个发病过程。参红通络方是长春中医药大学附属医院名老中医经验方,具有益气活血、豁痰通络作用。笔者在本实验观察参红通络方对AS大鼠粥样硬化斑块的影响,以揭示该药治疗AS的可能机制。
1 材料与方法
1.1实验动物 无特定病原体(SPF)级雄性SD大鼠80只,体质量(280±20) g,由长春市亿斯实验动物技术有限责任公司提供,实验动物生产许可证号:SCXK(吉)2011-0004,实验动物合格证号:SCXK(吉)2017-0005。大鼠饲养于吉林大学基础医学院动物饲养室,分笼饲养,自由饮水。饲养室温度18~22 ℃,相对湿度50%~70%,通风良好。大鼠基础饲料配方:面粉20%、米粉3%、玉米25%、麸皮25%、豆料20%、骨粉3%、鱼粉4%。高脂饲料配方:基础饲料77%、胆固醇3%、蛋黄粉10%,猪油10%。先将基础饲料与胆固醇、蛋黄粉、猪油充分混合,搅拌均匀,加入适量开水制成模饼,微波炉烤干。基础饲料、胆固醇、蛋黄粉、猪油均由吉林大学动物实验中心提供。
1.2药物与试剂 参红通络方:由人参、红景天、瓜蒌、半夏、丹参、水蛭、降香等药物组成,本实验采用其免煎农本颗粒(由吉林省莱沃药业有限公司提供,药品与批号分别为人参A1701100、红景天A1601745、瓜蒌A1601059、清半夏A1700452、丹参A1601972、水蛭A1701020、降香A1600538);辛伐他汀片(杭州默沙东制药有限公司,批号:J20130068 ,规格:每片20 mg);低分子肝素钠(商品名:吉派林,杭州九源基因工程有限公司,规格:每瓶0.3 mL,批号:160406);青霉素钠(华北制药股份有限公司,规格:每瓶80万U,批号:20170529)。
氧化低密度脂蛋白酶联免疫吸附测定(oxidation low lipoprotein enzyme linked immunosorbent assay,ox-LDL ELISA)试剂盒(南京建成生物工程研究所,批号:20181120);可溶性CD40配体(soluble CD40 ligand,sCD40L)ELISA试剂盒(天津安诺瑞康生物技术有限公司,批号:208180418);抗肿瘤坏死因子-α(anti-tumor necrosis factor,Anti-TNF-α,兔抗大鼠,北京博奥森生物技术有限公司);抗血管细胞黏附分子1(anti-vascular cell adhesion molecule-1,anti-VCAM-1,兔抗大鼠,博士德生物工程有限公司,批号:BST17274289);二氨基联苯胺3(3’-diaminobenzidine,DBA)显色液(北京索莱宝科技有限公司,批号:20181120);0.5%聚山梨酯-20的磷酸盐缓冲溶液(phosphate buffer saline,PBS),美国Santa Curz生物工程公司);辣根酶标记羊抗鼠抗体(北京中杉金桥生物技术有限公司,批号:134560);辣根酶标记羊抗兔抗体(北京中杉金桥生物技术有限公司,批号:136080);增强化学发光法(enhanced chemiluminescence,ECL)试剂盒(上海碧云天生物技术有限公司,批号:82418180930);鸟类成髓细胞白血病病毒(avian myeloblastosis virus,AMV)逆转录酶[宝生物工程(大连)有限公司];磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、CD40、白细胞介素-1β(IL-1β)引物均由生工生物工程(上海)股份有限公司提供,批号:1914526843。
1.3实验仪器 JJ260电子记重秤(AWH);4K15低温高速离心机(Heraeus);TD-5M小型台式离心机(山东博科科学仪器有限公司);SpectraMax 190酶标仪(美谷分子仪器上海有限公司);AB×51光学显微镜(OLYMPUS);PM-10AO全自动显微照相装置(Olympus);HHW21600电热恒温水浴箱(上海量壹科学仪器有限公司);LKB~V型超薄切片机(瑞士LKB);JEDA801D形态学图像分析系统(江苏捷达有限公司);CFX96TM Real-Time system荧光定量聚合酶链式反应分析仪(美国Bio-Rad公司);04113R115669转膜仪(美国 Bio-Rad);Bio-Rad CFX96荧光定量PCR仪(美国Bio-Rad);KD-12-A(JY-18)高压灭菌器(浙江凯德医疗器械有限公司);SW-CJ-2FD无菌超净操作台(上海博迅实业有限公司医疗设备厂);电泳仪(Eps600);722s紫外可见分光计(上海精密科学仪器有限公司);Tanon-1600凝胶成像系统(上海Tanon科技有限公司);T10型匀浆机(德国IKA);U570-86 -80 ℃超低温冰箱(英国New Brunswick Scientific)。
1.4动物的分组与造模 将大鼠适应性喂养1周,采用随机数字表法分为5组,每组16只:假手术组、模型对照组、中药小剂量组、中药大剂量组、辛伐他汀组。
参考文献[2]方法,假手术组结扎颈外动脉,不行球囊损伤术,其余各组用球囊损伤主动脉。所有大鼠麻醉后仰卧固定,颈部备皮,取颈部正中偏左3 mm 切开皮肤,切口长 2.5~3.5 cm,钝性分离皮下组织与肌肉。左侧颈总动脉下穿2根4号丝线,结扎远端,另一根线放置近端备用。在靠近血管远端结扎处,剪一“V”型小口。假手术组直接在小口近心端结扎,其余各组大鼠用准备好的球囊沿小口处插入颈外动脉,继续顺着血管往下插,经过颈总动脉到达主动脉,调节压力泵以200~600 kPa扩张球囊,放松丝线,恢复血液供应,来回缓慢抽动球囊3次后撤出球囊,靠近颈总动脉分叉处结扎颈外动脉近端,抽去颈总动脉处丝线,恢复动脉血流,查看颈总动脉及颈内动脉是否充盈搏动良好。各组大鼠均用聚维酮碘溶液清洗组织,0.9%氯化钠溶液冲洗3次,逐层缝合。术后预防性给予青霉素 20万U皮下注射,连用3 d;低分子肝素钠注射液521 U·kg-1皮下注射,连用3 d。术后普通饲料饮食,自由饮水1周。
术后第2周,除假手术组仍给予普通饲料外,其余各组均给予高脂饲料喂养。根据前期预实验结果,球囊损伤+高脂饮食喂养6周后,大鼠胆固醇及三酰甘油水平明显升高,颈总动脉苏木精-伊红(HE)染色出现粥样硬化斑块,提示造模成功。
1.5给药方法 造模成功后,中药小剂量组、中药大剂量组分别给予参红通络方免煎农本颗粒7.15和28.60 g·kg-1·d-1,溶于温水2 mL灌胃;辛伐他汀组给予辛伐他汀1 mg·kg-1·d-1,溶于温水2 mL灌胃;假手术组、模型对照组给予等容积0.9%氯化钠溶液灌胃。均每天1次,连续8周,以上剂量均按《医学实验动物学》人、鼠剂量转换公式换算。
1.6观察指标与测定方法 血清样品的制备:实验结束后摘眼球取血,室温放置30 min~2 h,血清析出后3000 r·min-1(r=15 cm)离心10 min,吸取上层血清,-80 ℃保存备用。
动脉标本的取材:将取完血清的大鼠处死,取损伤部位动脉,截取1~2 cm置于4%多聚甲醛备用,剩余部分置微型离心(eppendorf,EP)管,-80 ℃冰箱保存待测。
大鼠血清ox-LDL、sCD40L的测定:从冰箱取出 ELISA试剂盒及血样,室温复温约30 min,按试剂盒说明书进行操作。
颈总动脉病理形态观察:将颈总动脉置4%多聚甲醛固定液48~72 h,0.1 mol·L-1中性磷酸盐缓冲液(PBS)液充分洗涤,过夜,修复组织块,梯度乙醇,二甲苯、浸蜡Ⅰ1、Ⅱ处理,石蜡包埋,LKB~V型超薄切片机切片,厚3~4 μm,每块组织切5片,以防损坏备用。病理摊烤片机干燥,切片后HE染色,光镜下观察组织形态学变化。
免疫组化法观察斑块细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、TNF-α表达:①操作步骤,采用免疫组化链霉菌抗生物素蛋白-过氧化物酶连结法(streptavidin-perosidase,SP)法检测),a.颈总动脉组织修块固定,脱水透明,石蜡包埋切片;b.PBS(0.01 mol·L-1,pH值7.5±0.1)冲洗;c.对组织抗原进行相应修复;d.每张切片加过氧化氢酶阻断溶液(H2O2),室温孵育10 min,PBS冲洗;e.除去PBS液,每张切片加正常非免疫动物血清,室温孵育;f.除去血清,每张切片加第一抗体;g.PBS冲洗,每张切片加生物素标记的第二抗体,室温孵育,PBS冲洗;h.除去PBS液,每张切片加第三抗体链霉菌抗生物素-过氧化物酶溶液,室温孵育,PBS冲洗;i.除去PBS液,每张切片加氧化二氨基联苯胺(diaminobenzidine,DAB)溶液,显微镜下观察;j.纯化水冲洗,苏木精复染,水洗,氨水返蓝。切片经过梯度乙醇脱水干燥,二甲苯透明,中性树胶封片。②结果的判定:以光镜下内皮细胞胞质染成浅黄色、棕黄色或棕褐色为阳性着色。按阳性染色细胞所占比例分为3级:阳性染色细胞占15%~35%为弱阳性反应(+);阳性染色细胞占36%~75%为阳性反应(++);阳性染色细胞占75%以上为强阳性反应(+++);将免疫组化切片置显微镜下,免疫组化反应显色强度JEDA801D形态学图像分析系统进行分析并测定颈总动脉内皮ICAM-1、TNF-α灰度值(即反映组织化学染色产物深浅程度:灰度值越大,则反映产物浓度越小,反之,浓度越大),每张切片取视野5个,取平均值。
AS斑块内CD40mRNA及IL-1B mRNA表达:①RNA的提取,取冻存大鼠颈总动脉50 mg,置研钵中迅速在液氮中研成粉末,采用Total RNA提取试剂常规提取总RNA,DNase I(RNase Free)进行DNA消化。②反转录反应:采用反转录反应体系20 μL合成cDNA。③Real-Time PCR反应:取反转录后产物cDNA作为模板进行PCR扩增。扩增以GAPDH基因表达作为内参照,GAPDH上游引物序列:5′-AGTGCCAGCCTCGTCTCATA-3′,下游引物序列:5′-TGAACTTGCCGTGGGTAGAG -3′;CD40上游引物序列:5′-ATACCCTCTGTGGTTTCCAGC-3′,下游引物序列:5′-TCCTTTGGTTTGACCACC-3′;IL-1β引物序列:上游5′-CGATGGTCCCAATTACATGA-3′,下游:5′-TTGTAGGGTTGGCAGGAGAT-3′,Real-time PCR反应体系20 μL,含SYBRP remixExTaqTM (×2)10 μL,PCR Forward Primer (10 μmol·L-1)0.4 μL,PCR Reverse Primer(10 μmol·L-1)0.4 μL,ROX Reference Dye (×50)0.4 μL,cDNA模板1 μL,ddH2O 7.8 μL。多次循环,变性、退火、延伸,每个样本重复3次。Real-time PCR仪数据分析软件(SDDS,Version 1.3,Taq Man)得出CD40、IL-1β和GAPDH的CT值。

2 结果
2.1一般情况 随着喂养时间延长,各组大鼠体质量均增加,假手术组大鼠反应灵敏,进食饮水正常,毛色润泽,体质量增长,精神状态良好;模型对照组反应较迟钝,喜蜷缩,毛色暗沉,体质量增长较少。其他组大鼠反应、进食、毛色、精神方面均优于模型对照组。
2.2大鼠死亡情况 球囊损伤术前假手术组死亡1只,考虑死亡原因可能为麻醉药不耐受。球囊损伤术后假手术组、辛伐他汀组、中药大剂量组各死亡3只,模型对照组、中药小剂量组各死亡2只,考虑死因可能为手术牵拉迷走神经导致肠梗阻。高脂饮食饲喂过程中,模型对照组、中药小剂量组大鼠各死亡1只。最终假手术组存活12只,其他4组各存活13只。
2.3ox-LDL与sCD40L测定结果 见表1。与假手术组比较,模型对照组大鼠血清ox-LDL、sCD40L含量均显著升高 (P<0.01);与模型对照组比较,中药大剂量组、中药小剂量组、辛伐他汀组ox-LDL、sCD40L含量均不同程度下降(P<0.05或P<0.01),中药大剂量组与辛伐他汀组ox-LDL、sCD40L降低程度差异无统计学意义。

表1 5组大鼠ox-LDL与sCD40L测定结果Tab.1 Determination of ox-LDL and sCD40L in five groups of rats
2.4颈总动脉病理形态 结果见图1。假手术组颈总动脉结构完整,内膜连续,平滑肌细胞及弹力纤维板排列整齐;模型对照组颈总动脉结构破坏明显,可见大量泡沫细胞、巨噬细胞及淋巴细胞浸润,中膜层明显萎缩,平滑肌细胞排列明显紊乱,弹力纤维板呈波浪状排列,板间间隙增大,部分呈断裂状态;中药小剂量组颈总动脉内膜较不光滑,内皮下可见中等量泡沫细胞、巨噬细胞及淋巴细胞聚集,平滑肌细胞排列较紊乱,弹力板间隙变大,但该组病理变化较模型对照组明显减轻;辛伐他汀组、中药大剂量组颈总动脉病变显著减轻,内膜较光滑,弹力纤维板间隙增大不明显,平滑肌细胞排列较整齐,未见明显泡沫细胞、巨噬细胞及淋巴细胞。
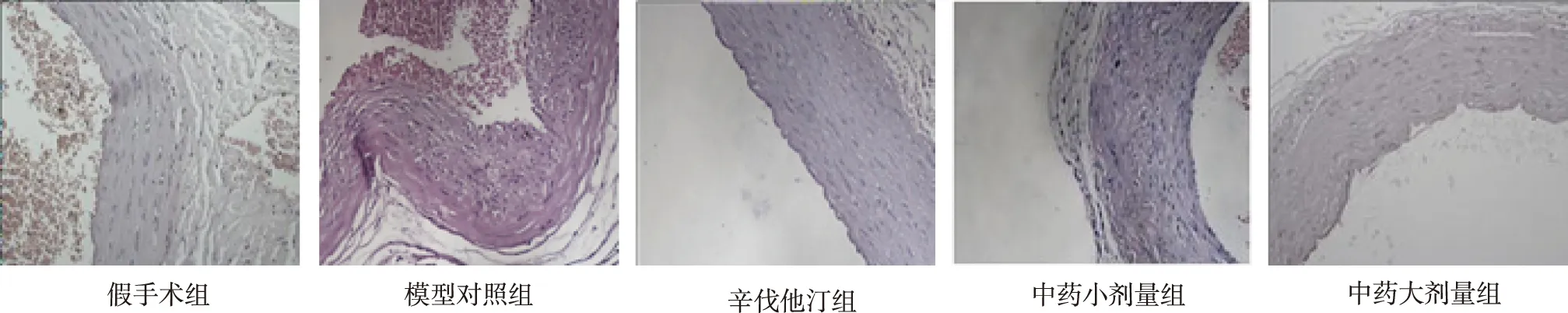
图1 5组大鼠颈总动脉HE染色(×200)Fig.1 HE staining on common carotid arteries in five groups of rats(× 200)
2.5斑块中ICAM-1表达情况 结果见图2。假手术组颈总动脉内皮结构清晰,几乎无染成黄色的ICAM-1存在;模型对照组大鼠颈总动脉内皮局部可见大量ICAM-1表达,其他各组大鼠颈总动脉内膜可见ICAM-1表达,但显著少于模型对照组。

图2 5组斑块中ICAM-1表达情况 (×200)Fig.2 ICAM-1 expression in the plaques of five groups of rats(× 200)
2.6斑块中TNF-α表达情况 见图3。假手术组大鼠颈总动脉未见TNF-α表达,模型对照组大鼠颈总动脉TNF-α表达明显,其他各组大鼠颈总动脉棕黄色颗粒较模型对照组显著减少,提示TNF-α表达明显降低。

图3 5组斑块中TNF-α表达情况(×200)Fig.3 TNF- α expression in the plaques of five groups of rats(× 200)
2.7斑块中CD40mRNA表达情况 见图4。与假手术组比较,模型对照组斑块内CD40mRNA表达量显著增加(P<0.01);与模型对照组比较,辛伐他汀组、中药大剂量组、中药小剂量组斑块中CD40mRNA表达量显著降低(P<0.01),其中中药大剂量组略小于辛伐他汀组与中药小剂量组。
2.8AS斑块内IL-1βmRNA表达情况 见图5。与假手术组比较,模型对照组斑块内IL-1βmRNA表达明显增加,差异有统计学意义(P<0.01);与模型对照组比较,辛伐他汀组、中药小剂量组斑块内IL-1βmRNA表达明显降低,差异有统计学意义(P<0.05),中药大剂量组斑块内IL-1βmRNA降低更显著(P<0.01)。

①与假手术组比较,t=13.387,P<0.01;②与模型对照组比较,t=3.617~5.120,P<0.01。图4 5组斑块中CD40 mRNA相对表达①Compared with sham operation group,t=13.387,P<0.01;②Compared with model control group,t=3.617-5.120,P<0.01.Fig.4 The mRNA expression of CD40 in the plaques of five groups of

①与假手术组比较,t=6.072,P<0.01;②与模型对照组比较,t=2.091~3.158,P<0.05;③与模型对照组比较,t=4.138,P<0.01。图5 5组斑块内IL-1β mRNA表达情况①Compared with the sham operation group,t=6.072,P<0.01;②Compared with the model control group,t=2.091-3.158,P<0.05;③Compared with the model control group,t=4.138,P<0.01.Fig.5 The mRNA expression of IL-1β in the plaques of five groups of
3 讨论
CD40/CD40L通路是重要的免疫炎症反应通路,在非疾病状态下,CD40、CD40L处于不表达或低表达状态,遇到炎症等刺激会导致其表达量显著上调。CD40L与CD40配接成功后激活CD40,促使其进入细胞内与TNF受体相关因子(TNF receptor-associated factors,TRAFs)衔接[3-4],CD40与TRAFs衔接完成后,促使下游黏附分子(如ICAM-1)、炎症因子(如IL-1β和TNF-α等)等大量释放,为AS发生发展提供强大动力。多项研究结果表明,抑制CD40/CD40L信号通路及其相关信号分子能有效延缓AS进程[5-8]。
LOX-1是ox-LDL结合的重要位点,与ox-LDL结合后可以激活CD40/CD40L通路,极大促进活性氧物质及炎症因子释放,严重损害血管内皮功能,对泡沫细胞的形成及内膜增生具有推动作用[9],并能破坏线粒体DNA,参与血管细胞凋亡和自噬[10]。临床研究显示,黏附分子与冠心病和急性心肌梗死有关,可以作为疾病诊断、治疗及评估预后的参考指标[11]。动物实验已经证实,黏附分子缺乏避免了免疫成分细胞的黏附及迁移,也显著减轻了LDL-/-鼠AS损伤[12]。TNF-α是由巨噬细胞分泌的对肿瘤细胞有极强杀伤力的小分子生物活性蛋白。动物研究显示,ApoE-/-小鼠注射TNF-α后内皮细胞LDL转胞吞作用增强,LDL颗粒在血管壁沉积增多[13],刺激了AS产生。同时TNF-α通过刺激白细胞介素及趋化因子等的释放,激活嗜中性粒细胞,促使炎症细胞在损伤部位的聚集,并参与血栓形成、血管重塑、内皮细胞凋亡及诱导氧化应激等多个环节,加剧AS病变[14-15]。抑制TNF-α可能对亚临床AS具有预防作用,并可能延缓AS进展[16]。IL-1β通常以无活性前体形式存在,遭遇炎症刺激后经Caspase-1酶剪切活化[17]。实验研究发现,IL-1β对于泡沫细胞的形成具有明显推动作用[18],能够促进内皮细胞分泌多种黏附分子,增强免疫炎症反应,同时对巨噬细胞、粒细胞活性及APC抗原递呈能力具有显著提升作用,还能刺激蛋白分解酶产生[19],可以说IL-1β是一种强有力的免疫炎症刺激因子,影响AS发展。应用IL-1β单克隆抗体能明显减少ApoE-/-小鼠斑块数量。不仅如此,一项随机、双盲、安慰药对照的大型临床试验亦显示,IL-1β抑制药康纳单抗能显著降低心肌梗死患者炎症反应,使AS患者心血管终点事件下降15%[20],表明降低IL-1β含量可能成为防治AS的有效方法。上述研究表明,CD40/CD40L通路与AS密切相关,LOX-1、CD40、CD40L作为通路上游信号,ICAM-1、sCD40L、TNF-α、IL-1β作为通路下游信号,在CD40/CD40L通路整个信号转导过程中发挥重要作用,这些信号分子表达上调时刺激AS发生,抑制这些信号分子的表达则有利于延缓AS进展。
本研究结果显示,与模型对照组比较,中药大剂量组与小剂量组ox-LDL、sCD40L含量均不同程度下降,中药大剂量组与辛伐他汀组ox-LDL、sCD40L降低幅度相当;颈总动脉HE染色显示,中药大剂量组病变程度显著减轻,内膜较光滑,弹力纤维板间隙增大不明显,平滑肌细胞排列较整齐,未见明显泡沫细胞、巨噬细胞及淋巴细胞;中药大剂量组与小剂量组斑块中ICAM-1、TNF-α表达显著减少;通过荧光定量PCR法检测AS斑块内CD40mRNA及IL-1βmRNA表达显示,中药大剂量组大鼠斑块内CD40mRNA与IL-1βmRNA表达显著降低,CD40mRNA降低与辛伐他汀组相当,IL-1βmRNA降低优于辛伐他汀组。综上所述,参红通络方具有较好抑制炎症因子、抗AS、稳定易损斑块作用,该作用可能通过干预CD40/CD40L信号转导实现。
