紫贻贝加工下脚料抗菌肽的分离及其稳定性研究
2021-07-06时光宇潘渊博赵莘芷徐琼怡杨玉霞庄黛娜
时光宇,张 玥,潘渊博,赵莘芷,徐琼怡,杨玉霞,庄黛娜
(浙江海洋大学东海科学技术学院,浙江舟山 316000)
近年来,抗生素的过度使用导致细菌耐药性、抗生素残留等问题日益突出,严重制约着我国水产、畜牧养殖及食品工业的可持续发展[1]。因此,迫切需要寻找新型的抗生素替代物。抗菌肽(antimicrobial peptides,AMPs)是生物免疫系统产生的一类抵御外源病原体入侵的低分子质量肽类物质[2],由于具有活性强、安全性高、不易产生耐药性等特点,有望成为化学防腐剂、抗生素的理想替代品[3]。
贻贝是一种滤食性底栖海洋生物,长期生活在微生物多样性和复杂性的环境里(菌落总数为9 lgCFU·mL-1)[4],由于缺乏特异免疫系统,抗菌肽成为其抵御外源病原微生物侵袭的重要屏障[5]。目前,从3 种贻贝属(地中海贻贝Mytilus galloprovincialis、紫贻贝M.edulis 和厚壳贻贝M.coruscus)和1 种股贻贝属(翡翠贻贝Perna viridis)的血细胞、鳃和消化腺中鉴定出100 多种抗菌肽,按其序列特征可分为7 个家族[6],即Myticin、Mytilin、Mytimycin、MGD、Myticusin、big defensins 和Mytimacin。不同生长环境与发育阶段的贻贝会分泌不同抗菌肽抵御外源病原微生物的侵袭[7],而不同抗菌肽有着不同的结构和序列,其抑菌活性、理化性质及稳定性等特征也相应存在差异。
目前,有关紫贻贝抗菌肽的研究相对较少,如CHARLET,et al[8]从紫贻贝血液中分离鉴定出5 个抗菌肽,即defensin A(4 314.3 Da)、defensin B(4 392.4 Da)、Mytilin A(3 773.7 Da)、Mytilin B(3 974.3 Da)和Mytimycin(6 233.5 Da);李哲等[9]从紫贻贝肉中提取分离出1 个抗菌肽(5 908 Da),而宋宏霞[10]从紫贻贝肉的酶解液中分离出1 个抗菌肽(2 490 Da)。张玥等[11]尝试利用超声辅助乙酸提取紫贻贝加工下脚料(受损/小规格紫贻贝)中抗菌肽,结果表明工艺可行。为了实际生产中能正确应用抗菌肽,需对其抑菌活性、理化性质及稳定性等特征要有详细了解,而抗菌肽的分离纯化是抑菌活性、理化性质与结构鉴定的基础。
多肽分离方法主要有超滤、离子交换色谱、凝胶过滤色谱、超/高效液相色谱、亲和色谱等方法。实际操作中,一般采用2 种或以上分离方法对抗菌肽进行分离,从而精确分离目标肽[12]。因此,本试验先对紫贻贝加工下脚料粗提抗菌肽的敏感菌进行分析,在此基础上利用固相萃取、凝胶过滤色谱和半制备高效液相色谱(semi-preparative high performance liquid chromatography,半制备RP-HPLC)对其抗菌肽进行分离纯化,并对纯度高、活性强的抗菌肽的相对分子质量和稳定性进行分析,从而为紫贻贝加工下脚料抗菌肽的制备与进一步应用提供基础和依据。
1 材料与方法
1.1 材料与试剂
紫贻贝加工下脚料,舟山市某水产公司提供,受损的和小规格紫贻贝装入碎冰泡沫箱。
大肠杆菌(GIM1.708)、金黄色葡萄球菌(GIM1.178)、枯草芽孢杆菌(GIM1.222),广东省微生物菌种保藏中心;营养肉汤培养基、胰酪大豆胨琼脂培养基,杭州微生物试剂有限公司;Sep-pak C18 固相萃取柱,美国Waters 公司;乙腈,HPLC 级,美国天地公司;三氟乙酸,HPLC 级,国药集团化学试剂有限公司;其它试剂均为国产分析纯。
1.2 仪器与设备
Waring-8010S 组织捣碎机,美国Waring 公司;SK5210HP 型超声波清洗器(超声频率53 KHz,超声功率200 W),上海科导超声仪器有限公司;LGJ-10 型冷冻干燥机,北京松原华兴科技发展有限公司;SPX-150B-Z 型生化培养箱,上海博迅医疗生物仪器股份有限公司;AKTA Purifier 10 型蛋白纯化仪(配有UV-900 型紫外-可见光检测器和Unicorn 控制软件),瑞典安玛西亚公司;Waters 1525-2998 型半制备液相色谱仪(配有Empower 色谱工作站),美国Waters 公司。
1.3 实验方法
1.3.1 抗菌肽的制备及敏感菌筛选
紫贻贝下脚料半解冻后取肉、清洗、沥干。准确称取一定质量的紫贻贝肉,倒入螺口试剂瓶中,按张玥等[11]紫贻贝下脚料抗菌肽提取工艺进行抗菌肽的粗提,上清液冻干后即为紫贻贝粗抗菌肽,按1.3.2 方法测定其多肽含量与得率。
用20 mmol·L-1pH 4.0 乙酸-乙酸钠缓冲液分别将紫贻贝粗抗菌肽和头孢克肟配制成100 mg·mL-1多肽溶液和100 μg·mL-1头孢克肟溶液,其中100 μg·mL-1孢克肟溶液和20 mmol·L-1pH 4.0 乙酸-乙酸钠缓冲液分别作为阳性对照和阴性对照。以大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌为受试菌,吸取100 μL 0.22 μm 水相微孔滤膜过滤的滤液,采用琼脂打孔法[11]测定其抑菌活性。
1.3.2 多肽含量与得率测定
采用考马斯亮蓝法[14],以结晶牛血清蛋白作为标样,采用最小二乘法做结晶牛血清蛋白标准溶液质量浓度(μg·mL-1)与吸光值A595 的线性回归方程:y=0.003 6x+0.286,相关系数R2=0.995 1。吸取1.0 mL 适当浓度的多肽溶液,加入5.0 mL 考马斯亮蓝G-250 试剂,涡流混匀静置5 min 后于595 nm 下测吸光值。多肽含量(%)=多肽溶液质量浓度(μg·mL-1)×多肽溶液体积(mL)×体积稀释倍数(n)/(1 000×样品质量(mg));多肽得率(%)=多肽含量(%)×多肽样品总质量(mg)/样品质量或进样多肽质量(mg)×100%。
1.3.3 抑菌活性及残留率测定
以敏感菌为指示菌,采用琼脂打孔法[11]测定各分离组分的抑菌活性,抑菌活性以抑菌圈直径大小(mm)表示。以20 mmol·L-1pH 4.0 乙酸-乙酸钠缓冲液作为阴性对照,未经处理的抗菌肽溶液作为阳性对照,计算抑菌活性残留率,抑菌活性残留率(%)=(样品抑菌圈直径-阴性对照抑菌圈直径)/(阳性对照抑菌圈直径-阴性对照抑菌圈直径)×100%。
1.3.4 抗菌肽的分离纯化
1.3.4.1 固相萃取
称取1.0 g 紫贻贝抗菌肽粗提物,溶解于10 mL 0.1%三氟乙酸(trifluoroacetic acid,TFA)溶液中,12 000×g离心10 min,上清液在平衡好的Sep-pak C18 固相萃取柱(6 mL、500 mg)进行分步洗脱分离。分离条件:上样体积2 mL,流速2 mL·min-1,阶段洗脱顺序为0%、10%、40%、80%乙腈的0.1%TFA 溶液,洗脱体积12 mL,收集各洗脱组分,分别命名为Sp0、Sp10、Sp40 和Sp80。多次重复上样洗脱,合并各洗脱液,冻干后按1.3.2 方法测定多肽含量与得率。各洗脱组分用20 mmol·L-1pH 4.0 乙酸-乙酸钠缓冲液配制成10 mmol·L-1多肽溶液,0.22 μm 水相微孔滤膜过滤备用,按1.3.3 方法测定抑菌活性。
1.3.4.2 Sephadex G-25 层析
上述抑菌活性最高组分用超纯水配制成10 mg·mL-1多肽溶液,12 000 ×g 离心10 min,上清液在平衡好的Sephadex G-25 凝胶柱(Ø1.0 cm×60 cm)中进行分离。柱层析条件:上样体积1 mL、流速1.0 mL·min-1、检测波长220 nm,洗脱液为超纯水,收集各色谱峰。多次重复分离,合并各色谱峰,冻干后按1.3.2 方法测定多肽含量与得率。各色谱峰用20 mmol·L-1pH 4.0 乙酸-乙酸钠缓冲液配制成10 mg·mL-1多肽溶液,0.22 μm 水相微孔滤膜过滤备用,按1.3.3 方法测定抑菌活性。
1.3.4.3 半制备RP-HPLC 色谱
上述抑菌活性最高组分用0.1%三氟乙酸溶液配制成1 mg·mL-1多肽溶液,12 000 ×g 离心10 min,上清液进行RP-HPLC 色谱分离。色谱条件:SunfireTM C18 色谱柱(Ø19 mm×250 mm,5 μm),检测波长220 nm,柱温25 ℃,流动相为乙腈(含0.1%TFA)和0.1%TFA,流速1.0 mL·min-1,上样体积100 μL;线性梯度洗脱模式,60 min 内乙腈体积分数从10%升至40%。多次重复分离,合并收集各色谱峰,冻干后按1.3.2 方法测定多肽含量与得率,各色谱峰用20 mmol·L-1pH 4.0 乙酸-乙酸钠缓冲液将多肽粉配制成1 mg·mL-1多肽溶液,0.22 μm 水相微孔滤膜过滤备用,按1.3.3 方法测定抑菌活性。
1.3.5 稳定性分析
1.3.5.1 温度
用20 mmol·L-1pH 4.0 乙酸-乙酸钠缓冲液将HPLC 分离获得组分单一、活性强的抗菌肽配制成1 mg·mL-1多肽溶液,800 μL 多肽溶液分装于离心管内,分别在40、60、80、100 ℃条件下处理10 min 和20 min,冰水冷却,12 000 ×g 离心10 min,按1.3.3 方法测定其残留活性,未经热处理多肽溶液作为阳性对照。
1.3.5.2 反复冻融
用20 mmol·L-1pH 4.0 乙酸-乙酸钠缓冲液将HPLC 分离获得组分单一、活性强的抗菌肽配制成1 mg·mL-1多肽溶液,800 μL 多肽溶液分装于离心管内,置于-18 ℃冰箱中反复冻融2、4、8、12、16 次(冷冻30 min/次,25 ℃水浴30 min/次),12 000 ×g 离心10 min,按1.3.3 方法测定其残留活性,未经冻融处理的多肽溶液作为阳性对照。
1.3.5.3 蛋白酶
分别用20 mmol·L-1的pH 4.0 乙酸-乙酸钠缓冲液、20 mmol·L-1的pH 7.5 和pH 8.0 PBS 缓冲液将HPLC 分离获得组分单一、活性强的抗菌肽配制成1 mg·mL-1多肽溶液;胃蛋白酶、蛋白酶K 和胰蛋白酶也分别用20 mmol·L-1的pH 4.0 乙酸-乙酸钠缓冲液、20 mmol·L-1的pH 7.5 和pH 8.0 PBS 缓冲液配制成2.5 mg·mL-1酶溶液。分别吸取200 μL 多肽溶液和40 μL 蛋白酶溶液于1.5 mL 离心管内,胰蛋白酶和胃蛋白酶水解温度为37 ℃、蛋白酶K 酶解温度为42 ℃,水解时间为90 min,待水解结束后于85 ℃水浴15 min[13],冰水冷却,12 000 ×g 离心10 min,按1.3.3 方法测定其残留活性,以未经酶处理的多肽溶液作为阳性对照。
1.3.6 相对分子质量测定
采用凝胶过滤色谱法(gel filtration chromatography,GPC)对HPLC 分离获得组分单一、活性强的抗菌肽的相对分子质量进行测定。色谱条件:色谱柱Ultrahydrogel 250(7.8 mm×300 mm)串联Ultrahydrogel 100(7.8 mm×300 mm),流动相50 mmol·L-1PBS(含100 mmol·L-1NaCl,pH 6.8),洗脱速率1.0 mL·min-1,柱温25 ℃,检测波长220 nm,上样质量浓度1 mg·mL-1,上样体积50 μL。采用细胞色素C(12.4 kDa)、抑肽酶(6.5 kDa)、维生素B12(1.35 kDa)、Tyr-Phe-Glu(457 Da)作为标准分子质量物质,LgMr 与标准物质洗脱时间的线性回归方程为:LgMr=6.956 9-0.207 2x,相关系数R2=0.998 9。
1.4 数据处理
利用SPSS 19.0 软件进行数据处理及差异性分析,试验结果以x¯±S 表示,P<0.05 差异显著;采用OriginPro 9.1 软件进行绘图。
2 结果与分析
2.1 敏感菌的筛选
经超声辅助乙酸提取与冷冻干燥后,紫贻贝加工下脚料抗菌肽粗提物冻干粉呈淡黄色粉末,经计算其得率为(1.55±0.04)%。紫贻贝抗菌肽粗提物对金黄色葡萄球菌和大肠杆菌具有抑菌活性,其抑菌活性分别达到阳性对照的88.06%和33.21%(表1);而抗菌肽粗提物对枯草芽胞杆菌无抑菌效果(抑菌圈直径<2 mm),这与CHANDRAN,et al[15]的研究结果相一致,表明抗菌肽的抑菌活性具有选择性和特异性。因此,后续试验选用金黄色葡萄球菌作为敏感指示菌。

表1 紫贻贝粗抗菌肽的抑菌活性Tab.1 Antimicrobial activity of crude antimicrobial peptides from M.edulis by-products
2.2 分离纯化
2.2.1 固相萃取
固相萃取因其简单、方便而广泛被应用于多肽和蛋白的富集纯化[16]。由图1 可知,Sp40 和Sp80 洗脱组分具有抑菌活性,而Sp0 和Sp10 洗脱组分无抑菌活性,这与DEFER,et al[17]的研究结果相似。其中,Sp40洗脱组分的抑菌活性最高,抑菌圈直径为(11.38±1.59)mm,且其得率相对较高(30.83%)。同时,Sp40 洗脱组分具有两亲性和一定程度的疏水性,可能为蛋白或肽类[3]。为验证其是否为抗菌肽,利用凝胶过滤层析对Sp40 洗脱组分进行进一步分离。

图1 固相萃取洗脱组分的抑菌活性与得率Fig.1 Antimicrobial activity and yield of solid phase extraction fractions of crude peptides from M.edulis by-products
2.2.2 Sephadex G-25 层析
凝胶过滤层析是活性肽分离纯化的简单常用方法[18]。Sp40 洗脱组分经Sephadex G-25 凝胶过滤层析分离,色谱结果和抑菌活性见图2。色谱图中出现4 个洗脱峰,其中峰2(命名为Sp40-2 组分)具有抑菌活性,其抑菌圈直径为(23.19±3.82)mm,表明Sp40 洗脱组分中抑菌活性成分为多肽。另外,相同剂量下Sp40-2 组分比Sp40 洗脱组分的抑菌活性更强(P<0.05),说明SephadexG-25 对其抗菌肽纯化是有效的。为进一步获得抑菌活性和纯度相对较高的抗菌肽,采用半制备RP-HPLC 色谱对Sp40-2 组分进行进一步分离。

图2 Sp40 洗脱组分的Sephadex G-25 层析色谱图及分离峰抑菌活性Fig.2 Sephadex G-25 chromatogram of fraction Sp40 and antimicrobial activity of its separate peaks
2.2.3 半制备RP-HPLC 色谱
图3 显示,Sp40-2 组分经半制备RP-HPLC 色谱分离后仅有峰4 和峰段5(分别命名为Sp40-2-4 和Sp40-2-5)具有抑菌活性(抑菌圈直径分别为(33.26±4.35)mm 和(32.83±5.04)mm),其抑菌活性显著高于其抗菌肽粗提物(P<0.05)。Sp40-2-4 和Sp40-2-5 的抑菌活性无显著性差异(P>0.05),表明其抑菌活性不仅与其疏水性有关[19],也与其肽链组成与结构有关[20]。尽管Sp40-2-4 组分得率低于Sp40-2-5 组分,但Sp40-2-4 组分纯度(图4)和水溶解性均高于Sp40-2-5 组分。同时,图4 表明Sp40-2-4 组分为单一色谱峰,其相对分子质量约为1 970.78 Da,与已报道紫贻贝抗菌肽相对分子质量均不同[8-10]。鉴于此,后续试验着重研究Sp40-2-4 组分的稳定性。
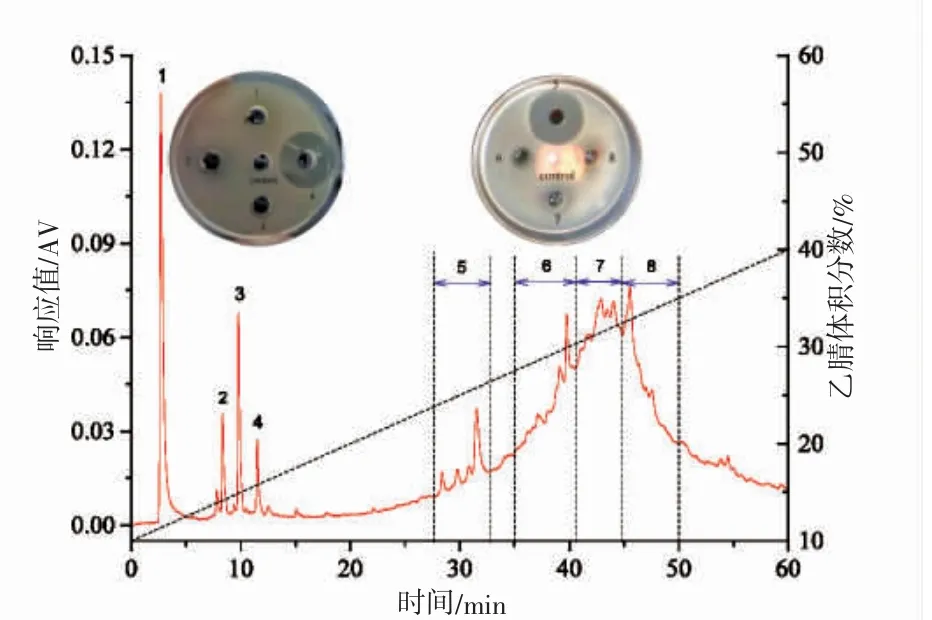
图3 Sp40-2 组分的半制备RP-HPLC 色谱图及各分离峰/段的抑菌活性Fig.3 Semi-preparative RP-HPLC chromatogram of fraction Sp40-2 on C18 preparative column and antimicrobial activity of its separate peaks

图4 Sp40-2-4 组分的GPC 色谱图Fig.4 Gel filtration chromatogram of fraction Sp40-2-4
2.3 Sp40-2-4 组分稳定性研究
2.3.1 温度
图5 显示,随着处理温度升高和作用时间延长,Sp40-2-4 组分的抑菌活性残留率逐渐降低。当温度≥100 ℃时,随着作用时间延长,Sp40-2-4 组分的抑菌活性残留率显著降低(P<0.05),这与HAUG,et al[4]研究的偏顶蛤乙腈提取物热稳定性结果相似,抑菌活性降低可能由于高温破坏了Sp40-2-4 组分的多肽分子结构[21]。李哲等[9]从紫贻贝中分离获得的抗菌肽经100 ℃加热20 min 后其抑菌活性基本丧失,而Sp40-2-4 组分抑菌活性残留率达72.42%,表明Sp40-2-4 组分具有一定的热稳定性,而且Sp40-2-4组分与其组成与结构不同。

图5 温度对Sp40-2-4 组分抑菌活性的影响Fig.5 Effect of temperature on the antimicrobial activity of fraction Sp40-2-4
2.3.2 反复冻融
从图6 可看出,当冻融次数≤10,Sp40-2-4 组分的抑菌活性残留率无显著降低(P>0.05),残留率为91.42%以上;而冻融次数≥12 时,其抑菌活性残留率显著降低(P<0.05),其中反复冻融16 次后其抑菌活性残留率降至57.49%,这与亚洲飞蝗抗菌肽的反复冻融结果相一致[22]。反复冻融会影响Sp40-2-4 组分多肽的结构和溶解性(离心管底部有沉淀),最终导致其抑菌活性降低。由此可知,当冻融次数≤10 时,Sp40-2-4 组分对反复冻融有一定的耐受性。

图6 反复冻融对Sp40-2-4 组分抑菌活性的影响Fig.6 Effect of freeze-thaw cycles on the antimicrobial activity of fraction Sp40-2-4
2.3.3 蛋白酶
图7 反映了Sp40-2-4 组分经3 种蛋白酶处理后其抑菌活性残留率的变化情况。经胃蛋白酶处理后,Sp40-2-4 组分抑菌活性残留率降至75.59%,这表明Sp40-2-4 组分具有一定的抗胃蛋白酶水解能力;而分别经胰蛋白酶、蛋白酶K 处理后,其抑菌活性残留率分别降至9.91%和8.93%,其抑菌活性基本丧失,表明Sp40-2-4 组分具有胰蛋白酶和蛋白酶K 的酶切位点,易被水解而失去抑菌活性。由此可知,Sp40-2-4组分对胃蛋白酶具有一定的耐受性,而对胰蛋白酶和蛋白酶K 的耐受性较差。

图7 蛋白酶对Sp40-2-4 组分抑菌活性的影响Fig.7 Effect of protease on the antimicrobial activity of fraction Sp40-2-4
3 结论
本试验首先分析了紫贻贝加工下脚料粗提抗菌肽的敏感菌,结果显示,金黄色葡萄球菌为最敏感菌株。在此基础上,采用固相萃取、Sephadex G-25 和半制备型RP-HPLC 对其抗菌肽进行分离纯化,获得2 个具有较高抑菌活性的组分Sp40-2-4 和Sp40-2-5,其抑菌圈直径分别为(33.26±4.35)mm 和(32.83±5.04)mm(P>0.05);GPC 显示Sp40-2-4 组分为单一色谱峰,其相对分子质量约为1 970.78 Da。稳定性试验表明Sp40-2-4 组分具有一定的热稳定性(100 ℃、20 min,抑菌活性残留率72.42%),对反复冻融(冻融次数≤10,抑菌活性残留率91.42%以上)和胃蛋白酶(抑菌活性残留率75.59%)有一定的耐受性;而对胰蛋白酶和蛋白酶K耐受性差(抑菌活性残留率10%以下)。
综上所述,Sp40-2-4 组分有被用于食品防腐的可能性,但其稳定性还有待提高,可尝试在分子水平上对其进行改良提高其稳定性。本研究说明在紫贻贝加工下脚料中存在具有抑菌活性的多肽,且经过逐步分离可获得高抑菌活性的多肽成分,从而为其抗菌肽的开发及相关研究奠定了基础。
