MicroRNA-326通过靶向Klk7调控MAPK信号通路对抑郁模型大鼠的神经保护作用
2021-07-06钟艳丽吴宏伟
刘 涛,张 望,钟艳丽*,吴宏伟
(1.重庆市精神卫生中心老年科,重庆 401147;2.第三军医大学基础医学院神经生物学教研室,重庆 400038)
重度抑郁症(major depressive disorder,MDD)是一种具有多种症状的情绪障碍,对人类的健康及生存存在着重大威胁, 其病理生理学涉及多种机制,包括单胺缺乏、昼夜节律异常、下丘脑-垂体-肾上腺轴失调、激素状态变化和炎性细胞因子水平升高[1]。 尽管现在市面上有多种抗抑郁药,但仍有将近三分之一的患者难以被治愈[2]。 因此,有必要进一步了解抑郁症的发病机制,发展更为有效的治疗方法。成熟神经元细胞的减少和神经细胞凋亡的增加是参与抑郁症生理和病理过程的两个重要因素,抑制神经炎症的发生和海马神经元细胞凋亡可以改善抑郁样行为[3]。miRNA属于小的非编码RNA(18-25 nt),参与抑郁症的发生发展过程[4]。另有研究表明,miR-326参与了细胞凋亡、肿瘤生长、细胞侵袭、胚胎发育、免疫调节、化疗抵抗和肿瘤发生等生物学进程[5]。激肽释放酶(Kallikreins,Klks)是15种丝氨酸蛋白酶的总称,参与各种生理进程和疾病的进展[6]。已有研究证明KLK4-7的共表达,可激活MAPK信号通路,促进卵巢癌疾病进展[7]。生长素释放肽通过抑制小鼠海马神经元中的p38-MAPK信号通路活化而发挥抗抑郁作用[8]。综上所述,本研究采用CUMS建立抑郁症大鼠模型,探究miR-326靶向激肽释放酶成员Klk7通过有丝分裂原激活的蛋白激酶( mitogen activated protein kinase,MAPK)信号通路对抑郁症模型大鼠海马神经元的影响,旨在为抑郁症新疗法的开发提供科学依据。报告如下。
1 材料与方法
1.1材料 胎牛血清、DMEM培养基购自Gibco公司;兔抗Klk7、p38、p-p38、JNK、p-JNK、ERK1/2、p-ERK1/2和GAPDH抗体,HRP标记二抗购自Abcam公司;高效RIPA裂解液、碘化丙啶(propidium Iodide,PI)购自Solarbio公司;BCA法蛋白质浓度测定试剂盒、ECL超敏化学发光试剂盒购自Sangon Biotech公司;miR-326 mimic、miR-326 inhibitor、阴性对照(negative control,NC)、siRNA-Klk7-1和siRNA-Klk7-2均由上海吉玛制药技术有限公司合成;TUNEL染色试剂盒购自全式金生物;CCK-8购自英格恩生物公司;大鼠海马神经元细胞完全培养基购自上海一研生物科技有限公司。
1.2实验动物及分组 体重为180~220 g的雄性Sprague-Dawley(SD)大鼠共20只(第三军医大学医学实验动物中心),动物房饲养,室内温度(23±2)℃,保持通风换气,普通鼠饲料喂养。待大鼠适应环境后,将其随机分为2组:空白对照组、慢性不可预测轻度应激(chronic unpredictable mild stress,CUMS)组,每组10只。
1.3抑郁症大鼠模型的建立 本研究采用CUMS建立抑郁症大鼠模型[9]。CUMS组大鼠每天随机选择以下一种刺激执行:禁食、禁水24 h;黑白颠倒12 h/12 h;高温环境饲养;潮湿垫料饲养;噪音干扰;强迫游泳;行为束缚。连续2 d的刺激不能相同,持续刺激3周,每种刺激执行3次。空白对照组大鼠不进行刺激,正常饲养。
1.4大鼠行为学变化检测
1.4.1蔗糖偏好实验 造模结束后,提供各组大鼠1%蔗糖溶液。24 h后,对大鼠禁食、禁水12 h。给各组大鼠提供瓶装自来水和1%蔗糖溶液12 h。6 h后,将2个瓶的位置对调,避免偏侧。蔗糖偏爱(SP)值的计算公式如下所示:
1.4.2旷场实验 实验在一个开口的黑色木盒(长81 cm×宽81 cm×高28 cm)中进行,木盒底部被分成16个等大的方格。将大鼠放置在木盒底部中央,让其自由探索6 min。待大鼠适应2 min后,记录大鼠在4 min内穿越底部的方格数。
1.4.3强迫游泳实验 准备直径为15 cm的透明圆桶,桶内水深20 cm,水温22~25 ℃。将大鼠置于水中15 min进行适应性训练。24 h后,将大鼠置于水中,待大鼠适应2 min后,记录大鼠在4 min内的静止时间。
1.5方法
1.5.1免疫组织化学 大鼠腹腔注射10%水合氯醛溶液(0.3 mL/100 g),待大鼠昏迷后,取出整个大脑置于冰上,立即分离出海马组织。海马组织4%多聚甲醛4℃过夜固定,常规方法石蜡包埋、切片,随后常规二甲苯脱蜡和梯度酒精水化。3% H2O2室温孵育10min,高温高压法抗原修复,10% BSA 37 ℃封闭40 min。滴加Klk7抗体(1∶200)和二抗(1∶100)孵育。DAB显色剂室温显色15 min,自来水终止显色。苏木精染色40 s,1%盐酸酒精分化3 s,蓝化10 s,再次脱水透明后,中性树胶封片。
1.5.2TUNEL染色 海马样品4%多聚甲醛4 ℃过夜固定,常规方法石蜡包埋、切片,随后常规二甲苯脱蜡和梯度酒精水化。3% H2O2室温孵育10 min。蛋白酶K室温孵育20 min。滴加50 μL反应混合物,37 ℃湿盒中反应1 h。滴加50 μL转化剂-POD,37 ℃湿盒中反应30 min,PBS清洗后,滴加DAB显色剂显色。苏木精染色3 s,中性树胶封片。
1.5.3HEK-293T细胞培养 HEK-293T细胞使用含10% FBS的DMEM培养基,在37 ℃、5%CO2条件下培养。待细胞生长至80%~90%密度时,0.25%胰酶溶液消化传代。
1.5.4双荧光素酶报告实验 利用microRA.org靶基因预测软件预测miR-326在Klk7 mRNA上的结合位点,构建Klk7 3′-非编码区(3′-UTR)野生型(WT)和突变型(MUT)的报告基因质粒,分别转染至稳定表达miR-326 mimic和NC的293T细胞中,37 ℃、5% CO2条件下培养48 h。应用Dual-Luciferase Reporter Assay System试剂盒,检测各组萤火虫荧光素酶和海肾荧光素酶的活性。
1.5.5海马神经元细胞培养 D-Hanks冲洗空白对照组和CUMS组大鼠海马CA1区组织并将其剪碎,0.25%胰酶溶液37 ℃条件下孵育,将其消化成细胞团或单个细胞。500 r/min离心5 min,弃上清,加入大鼠神经元细胞完全培养基重悬细胞,并将细胞密度调整至2×106个/mL,转移至细胞培养瓶,37 ℃,5%CO2条件下培养,待细胞密度达到80%~90%时,0.25%胰酶溶液消化传代。
1.5.6细胞转染 将HEK-293T细胞(或海马神经元细胞)按照5×104个/孔的密度接种至6孔板中,37 ℃、5%CO2条件下培养24 h后进行细胞转染。根据LipofectamineTM 2000说明书进行miR-326 mimic、miR-326inhibitor、NC和siRNA-Klk7的转染。37 ℃、5%CO2条件下培养48 h后,进行后续实验。转染序列见表1。
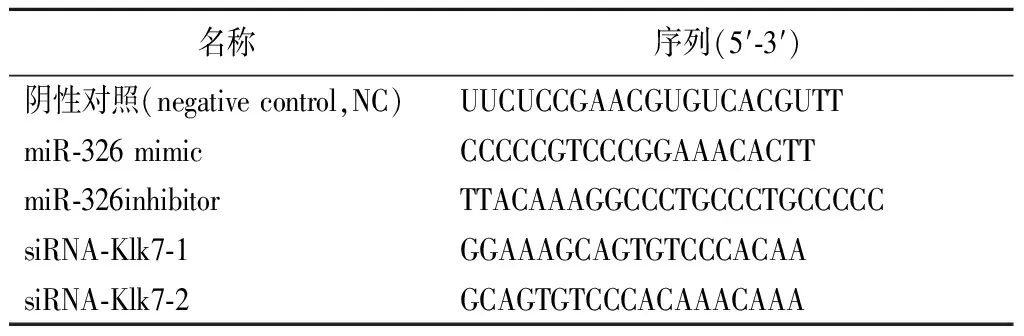
表1 转染序列Table 1 Transfection sequence
1.5.7Western blot 收集转染后的HEK-293T细胞(或海马神经元细胞),RIPA裂解液裂解细胞,取上清。BCA法测定蛋白浓度。取30 μg蛋白进行SDS-PAGE,将目的蛋白转至PVDF膜上。5%脱脂奶粉室温封闭3 h,Klk7(1∶500)、p38(1∶1 000)、p-p38(1∶1 000)、JNK(1∶1 000)、p-JNK(1∶1 000)、ERK1/2(1∶1 000)、p-ERK1/2(1∶1 000)和GAPDH(1∶10 000)抗体4 ℃过夜孵育,HRP标记二抗(1∶2 000)37 ℃孵育1 h。ECL法发光、曝光,凝胶成像系统采集图像。
1.5.8实时荧光定量PCR Trizol法提取转染后的HEK-293T细胞(或海马神经元细胞)总RNA,测定各样品RNA浓度,并反转录成cDNA。按照SYBR○RPremix Ex TaqTMⅡ试剂盒说明书配制反应体系,检测miR-326表达和Klk7 mRNA表达。反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 15 s;60 ℃ 30 s;95 ℃ 15 s。以GAPDH和U6为内参,2-△△Ct法计算miR-326表达和Klk7 mRNA表达。实验所需引物序列见表2。
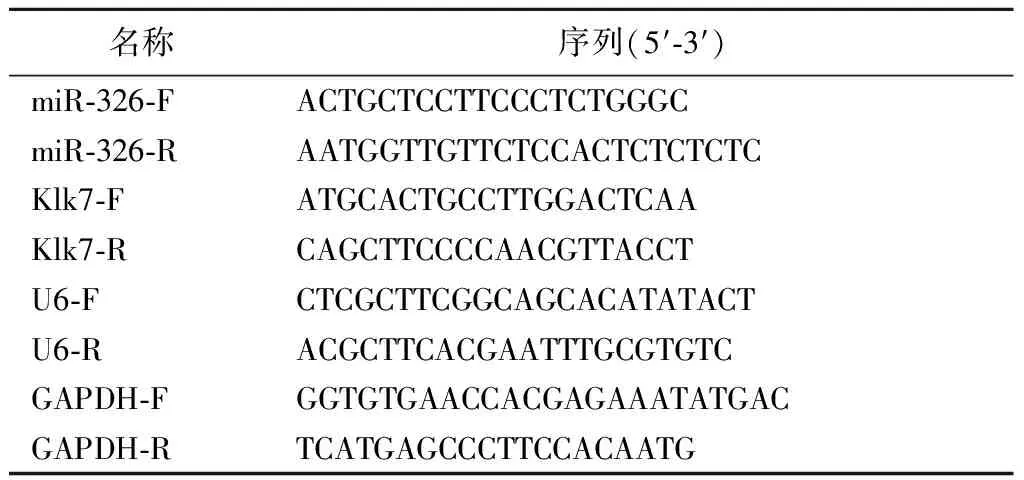
表2 引物序列Table 2 Primer sequences
1.5.9流式细胞术检测细胞凋亡 将海马神经元细胞接种于6孔板内(5×104个/孔),37 ℃,5%CO2条件下培养24 h,37 ℃,5%CO2条件下继续培养48 h。收集细胞,70%乙醇4 ℃过夜固定。5 μL RNaseA(10 mg/mL)37 ℃处理1 h,Annexin V 和PI 37 ℃避光孵育1 h,流式细胞仪检测细胞凋亡。将转染后的海马神经元细胞接种于96孔板(5×103个/孔),每组设置3个重复,37 ℃、5%CO2条件下培养。24,48,72 h后分别加入10 μL CCK-8 37 ℃条件下孵育3 h,酶标仪测定450 nm吸光度。
1.6统计学方法 应用SPSS 21.0统计软件分析数据。计量资料采用独立样本t检验、单因素方差分析、SNK-q检验以及重复测量的方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1CUMS处理对SD大鼠行为学的影响 造模结束后,检测各组大鼠SP值、穿越次数和静止时间,结果显示,与空白对照组相比,CUMS组大鼠SP值、穿越次数均显著下调,静止时间显著上调,差异有统计学意义(P<0.05),说明抑郁症大鼠模型造模成功。见表3。

表3 2组大鼠SP值、穿越次数和静止时间的比较Table 3 Comparison of sucrose preference,crossing times and resting time between two groups
2.2CUMS处理对大鼠海马组织Klk7表达和细胞凋亡的影响 免疫组织化学和TUNEL染色结果显示,与空白对照组相比,CUMS组大鼠海马组织中Klk7表达和细胞凋亡率均显著上调,差异有统计学意义(P<0.05)。见表4。

表4 各组大鼠Klk7表达和细胞凋亡率的比较Table 4 Comparison of KLK7 expression and apoptosis rate in each group
2.3siRNA-Klk7干扰效率筛选 实时荧光定量PCR和Western blot结果显示,与NC组相比,siRNA-Klk7-1和siRNA-Klk7-2组Klk7 mRNA和蛋白表达均显著下调(图1,P<0.05),其中siRNA-Klk7-1下调效果更明显,因此选取siRNA-Klk7-1进行后续实验,简称为siRNA-Klk7。见表5。

图1 Western blot检测Klk7蛋白表达

表5 各组细胞Klk7 mRNA和蛋白表达的比较Table 5 Comparison of Klk7 mRNA and protein expression in each group
2.4miR-326靶向调控Klk7 microRNA靶基因预测软件microRA.org分析结果显示,Klk7基因是miR-326的潜在靶点,miR-326种子序列5′-CUCUGGG-3′ 与Klk7序列5′-CCCAGAG-3′ 靶向结合。荧光素酶报告基因实验结果显示,miR-326 mimic可显著降低野生型Klk7基因3′-UTR报告基因的相对荧光素酶活性差异有统计学意义(P<0.05),而对突变型3′-UTR报告基因的相对荧光素酶活性无显著影响(P>0.05)。见表6。

表6 各组细胞荧光素酶活性的比较Table 6 Comparison of luciferase activity in each group
2.5miR-326靶向Klk7对CUMS大鼠海马神经元细胞增殖的影响 实时荧光定量PCR和CCK-8结果显示,与空白对照组相比,CUMS组细胞miR-326表达和活力显著下调(P<0.05),Klk7 mRNA表达显著上调(P<0.05);与NC组相比,上调miR-326 或下调Klk7,会显著上调细胞活力(P<0.05),下调miR-326则会上调Klk7 mRNA表达,下调细胞活力(P<0.05);与miR-326 inhibitor组相比,同时下调miR-326和Klk7,会显著上调细胞活力(P<0.05)。各组CD的表达量在组间、时点间、组间·时点间交互作用差异均有统计学意义(P<0.05)。见表7~8。

表7 各组细胞miR-326和Klk7 mRNA表达的比较Table 7 Comparison of miR-326 and Klk7 mRNA expression in each group

表8 各组细胞OD值的比较Table 8 Comparison of OD values of cells in each group
2.6miR-326靶向Klk7抑制CUMS大鼠海马神经元细胞凋亡 流式细胞术结果显示,与空白对照组相比,CUMS组大鼠海马神经元细胞凋亡率显著上调;与NC组相比,miR-326 mimic组和siRNA-Klk7组大鼠海马细胞神经元凋亡率显著下调,miR-326 inhibitor组显著上调;与miR-326 inhibitor组相比,miR-326 inhibitor+siRNA-Klk7组大鼠海马神经元细胞凋亡率显著下调,差异有统计学意义(P<0.05)。见表9。

表9 各组细胞凋亡率的比较Table 9 Comparison of apoptosis rate among groups
2.7miR-326靶向Klk7抑制CUMS大鼠海马MAPK信号通路活化 Western blot结果显示,与空白对照组相比,CUMS处理显著上调Klk7和MAPK信号通路相关基因蛋白表达;与NC组相比,上调miR-326 或下调Klk7后细胞Klk7和MAPK信号通路相关基因蛋白表达显著下调,下调miR-326则产生相反变化;与miR-326 inhibitor组相比,同时下调miR-326 和Klk7后细胞Klk7和MAPK信号通路相关基因蛋白表达显著下调,差异均有统计学意义(P<0.05)。见图2和表10。

图2 miR-326靶向Klk7抑制CUMS大鼠海马MAPK信号通路活化

表10 各组细胞中MAPK信号通路相关蛋白表达的比较Table 10 Comparison of MAPK signaling pathway related protein expression in each group
3 讨 论
抑郁症是一种常见的精神病,其特征是悲伤忍耐、自我价值低落、缺乏兴趣或幸福、精力不足或感到疲倦、睡眠不足、食欲不振和注意力不集中,世界约3亿人受其影响。 最近的流行病学研究表明,到2030年,抑郁症可能是疾病负担的主要原因[10]。抑郁症除了导致情绪状态外,还导致认知缺陷[11]。尽管我们在探究抑郁症的发病机制方面已经取得了巨大进展,但其发病机制仍不明了,还需要进一步研究。调节炎症的Klks是多用途酶,参与皮肤和肺部炎症,神经炎症和炎症性关节炎等疾病进展[6]。本研究旨在探究miR-326靶向Klk7通过MAPK信号通路对抑郁模型大鼠海马神经元细胞的影响,以期为抑郁症的治疗提供新的科学资料。
细胞凋亡是抑郁症发病机制中的关键介质[12]。近年来的研究表明,Klks在许多人类疾病中都存在着表达失调的现象,Klk7过表达导致人类黑素瘤细胞进一步恶化,发展为更恶性的表型,在黑色素瘤浸润中起着重要促进作用[13]。除此之外,Klk7的表达升高与胃癌细胞侵袭性增强有关[14]。Klk7在卵巢癌中过度表达,并且参与卵巢癌的发生发展[15]。目前,关于Klk7在退行性疾病中作用的研究较少。本研究结果显示,抑郁症大鼠海马神经元细胞凋亡率上调,通过检测Klk7表达显示,抑郁症大鼠海马中Klk7表达上调。该结果表明,Klk7可能在抑郁症大鼠中发挥重要作用。
miRNA参与各种各样的调节途径,包括发育、病毒防御、造血过程、器官形成、细胞增殖、细胞凋亡和脂肪代谢等[16]。有研究证明, miR-29-5p 通过靶向结合 KLK7来调控甲状腺乳头状癌细胞增殖,侵袭、迁移和凋亡[17]。miR-326过表达可增强阿尔茨海默症老鼠神经元细胞活力并抑制神经元凋亡[18]。本研究结果表明,miR-326靶向调控Klk7表达,miR-326在抑制抑郁症大鼠中低表达,过表达miR-326可通过抑制Klk7表达促进海马神经元细胞,抑制细胞凋亡。已有研究表明,在抑郁患者和抑郁样啮齿类动物模型中,MAPK信号通路表达异常[19]。MAPK信号通路参与海马神经元细胞凋亡的调控,抑制p38 MAPK信号通路可有效改善缺氧缺血性脑损伤新生大鼠的学习记忆能力和运动功能,减少海马组织神经元凋亡,从而促进神经元的恢复[20]。在抑郁症小鼠中,海马p-JNK和p-p38蛋白表达上调,MAPK途径被激活[21]。miR-326过表达可通过JNK信号通路增强神经元细胞活力并抑制神经元凋亡[18]。本研究结果显示,抑郁症大鼠海马神经元细胞miR-326表达显著下调,Klk7表达显著上调,MAPK信号通路被激活;miR-326通过靶向Klk7抑制MAPK信号通路活化。
综上所述,miR-326通过靶向Klk7抑制MAPK信号通路,促进CUMS大鼠海马神经元细胞增殖并抑制凋亡,抑制炎症因子的产生,从而发挥神经保护作用。miR-326是否通过靶向Klk7调控其它信号通路发挥对抑郁症大鼠的改善作用还有待进一步研究。
