草苁蓉多糖对脂多糖诱导的小鼠J774A.1巨噬细胞炎症反应的抑制作用
2021-07-05张天王园园张钊葛乃嘉尹学哲郑喜全吉淑
张天,王园园,张钊,葛乃嘉,尹学哲,郑喜*,全吉淑*
1(延边大学 医学院,吉林 延吉,133002)2(延边大学附属医院,吉林 延吉,133000)
草苁蓉属于寄生植物,寄生于桦本科上,生长条件极为苛刻,喜欢在阴湿的环境生长,在我国大兴安岭以及长白山等地区分布较多[1]。草苁蓉全草可入药,因其有抗衰老作用又称“不老草”,近些年来,越来越多的国内外学者开始重视草苁蓉有效成分及其药理作用研究[2]。其中草苁蓉多糖(Boschnikiarossicapolysaccharides,BRPS)是草苁蓉至关重要的活性成分[3],具有保护肝脏、抗氧化应激以及抗炎等作用[4-7]。
炎症是人体的正常免疫反应,属于正常防御反应之一,在通常情况下是对机体有益的;炎症又是疾病进展的重要因素之一,如不加以阻止就会引起自身免疫性疾病、癌症、心血管疾病及糖尿病等多种疾病,将严重威胁人类生命健康及安全[8-9]。脂多糖(lipopolysaccharide,LPS),目前是诱导机体产生炎症最常见的、危害最为严重的致炎因子[8-9]。因此,在本研究中利用LPS刺激小鼠J774A.1细胞建立巨噬细胞炎症模型,探讨草苁蓉多糖对巨噬细胞炎症反应的抑制作用及其机制,皆为在其抗炎方面的应用提供科学依据。
1 材料与方法
1.1 细胞株与材料
草苁蓉,中国长白山,常规方法提取含量为86.5% 的草苁蓉多糖[3, 10];小鼠J774A.1巨噬细胞,美国ATCC公司。
1.2 主要试剂
LPS,美国Sigma公司;环氧合酶-2(COX-2)抗体、Toll样受体4(TLR4)抗体、白介素-1受体相关激酶4(IRAK4)抗体、髓样分化因子88(MyD88)抗体、核转录因子-κB(NF-κB)抗体以及Lamin B1抗体,美国CST公司;β-action抗体,ABclonal公司;羊抗兔二抗、羊抗鼠二抗,中国纳川生物有限公司;IL-6、IL-1β、TNF-α酶联免疫吸附分析试剂盒,中国上海研瑾有限责任公司;核蛋白提取试剂盒,索莱宝有限公司;细胞增殖毒性试剂盒,中国北京庄盟科技公司。
1.3 主要仪器
RT-2100型酶标仪,美国Bio-Tek公司;UVP全自动凝胶成像仪,美国UVP公司;DYCZ-24DN电泳仪,北京市六一生物科技有限公司。
1.4 实验方法
1.4.1 细胞培养
将小鼠J774A.1巨噬细胞放置于含有10%(体积分数)胎牛血清的高糖DMEM培养液中,37 ℃、5% CO2条件下培养。
1.4.2 LPS诱导J774A.1巨噬细胞建立炎症模型
取对数生长期J774A.1细胞,以密度为5×104个/mL接种于96孔板中,待细胞贴壁后,换成含有0、100、200、500、1 000、2 000 μg/L LPS的培养液。每组设6个复孔。LPS作用24 h后,每孔加入10 μL CCK-8试剂,置于培养箱中作用2 h,用酶标仪测定492 nm处的吸光度值,计算细胞存活率,如公式(1)所示。收集细胞培养液,参照ELISA试剂盒说明书步骤,检测培养液中TNF-α、IL-6含量。

(1)
1.4.3 BRPS对J774A.1细胞的毒性作用
取对数生长期J774A.1细胞,以密度为5×104个/mL接种于96孔板中,待细胞贴壁后,换成含有0、12.5、25、50、100、200 mg/L BRPS的培养液。每组设6个复孔。BRPS作用24 h后,每孔加入10 μL CCK-8试剂,置于培养箱中作用2 h,测定492 nm处的吸光度值,并计算细胞存活率。
1.4.4 细胞分组及处理
J774A.1细胞随机分为正常组、模型组、BRPS低、中、高剂量组(又称BRPS25组、BRPS50组和BRPS100组,BRPS质量浓度分别为25、50和100 mg/L)[11]。正常组与模型组加入无血清DMEM培养液,培养24 h;BRPS组加入相应浓度BRPS的DMEM培养液,作用24 h。随后,除正常组换新的无血清培养液作用1 h 外,模型组与BRPS组均加入100 μg/L LPS,作用1 h。
1.4.5 BRPS对LPS诱导J774A.1细胞IL-6、TNF-α和IL-1β分泌的影响
收集各组细胞培养液上清,按照ELISA试剂盒说明书步骤,检测小鼠J774A.1细胞IL-6、TNF-α和IL-1β等炎症因子的分泌情况。
1.4.6 BRPS对LPS诱导J774A.1细胞炎症相关蛋白表达的影响
细胞分组以及处理同方法1.4.4,收集各组细胞,冰上裂解30 min,4 ℃、12 000 r/min离心20 min,小心吸取上清液收集细胞全蛋白。利用核蛋白提取试剂盒提取细胞核蛋白。进行SDS-PAGE电泳,随后转膜到PVDF膜上,5%(体积分数)的脱脂牛奶封闭1 h后,一抗4 ℃过夜,相应二抗25 ℃孵育2 h,ECL显色,并用UVP全自动化学成像仪分析相对灰度比值。
1.5 统计学分析处理

2 结果与分析
2.1 LPS诱导J774A.1巨噬细胞的炎症模型
如图1所示,不同浓度的LPS刺激对J774A.1细胞存活率无显著影响(P>0.05),但可显著提高J774A.1细胞培养液中IL-6和TNF-α的含量(P<0.05),提示巨噬细胞炎症模型成功。因此,本实验中J774A.1细胞炎症模型的构建均采用浓度为100 μg/L 的LPS处理J774A.1细胞1 h。

a-细胞存活率;b-IL-6;c-TNF-α图1 LPS诱导的J774A.1巨噬细胞炎症模型的构建Fig.1 Construction of LPS-induced J774A.1 macrophage inflammation model 注:与正常组比较,*P<0.05
2.2 BRPS对J774A.1细胞的毒性作用
如图2所示,BRPS浓度为0~100 mg/L时,J774A.1细胞存活率均在90%以上。因此,BRPS浓度小于100 mg/L时对J774A.1细胞没有毒性作用。在后续实验中,将25、50和100 mg/L分别选定为BRPS低、中、高剂量组的药物处理浓度。

图2 BRPS对J774A.1细胞的毒性作用Fig.2 Effect of BRPS on the viability of J774A.1 cells
2.3 BRPS对LPS诱导J774A.1细胞TNF-α、IL-6、IL-1β分泌的影响
如表1所示,与正常组比较,模型组细胞培养液中的TNF-α、IL-6和IL-1β水平显著增高(P<0.05);与模型组比较,BRPS组TNF-α、IL-6和IL-1β含量显著降低(P<0.05),说明BRPS对巨噬细胞炎症反应具有抑制作用。

表1 BRPS对LPS诱导J774A.1细胞炎症因子分泌的影响Table 1 Effects of BRPS on LPS-induced secretion of inflammatory factors in J774A.1 cells
2.4 BRPS对LPS诱导的J774A.1细胞COX-2蛋白表达水平的影响
如图3所示,与正常组比较,模型组COX-2蛋白表达水平显著升高(P<0.05),与模型组比较,BRPS中、高剂量组COX-2蛋白表达水平显著降低(P<0.05)。

图3 BRPS对J774A.1细胞COX-2蛋白表达的影响Fig.3 Effect of BRPS on protein expression of COX-2 in J774A.1 cells 注:与正常组比较,*P<0.05;与模型组比较,#P<0.05(下同)
2.5 BRPS对LPS诱导的J774A.1细胞TLR4蛋白表达水平的影响
如图4所示,与正常组比较,模型组TLR4蛋白表达水平显著增高(P<0.05)。与模型组比较,BRPS中、高剂量组的TLR4蛋白表达水平显著降低(P<0.05)。
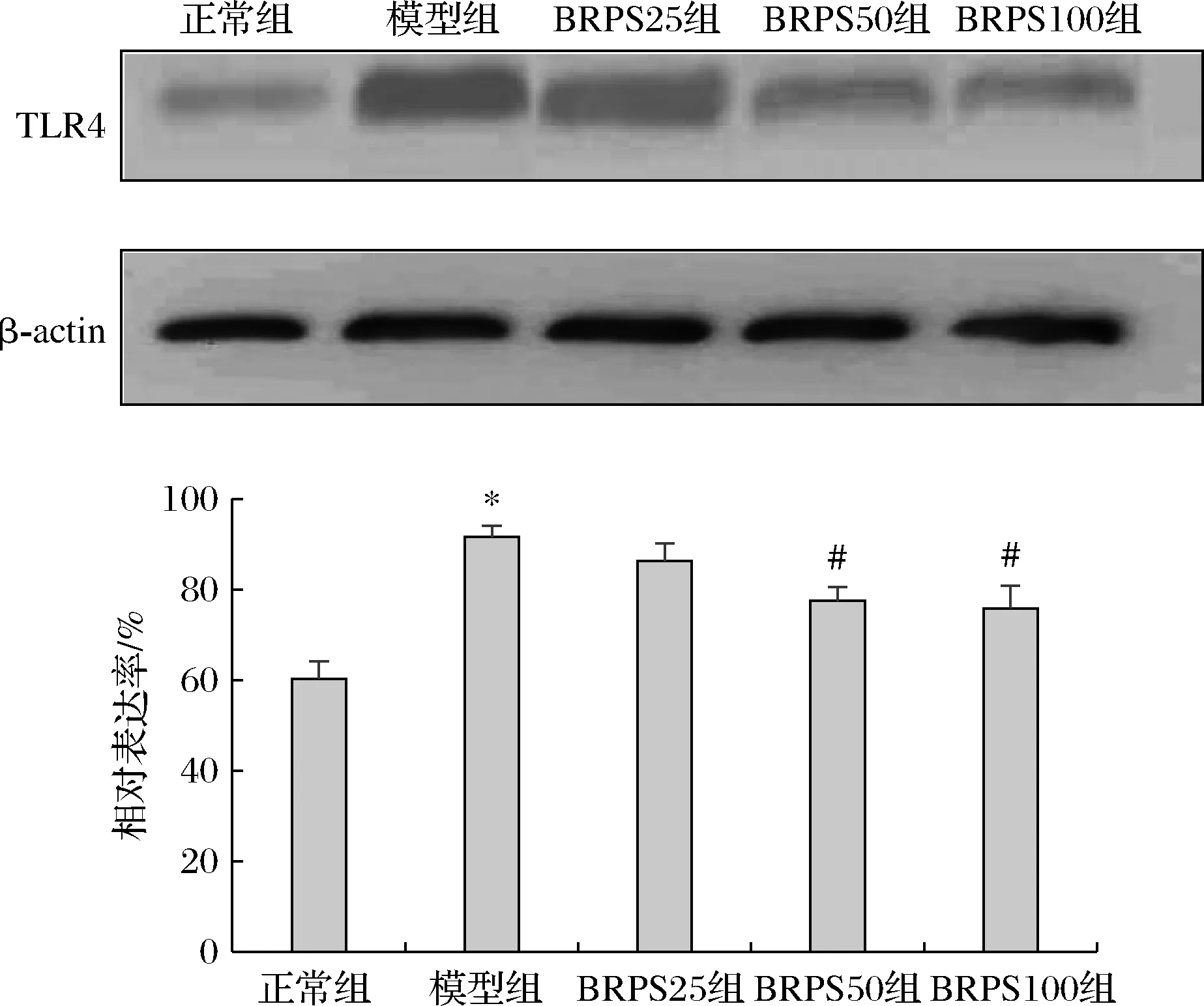
图4 BRPS对J774A.1细胞TLR4蛋白表达的影响Fig.4 Effect of BRPS on expression of TLR4 protein in J774A.1 cells
2.6 BRPS对LPS诱导的J774A.1细胞MyD88蛋白表达水平的影响
如图5所示,与正常组比较,模型组MyD88蛋白表达水平显著升高(P<0.05),与模型组比较,BRPS组MyD88蛋白表达水平显著降低(P<0.05)。

图5 BRPS对LPS诱导的J774A.1细胞MyD88蛋白 表达的影响Fig.5 Effect of BRPS on protein expression of MyD88 in LPS-stimulated J774A.1 cells
2.7 BRPS对LPS诱导的J774A.1细胞IRAK4蛋白表达水平的影响
如图6所示,与正常组比较,模型组IRAK4蛋白表达水平显著升高(P<0.05),与模型组比较,BRPS组IRAK4蛋白水平降低(P<0.05)。

图6 BRPS对LPS诱导的J774A.1细胞IRAK4 蛋白表达的影响Fig.6 Effect of BRPS on protein expression of IRAK4 in LPS-stimulated J774A.1 cells
2.8 BRPS对LPS诱导的J774A.1细胞核的NF-κB蛋白表达水平的影响
如图7所示,与正常比较,模型组细胞核中的NF-κB蛋白表达水平显著升高(P<0.05),与模型组比较,BRPS中、高剂量组的细胞核NF-κB蛋白水平明显降低(P<0.05)。

图7 BRPS对LPS诱导的J774A.1细胞核NF-κB 蛋白表达的影响Fig.7 Effect of BRPS on protein expression of nuclear NF-κB in LPS-stimulated J774A.1 cells
3 讨论
炎症反应属于人体正常防御反应,在机体受到损伤时起到保护性作用,巨噬细胞恢复正常表型通常是成功解决或修复组织损伤的表现之一[12-13]。LPS是革兰氏阴性菌外膜的主要成分,可作为毒性因子起作用,因此常被用于炎症模型的研究[14-17]。巨噬细胞作为促炎因子的主要来源,在炎症疾病中起着至关重要的作用。本实验以LPS为诱导剂,小鼠J774A.1巨噬细胞作为研究对象,建立J774A.1巨噬细胞炎症模型,研究BRPS对小鼠J774A.1细胞炎症反应的抑制作用及其机制。
LPS刺激巨噬细胞后产生和分泌大量炎症因子,其中IL-1、TNF-α和IL-6在炎症反应中发挥着重要作用。IL-1是对各种炎症和感染性刺激反应所产生的炎症因子,可分为IL-1α和IL-1β 2种,其中IL-1β是启动和维持局部及全身炎症反应的一种重要炎症因子,主要通过IL-6和C反应蛋白发挥作用[18-19]。当炎症发生时,IL-6迅速被刺激和表达,这有助于防御机体感染;而C反应蛋白作为炎症生物标志物,其合成主要受IL-6控制[20]。TNF-α是机体内主要的炎症细胞因子之一,被认为是炎症反应的关键参与者[21]。本实验中,用100 μg/L LPS处理J774A.1细胞1 h,可显著增高细胞培养液中TNF-α、IL-6水平,提示J774A.1细胞炎症模型已成功构建;而BRPS组IL-1β、IL-6和TNF-α水平较模型组显著降低,表明BRPS对巨噬细胞炎症反应具有抑制作用。
TLR4蛋白位于细胞膜上,主要表达在免疫细胞,如巨噬细胞、单核细胞等,当LPS与TLR4结合后,通过MyD88募集IRAK1/4,随后触发信号传导级联反应,导致NF-κB发生活化,调控其他炎症因子如IL-6和TNF-α的合成,诱导COX-2蛋白;而COX-2是前列腺素生物合成的关键酶,可通过多种促炎因子被诱导[15, 22-26]。课题组前期研究显示,小鼠炎性肝损伤模型中BRPS可通过TLR4/NF-κB信号通路对肝细胞炎症反应起到抑制作用,从而起到肝保护作用[27]。本实验结果显示,与正常组比较,模型组小鼠J774A.1细胞COX-2、TLR4、IRAK4、MyD88及细胞核NF-κB蛋白表达水平升高;与模型组比较,BRPS组COX-2、TLR4、IRAK4、MyD88以及细胞核NF-κB蛋白水平显著降低,提示BRPS的抗炎作用可能与其抑制TLR4/NF-κB信号通路有关,这与前人的实验结果相一致[27]。TLR4信号通路还可通过TAK1蛋白,激活与炎症反应相关的MAPK通路,其中JNK和p38通路与炎症关系最为密切[28-29]。因此,研究BRPS如何通过MAPK通路调节小鼠J774A.1细胞炎症反应将是本课题组下一步的研究方向之一。
综上所述,BRPS能够有效抑制LPS诱导的J774A.1细胞炎症反应,其抗炎作用可能与其抑制TLR4/NF-κB信号通路有关。BRPS具有较强的抗炎作用,且水溶性好、无毒副作用,这些优点有利于对草苁蓉多糖的开发和利用。
