他达拉非自乳化片的制备与体外溶出研究
2021-07-05祁静波
祁静波,王 敏,谢 鹏
(1.唐山市协和医院药剂科,唐山 063000;2.唐山职业技术学院,唐山 063000)
他达拉非(TDF)是一种选择性磷酸二酯酶抑制剂,临床主治勃起功能障碍和良性前列腺增生[1-2]。TDF属于生物药剂学分类系统(BCS)Ⅱ类药物,溶解性极差(在水中溶解度约为2 μg·mL-1),口服生物利用度低[3-5]。自乳化释药系统(SMEDDS)是由药物、油相、乳化剂和自乳化剂组成的均一、透明、各相同性的热力学稳定体系[6-7],进入体内在胃肠道蠕动下即可自发形成纳米级水包油(O/W)型微乳状液,可显著提高药物的溶解度及溶出速度,进而有望提高药物的口服生物利用度[8-10]。已有研究表明,将液态SMEDDS转化为固体剂型能够降低生产成本,易于储存,增加制剂的稳定性,同时患者方便携带和使用,也改善了用药依从性[11-12]。因此,本研究将TDF开发成自乳化片(TDF-SMEDDS-FDTs),为提高TDF的临床疗效提供一种有效的解决方案。
1 仪器与试药
1.1仪器 90-2型恒温定时磁力搅拌器(上海精科实业有限公司);ELSZ-2000型纳米粒度/Zeta电位仪(大塚电子苏州有限公司);TD5G型台式过滤离心机(长沙湘锐离心机有限公司);JEM-2100F型透射电镜(日本电子株式会社);KYKY-EM8100型扫描电子显微镜(北京中科科仪股份有限公司);RT600型溶出度仪(深圳市锐拓仪器设备有限公司);DPL-1型沸腾干燥制粒包衣机(重庆精工制药机械有限责任公司);GYROMAX939型轨道式和往复式水浴摇床(世联博研北京科技有限公司);DP30A型单冲压片机(北京国药龙立科技有限公司)。
1.2试药 他达拉非原料药(TDF,天方药业有限公司,批号TF190118);油酸乙酯(Ethyl oleate,江西益普生药业有限公司);蓖麻油(Castor oil,江西阿尔法高科药业有限公司);葵花籽油(Sunflower oil,上海瑞楚生物科技有限公司);丙二醇二癸酸酯(Labrafac PG,上海鼎运化工贸易有限公司);辛酸癸酸聚乙二醇甘油酯(Labrasol,湖北广奥生物科技有限公司);聚氧乙烯去水山梨醇单月桂酸酯(Tween 80,南京威尔药业股份有限公司);聚乙二醇-15羟基硬脂酸酯(Solutol HS 15)和聚氧乙烯蓖麻油(Cremophor EL),均购自巴斯夫应用化工有限公司;丙二醇单辛酸酯(Capryol 90)和单辛酸甘油酯(Capmul MCM C8),均购自嘉法狮上海贸易有限公司;辛酸/癸酸甘油酯(Akoline MCM,北京华迈科生物技术有限责任公司);聚乙二醇600(PEG600)和聚乙二醇400(PEG400),均购自广东光华化学厂有限公司;硅酸镁铝(罗辅医药科技上海有限公司);聚乙烯吡咯烷酮K30(PVP K30,巴斯夫新材料有限公司);微晶纤维素(山东聊城阿华制药股份有限公司);交联羧甲基纤维素钠(明台化工股份有限公司);磷钨酸钠(上海阿拉丁生化科技股份有限公司);十二烷基硫酸钠(安徽山河药用辅料股份有限公司);0.45 μm聚偏四氟乙烯膜(杭州科百特过滤器材有限公司);硬脂酸镁(安徽山河药用辅料股份有限公司)。
2 方法与结果
2.1平衡溶解度测定 通过测定TDF在不同油相、乳化剂和助乳化剂中的溶解度,确定TDF自乳化释药系统(TDF-SMEDDS)的处方组成。辅料类型见表1。按照表1中所列的辅料类型,每种辅料各取2 g,置于离心管中,再加入足量的TDF原料药,加盖密封后涡旋混合5 min,置于37 ℃水浴中以150 r·min-1持续振摇72 h。药物溶解达到平衡后,将离心管置于离心机中,以5 000 r·min-1离心10 min,上清液用0.45 μm聚偏四氟乙烯膜过滤,取适量续滤液加入甲醇溶解并稀释,通过HPLC法[13]测定药物含量,计算TDF在不同辅料中的平衡溶解度,每份样品重复测定3次。见表1。
选择对TDF具有较高溶解度的辅料可以提高SMEDDS的载药量,减少辅料的用量。由表1可知,在所筛选的油相中Capryol 90对TDF的溶解性最好,乳化剂中Labrasol对TDF的溶解能力最大,助乳化剂中PEG600对TDF具有较大的溶解度,因此本研究选择Capryol 90作为TDF-SMEDDS的油相,Labrasol作为乳化剂,PEG600作为助乳化剂,用于进一步实验研究。

表1 他达拉非在不同辅料中的平衡溶解度
2.2伪三元相图的绘制 使用水滴定法绘制由油相(O)、乳化剂与助乳化剂混合物(Smix)和水相(W)构成的伪三元相图[14]。将乳化剂Labrasol与助乳化剂PEG600分别按照质量比(Km)为1∶2、1∶1、2∶1配制成混合物,然后与油相Capryol 90按照质量比为1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1混匀,在50 r·min-1磁力搅拌速度下滴加水相,直到形成澄清透明的微乳,记录加水量,继续滴加,当微乳又重新出现浑浊时,再次记录加水量,计算形成微乳及变浑浊时各组分的质量分数,使用Origin 8.0软件绘制伪三元相图,以形成的微乳区域面积作为评价指标,确定TDF-SMEDDS的处方用量,结果见图1。
由图1可以评估油相、乳化剂与助乳化剂的组合物的自乳化能力。深色区域为加水后自发形成微乳,浅色区域为加水后不能形成微乳,当乳化剂与助乳化剂混合物比例从1∶2增加到2∶1时形成微乳的区域逐渐增大,这是由于乳化剂占比增大,乳化能力增强,形成的微乳粒径更小,稳定性越好,因此确定处方中乳化剂与助乳化剂的质量比为2∶1;另外,处方中乳化剂用量过大会对胃肠道造成不良反应,用量越小对人体越安全[15],因此最终根据图1确定TDF-SMEDDS的处方组成为:Capryol 90作为油相,Labrasol作为乳化剂,PEG600作为助乳化剂,最佳配比为0.7∶0.2∶0.1。
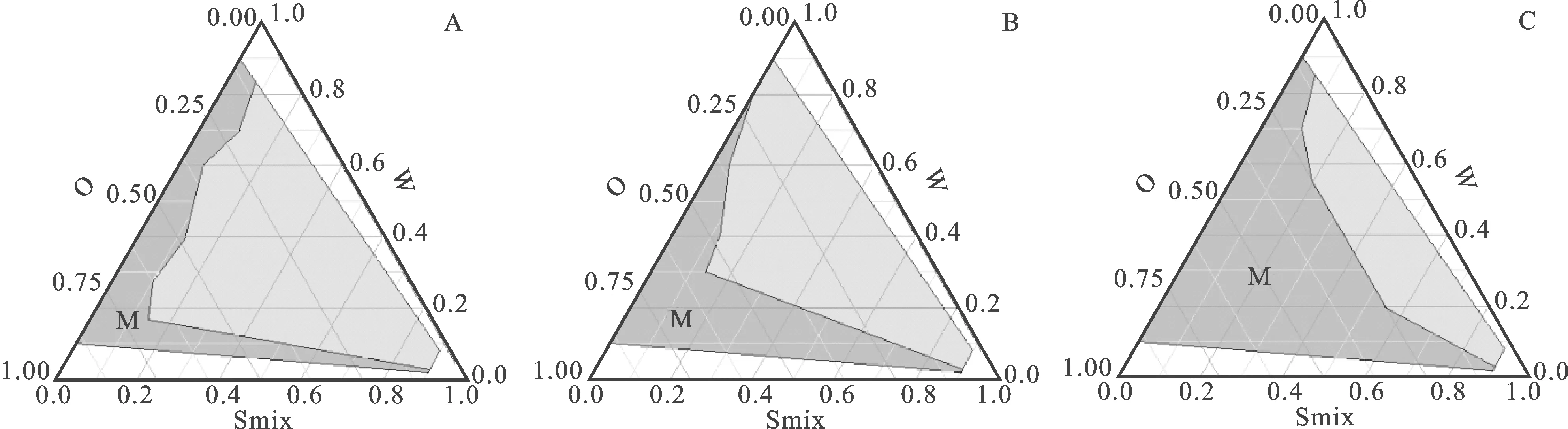
图1 油相(O)、乳化剂与助乳化剂混合物(Smix)和水相(W)构成的伪三元相图
2.3TDF-SMEDDS的制备及固化 按照2.2项下筛选的TDF-SMEDDS最优处方,分别称取Capryol 90 35.0 g、Labrasol 10.0 g和 PEG600 5.0 g,置于烧杯中,搅拌混合,形成透明状油性溶液;称取TDF 4.0 g,置于烧杯中,搅拌混合至药物完全溶解,得到澄清透明状TDF-SMEDDS。取制备好的TDF-SMEDDS加入纯化水250 mL,搅拌形成微乳,再加入PVP K30 25 g搅拌至完全溶解,备用。
通过流化床制粒工艺固化TDF-SMEDDS[16],取硅酸镁铝200 g,置于流化床锅中,安装0.8 mm喷雾针头,进风温度设置为45 ℃,启动机器,调节进风速度,使锅中颗粒处于完全流化状态,并开启连续抖袋,防止颗粒吸附到滤袋表面,待物料温度达到33~35 ℃时进行喷液,雾化压力设置为2 mbar,喷液速度为5~10 g·min-1,在实验过程中根据颗粒流化状态适时调整喷液速度,防止塌锅。喷液结束后,颗粒继续流化干燥,得TDF-SMEDDS颗粒,收集全部颗粒,称质量,密封保存。
2.4TDF-SMEDDS-FDTs的制备 采用粉末直接混合压片工艺制备TDF-SMEDDS-FDTs。将TDF-SMEDDS颗粒过20目筛网整粒,按照处方用量称取原辅料,等量递加混匀,转移至单冲压片机中压片,冲模为11.0 mm圆形平冲,理论片质量为450 mg,目标硬度为150~200 N。见表2。
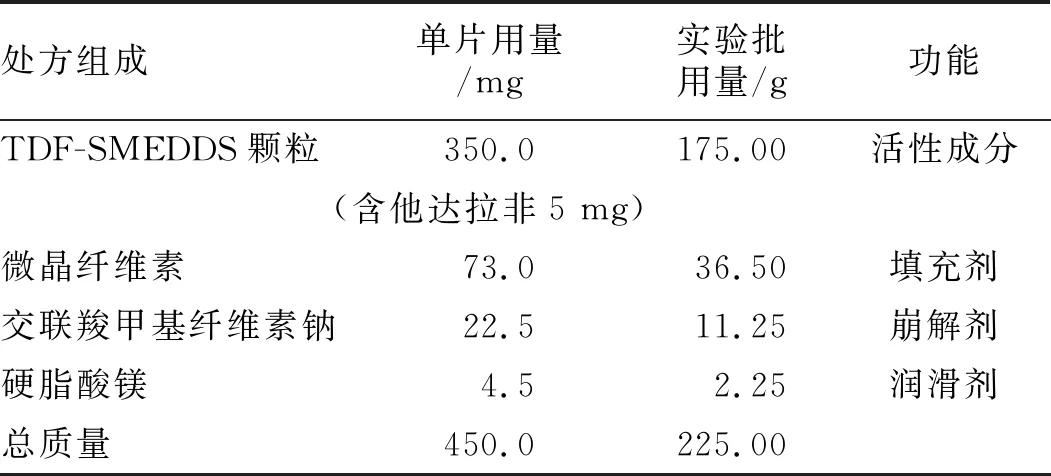
表2 TDF-SMEDDS-FDTs的处方组成
2.5制剂性质表征
2.5.1粒径分布、Zeta电位测定 取少量TDF-SMEDDS,加入适量蒸馏水,轻轻振摇,分散形成微乳;另取一片TDF-SMEDDS-FDTs,加入适量蒸馏水,轻轻振摇,片剂完全崩散,离心10 min,上层为微乳液。依次取2份微乳液,采用纳米粒度/Zeta电位仪测定微乳的粒径分布及Zeta电位,每份样品测定3次,取平均值,结果见表3。

表3 制剂性质检测结果
TDF-SMEDDS加水形成微乳的粒径较小,外观呈透明状淡蓝色溶液,经测定粒径为(57.2±4.2)nm,但TDF-SMEDDS固化成颗粒后重新分散形成的微乳粒径增大至(69.8±3.6) nm,这可能是由于流化床制粒工艺或者处方中加入PVP K30导致微乳粒径增大;而将TDF-SMEDDS颗粒压制成片剂后重新分散形成的微乳液粒径分布与TDF-SMEDDS颗粒相近,说明压缩过程不改变形成微乳的能力。
2.5.2透射电镜观察 取少量TDF-SMEDDS,加入适量蒸馏水,轻轻振摇,分散形成微乳;另取一片TDF-SMEDDS-FDTs,加入适量蒸馏水,轻轻振摇,片剂完全崩散,离心10 min,上层为微乳液。分别取2份微乳液少量,加入蒸馏水稀释,取稀释液均匀铺展到碳覆铜网上,加1滴质量浓度为50 mg·mL-1的磷钨酸钠溶液,负染10 min,挥干水分,在透射电镜下观察2种微乳的微观形态。见图2。
由图2可知,TDF-SMEDDS 形成微乳的粒径大约为50 nm(图2A),而TDF-SMEDDS-FDTs形成的微乳粒径稍大(图2B),这与粒度测定仪测定的结果相似;2种微乳均呈球形或类球形分布,无黏连,也未观察到药物晶体析出。

图2 TDF-SMEDDS(A)和TDF-SMEDDS-FDTs(B)形成的微乳透射电镜照片
2.5.3扫描电镜观察 取TDF-SMEDDS颗粒固定到电胶布上,喷金,在扫描电镜下观察其微观形态。见图3。

图3 TDF-SMEDDS颗粒的扫描电镜照片
由图3可知,TDF-SMEDDS形成的微乳黏附在载体颗粒表面,这是由于微乳溶液与黏合剂被喷散在酸镁铝载体颗粒表面后,水分从颗粒表面迅速蒸发,微乳被固定到颗粒表面,能够保留微乳的特性。
2.6溶出度比较 比较TDF-SMEDDS-FDTs与他达拉非片的体外药物溶出速率,选用《中国药典》2015年版四部0931项下第Ⅱ法(桨法),溶出介质为含有3 mg·mL-1十二烷基硫酸钠的水溶液,体积为900 mL,桨转速为50 r·min-1,取TDF-SMEDDS-FDTs与他达拉非片,置于溶出杯中,在设定的时间点取出溶出介质5 mL(同时补液),过滤,稀释,检测药物含量,绘制药物累积溶出度-时间曲线。见图4。
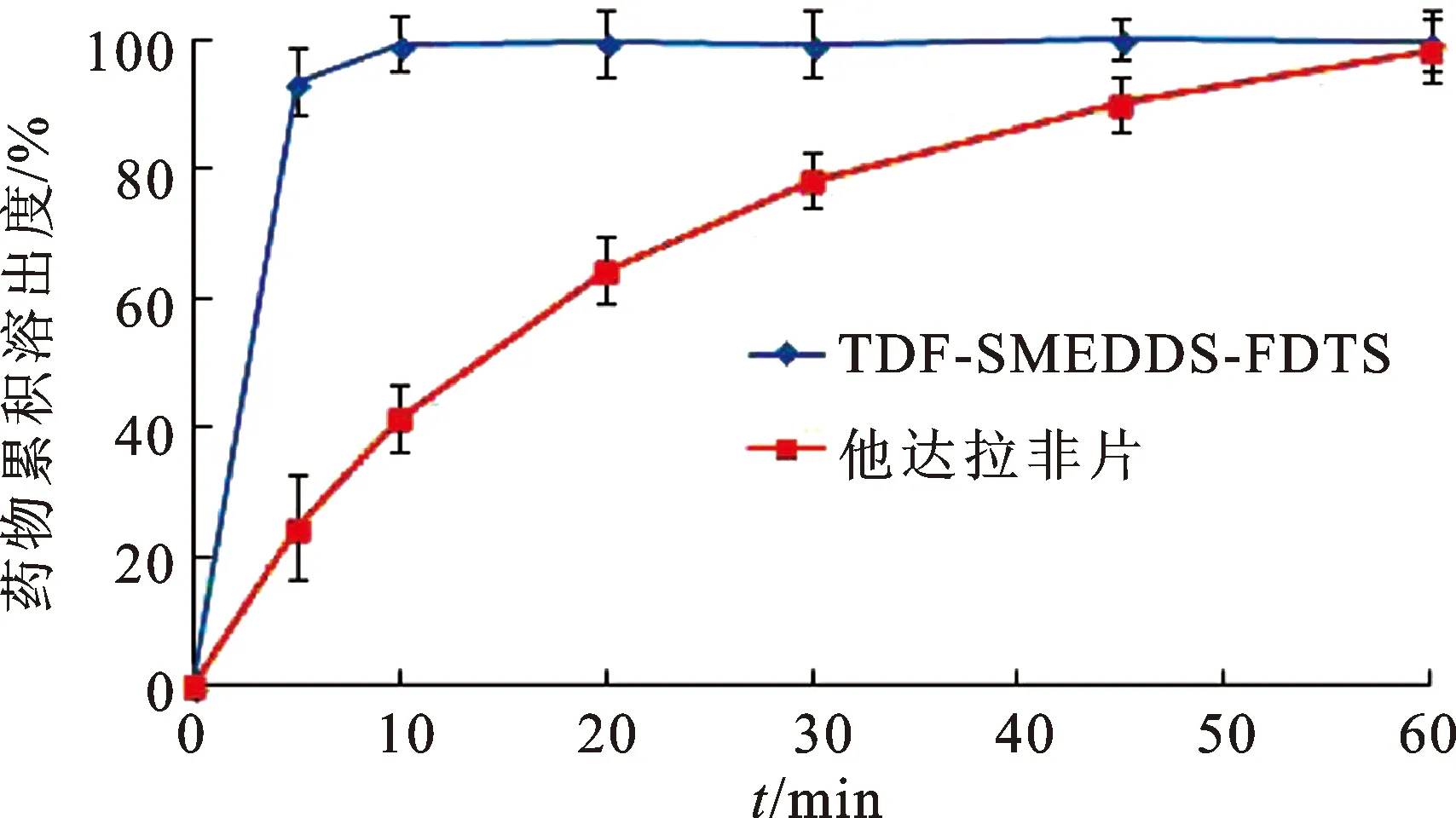
图4 TDF-SMEDDS-FDTs与他达拉非片的体外溶出曲线
TDF-SMEDDS-FDTs在溶出杯中迅速崩解,在5 min药物溶出度已超过90%,10 min时药物已完全溶出,药物能够达到快速溶出的目的;而他达拉非片虽然也能快速崩解,但是其溶出速度相对较缓慢,在5 min药物溶出不足30%,60 min时药物才能溶出完全。由图4可知,将TDF制备成TDF-SMEDDS-FDTs后药物溶出速率显著提高,有望提高药物的吸收速度与程度,增加药物口服生物利用度。
2.7稳定性考察 取TDF-SMEDDS-FDTs,置于高密度聚乙烯瓶中,封口,置于加速实验箱中(40 ℃,相对湿度为75%)考察其稳定性,分别在1、2、3、6个月取样检测外观、硬度、崩解时限和10 min溶出度,结果见表4。由表4可知,TDF-SMEDDS-FDTs放置在加速条件下6个月内,其外观、硬度、崩解时限以及10 min药物溶出度均未发生显著变化,说明稳定性较好。

表4 稳定性实验结果
3 讨论
诸多文献报道[17],SMEDDS能够增加难溶性药物的溶解度,提高药物口服生物利用度。但SMEDDS为液体,需要包装到软胶囊中使用,软胶囊生产工艺复杂,且内容物易与明胶囊壳发生作用,导致囊壳破裂,药物稳定性较差[18]。为了克服上述缺点,可以将SMEDDS转化为固体制剂,目前将SMEDDS转化为固体的技术包括吸附、喷雾干燥、挤出滚圆、湿法制粒和流化床制粒等[19]。研究报道,SMEDDS经固化后不改变其本身具有的自乳化性质,因此本研究采用流化床制粒固化TDF-SMEDDS,制备成颗粒,并与其他外加辅料混合最终制备成片剂。
硅酸镁铝是一种白色无定形固体颗粒,粒径为60~120 μm,密度为0.13~0.18 g·cm-3,拥有足够大的孔隙率及比表面积,能够吸附大量液体,特别是对油性物质的吸附性极强,可长时间保持稳定性和流动性,同时保证最终制备的片剂具备合适的硬度,因此硅酸镁铝成为SMEDDS最常用的固化载体材料[20],本研究经流化床制粒工艺将TDF-SMEDDS制备成固体颗粒,通过电镜照片可观察到颗粒中存在一些空隙,增加了比表面积,与水接触后有利于快速自乳化。
