顶空进样气相色谱内标法测定注射用头孢哌酮钠舒巴坦钠的残留溶剂
2021-07-05李玥琦张国林邢以文顾晓风
李玥琦,张国林,邢以文,顾晓风
(苏州市药品检验检测研究中心,苏州 215104)
注射用头孢哌酮钠舒巴坦钠由头孢哌酮钠和舒巴坦钠原料药直接混合制得,广泛应用于治疗由敏感菌引起的多种感染性疾病。《中国药典》2015年版二部[1]仅对头孢哌酮钠原料药进行了残留溶剂控制,对舒巴坦钠原料药和两者混合而得的制剂均无残留溶剂要求,其他现行国家标准[2-5]也均未控制该制剂中的残留溶剂。一方面,舒巴坦钠的成盐或溶析结晶过程中可能使用乙醇[6-7]、异丙醇[8-9]、乙酸乙酯[10-11]和正丁醇[10,12]等有机溶剂,由此引入的残留溶剂种类和含量均未见明确报道[13-14]。另一方面,《中国药典》2015年版规定头孢哌酮钠中丙酮残留量不得超过2.0%,据此限度推算,头孢哌酮钠舒巴坦钠制剂中可能存在接近1.0%的丙酮残留,超过《中国药典》2015年版四部项下通则[15]和国际人用药品注册技术协调会(ICH)中0.5%的限度,可能存在安全风险。
本研究以戴寿沣等[16]建立的顶空进样气相色谱内标法为基础,参考《中国药典》2015年版四部残留溶剂测定法[15],使用N,N-二甲基甲酰胺(DMF)为溶剂改善待测物的溶解性,以2-丁酮为内标物建立标准曲线,用于测定不同生产企业的注射用头孢哌酮钠舒巴坦钠(1∶1)中的14种残留溶剂,并与既往结果进行比较。
1 仪器和试药
1.1仪器 7890B型气相色谱仪,7697A型顶空进样器和OpenLab CDS 2.2型色谱数据系统,均购自安捷伦科技有限公司;氢气发生器,空气泵,均购自苏州市莱顿科学仪器有限公司;XPE205型电子天平(瑞士梅特勒-托利多仪器有限公司)。
1.2试剂N,N-二甲基甲酰胺(DMF,气相色谱级,体积分数为99.99%),德国默克集团;2-丁酮、丙酮、乙醇、异丙醇、正丙醇、正丁醇、甲基异丁基酮、二氯甲烷和乙醚(分析纯,体积分数均大于99.0%),均购自国药集团化学试剂有限公司;甲醇和乙腈(色谱纯,体积分数为99.99%),购自霍尼韦尔国际公司;乙酸乙酯、环己烷、四氢呋喃、正己烷(色谱纯,体积分数大于99.9%),均购自赛默飞世尔科技有限公司。
1.3样品 注射用头孢哌酮钠舒巴坦钠为2020年国家药品抽检品种,涉及6个规格,来自编号为M01~M43的43家生产企业。除去处方比例为2∶1的样品,并剔除同一生产企业、相同生产批号的重复样品后,累计处方比例为1∶1的数量共183批,样品编号为YP0001~YP0344的非连续编号。回收率考察使用编号为YP0328的样品,生产企业编号为M39,生产批号为02200301。
2 方法与结果
2.1色谱条件 使用Agilent DB-624(30 m×0.53 mm,3.0 μm)毛细管气相色谱柱;载气为氮气(体积分数为99.999%);流速为3.0 mL·min-1。程序升温:起始温度为35 ℃,维持5 min后以1 ℃·min-1升至40 ℃,维持2 min,以10 ℃·min-1升至60 ℃,维持5 min,以60 ℃·min-1升至180 ℃,维持4 min。顶空平衡温度为70 ℃,平衡时间为30 min,进样时间为1 min,进样口温度为230 ℃,分流比为20∶1,火焰离子化检测器温度为250 ℃。
2.2溶液的配制
2.2.1系列混合对照品溶液 精密量取2-丁酮1 mL,置于500 mL量瓶中,用DMF溶解并稀释至刻度,摇匀制成内标溶液。分别精密称取丙酮、乙醇、异丙醇、正丙醇、正丁醇、乙酸乙酯、甲基异丁基酮、甲醇、环己烷、四氢呋喃、二氯甲烷、乙腈、正己烷和乙醚251.33、126.98、64.53、64.08、66.55、56.30、62.75、38.43、54.89、41.60、44.98、33.50、39.55、66.33 mg,置于预装有内标溶液的100 mL量瓶中,稀释至刻度,作为混合对照品溶液1,再用内标溶液分别稀释1.25、2.5、5、25、100倍,作为混合对照品溶液2~6。
2.2.2供试品溶液 精密称取1.0 g头孢哌酮钠舒巴坦钠,置于20 mL顶空进样瓶中,精密加入2.2.1项下制备的内标溶液5 mL,超声使溶解,密封,即得。
2.3系统适用性和重复性实验 取2.2.1项下制备的内标溶液、混合对照品溶液2和1.2项下16种试剂分别进样。混合对照品溶液中各待测物的理论塔板数峰面积值均不低于5 000,内标物2-丁酮和溶剂DMF对14种待测物质均无干扰,见图1。由图1可知,相邻色谱峰之间达到基线分离,分离度均大于1.5。取混合对照品溶液2,连续进样6次,各待测物峰面积与内标物峰面积之比(f)的RSD值在0.47%~3.41%范围内。
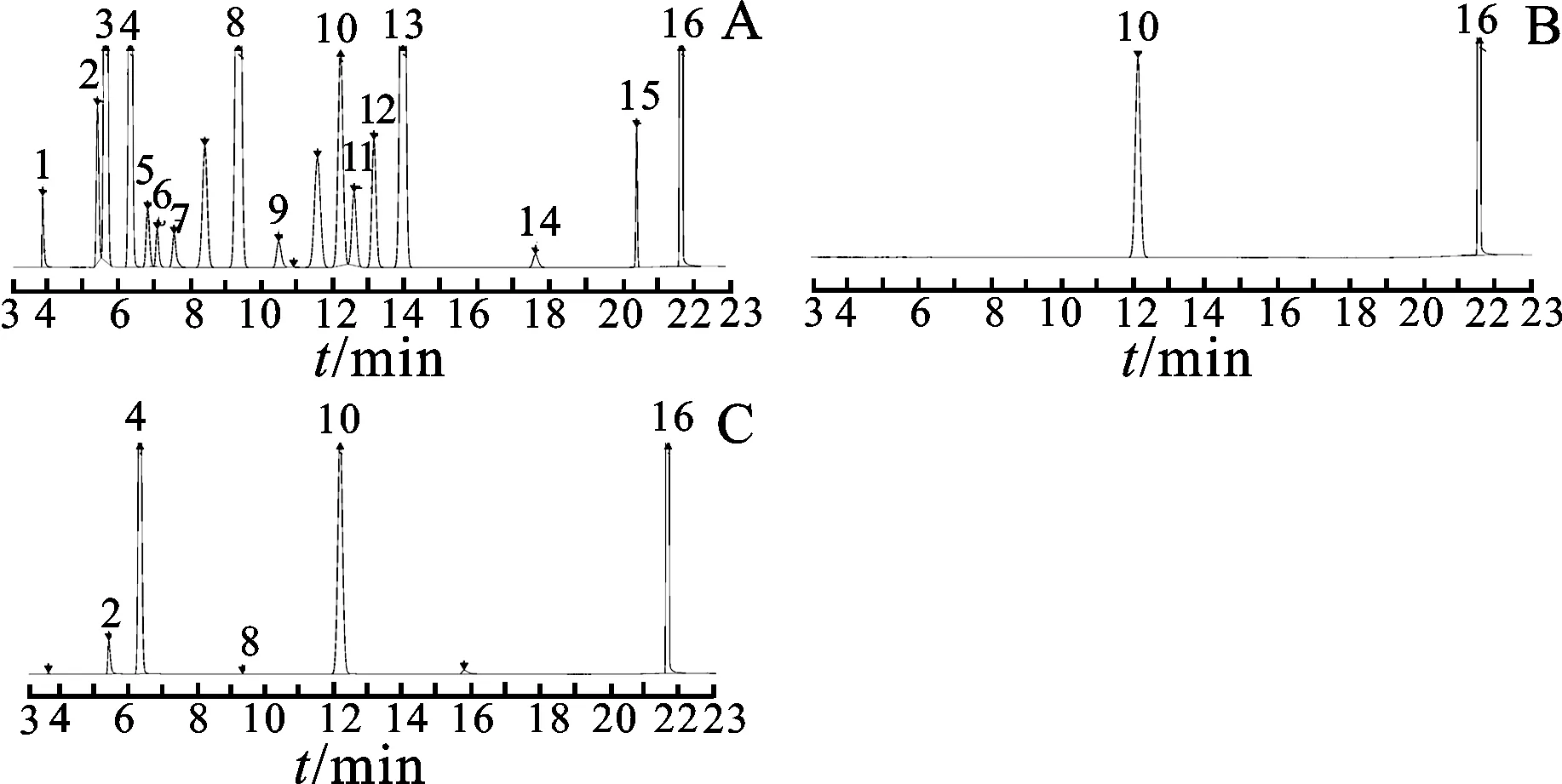
图1 GC图
2.4线性范围和定量限 取2.2.1项下制备的系列混合对照品溶液,按照2.1项下色谱条件进样测定。取混合对照品溶液6,用内标溶液分别稀释2~50倍,计算信噪比。以待测物与内标物峰面积之比为纵坐标(y)、待测物质量浓度为横坐标(x)进行线性回归,见表1。
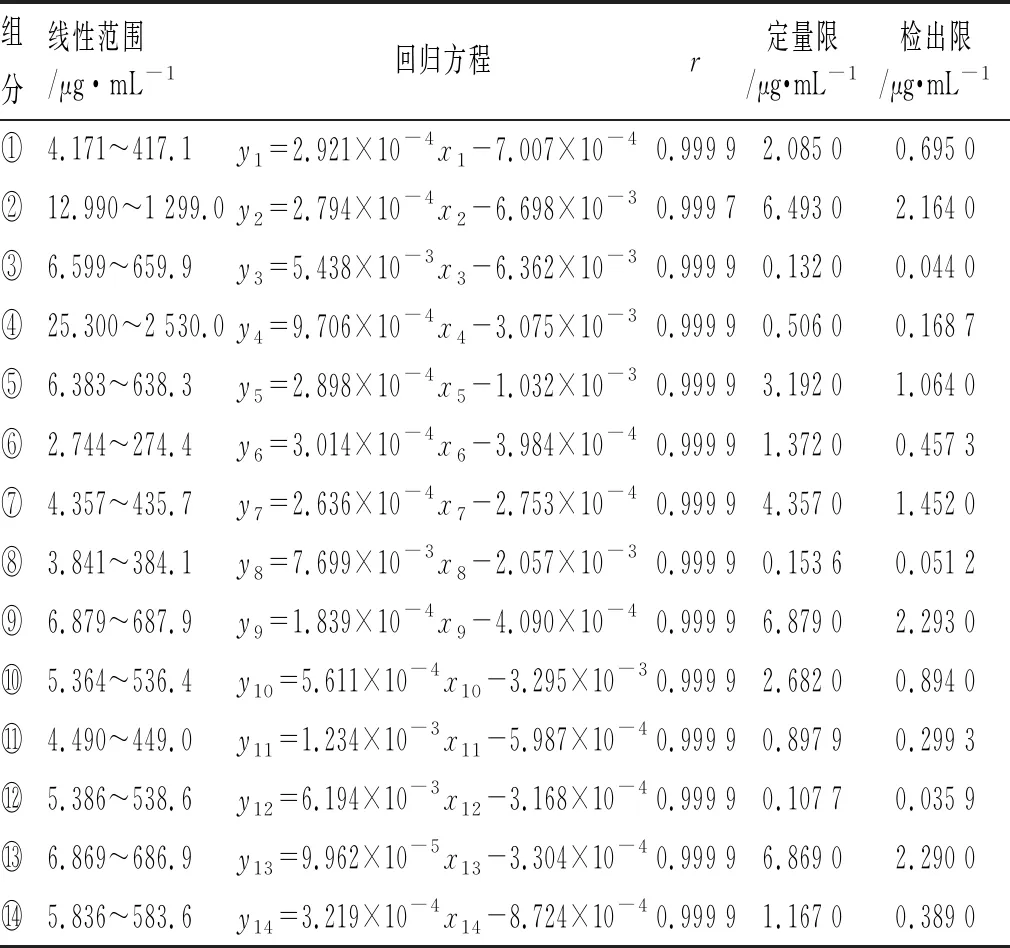
表1 线性回归方程
2.5回收率实验 精密称取12份样品(使用编号YP0328),每份1.0 g;其中3份加5 mL内标溶液作为本底;3份加入5 mL混合对照品溶液2作为高浓度回收率样品;3份加入5 mL混合对照品溶液3作为中浓度回收率样品;3份加入5 mL混合对照品溶液4作为低浓度回收率样品。计算得平均回收率在82.58%~105.46%范围内,结果见表2。
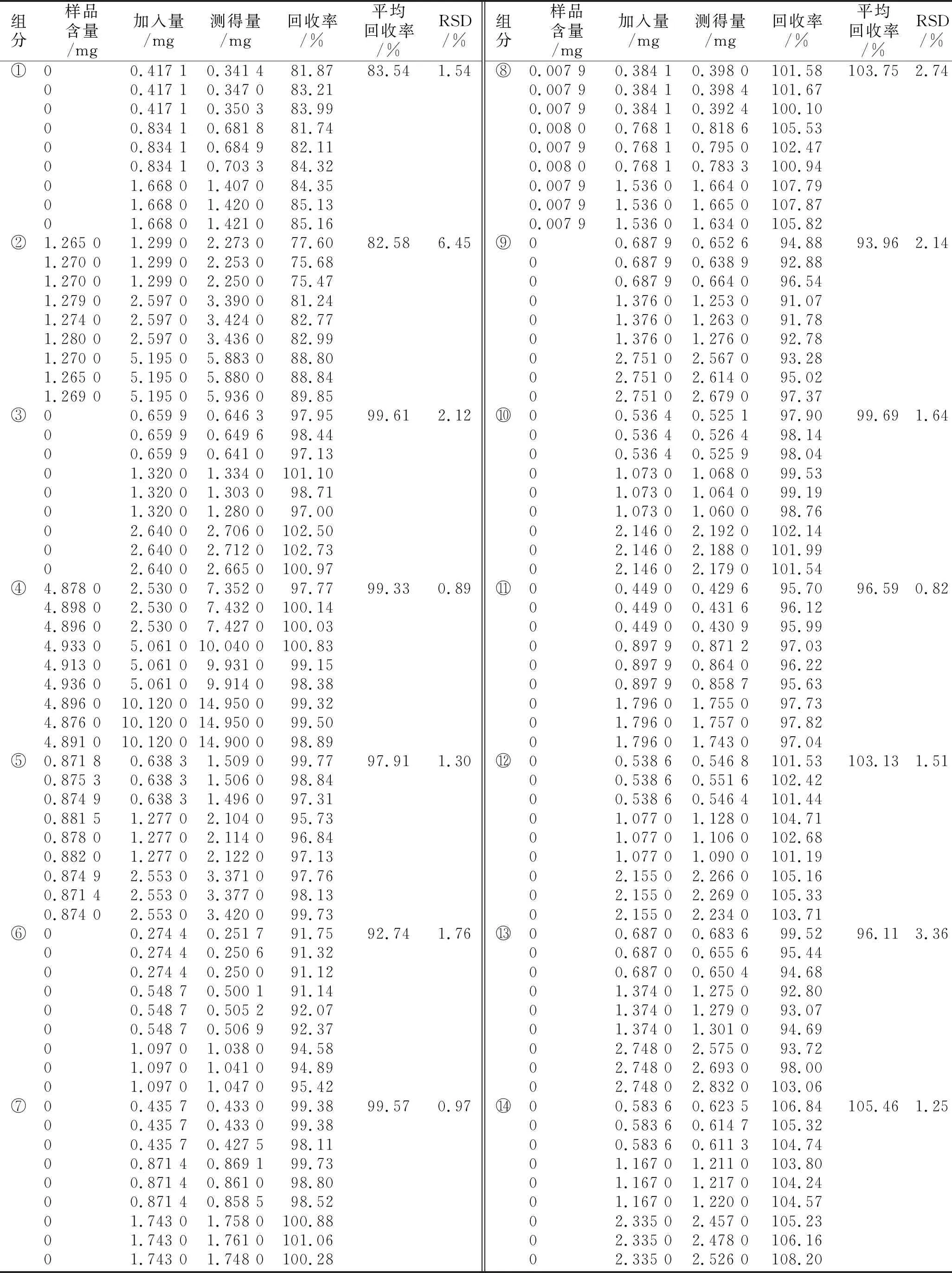
表2 回收率实验结果 (n=9)
2.6样品测定结果 183批次样品均检出有丙酮残留,且90.2%的样品丙酮残留量在0.5%以上,平均残留量为0.67%±0.01%(95%置信区间:0.65%~0.69%)。上述残留量与戴寿沣等[16]发表结果一致,但生产企业之间的差异明显缩小,本次实验未见丙酮含量在0.9%以上或0.2%以下的样品。除生产企业M16以外,所有样品均检出了乙醇,残留量在0.03%~0.25%之间,均在0.5%的限度内;近半数样品中检出有异丙醇,平均残留量接近0.1%;多数样品中检出有正己烷,但平均残留量<0.001%;少数样品中检出了二氯甲烷、乙酸乙酯、环己烷和正丁醇,残留量接近检出限;所有样品中均未检出甲醇、乙醚、乙腈、正丙醇、四氢呋喃和甲基异丁基酮。对检出的残留量进行加和,计为总残留量,结果见表3。
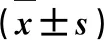
表3 样品测定结果
3 分析与讨论
3.1残留溶剂种类分析 本次纳入残留溶剂检查的183批样品中,丙酮、乙醇、正己烷和异丙醇的检出率分别为100.0%、95.6%、67.2%、44.8%;少量样品(<5%)检出二氯甲烷、乙酸乙酯、环己烷和正丁醇;另有40批(21.9%)样品在保留时间15.8 min检出未知物质(图1 C),有待进一步实验分析和确证。
多数企业检出的残留溶剂种类为2~4种,检出种类及含量较为一致,仅有3批样品检出了6种及以上的溶剂残留。回溯生产工艺,70%以上的生产企业直接购买混粉原料药后进行无菌分装,且原料药来源于3家混粉生产企业。生产企业M15、M16和M22检出残留溶剂的种类和总量均偏低,且不同批次产品之间一致性较好,均是自行混合2种原料药后分装的工艺,可能与原料药生产企业特有的生产工艺有关[17]。
3.2溶剂的选择 头孢哌酮钠和舒巴坦钠均易溶于水,既往研究[16,18]在溶解供试品时通常选择水为溶剂。本研究在进行方法验证时,发现以水、二甲基亚砜或水-二甲基亚砜(50∶50)作为溶剂时,正己烷和环己烷均不能在标准曲线系列溶液中均匀分布,峰面积比与浓度的线性回归相关系数r<0.999 7。使用DMF作为溶剂时,虽然1.0 g的样品不能完全溶解于5 mL溶剂,但可以溶解所有待测物和内标,14种待测物回归曲线的相关系数均>0.999 0,回收率良好,且所测得的残留溶剂种类及含量与文献[16]结果相近。
3.3限度合理性 抗感染药物尤其是注射剂的不良反应发生率高,头孢哌酮钠舒巴坦钠引起的严重不良反应事件报告数量在2015~2017年高居抗感染药物的前3位,不能排除该现象与其普遍高于0.8%的残留溶剂总量之间的关系。
由于注射用头孢哌酮钠舒巴坦钠的生产工艺不涉及其他辅料,制剂中的残留溶剂主要来源于原料药[18]。在头孢哌酮钠的生产工艺中,丙酮是关键溶剂且无法完全去除[19-20],《中国药典》规定头孢哌酮钠原料药中丙酮残留量不得超过2.0%。本研究测得丙酮残留量的最大值为0.84%,依据注射用头孢哌酮钠舒巴坦钠的说明书,其最大推荐剂量为每日8.0 g,因此ICH Q3C残留溶剂指导原则推荐的限度相当于含丙酮残留量不得超过0.625%。而本研究结果显示,大多数生产企业的制剂中丙酮残留量均显著超过该限度,存在安全风险。在实际生产过程中,有部分企业通过改进原料药成盐过程或混粉工艺[17],将丙酮残留量控制在0.5%以内。综上所述,有必要对注射用头孢哌酮钠舒巴坦钠制剂的残留溶剂进行检查,并考虑纳入质量控制。
