一株产果胶酶芦苇内生真菌的分离、鉴定及酶学性质研究
2021-07-04李碧婵肖国利黄星星
李碧婵,肖国利,黄星星,张 敏
(1.武夷学院 生态与资源工程学院,福建 武夷山 354300;2.福建省生态产业绿色技术重点实验室,福建 武夷山 354300)
果胶酶是能降解果胶物质的一类酶的总称[1]。果胶酶在食品、医药、纺织、造纸、动物饲料生产以及废水处理等领域有广泛应用,是生物技术领域最具商业价值的酶之一[2]。果胶酶可由微生物或其他生物如植物、线虫和昆虫等自然产生[2]。其中,微生物果胶酶以其具有广泛的底物特异性、诱导性、多功能性以及可作用于多种果胶物质的能力,成为许多工业过程中重要的生物催化剂[3]。据报道,微生物来源的果胶酶占全球食品和工业酶销售额的25%,其市场仍在不断增长[4]。目前,曲霉属、欧文氏菌属、芽孢杆菌属和青霉属已被广泛应用于果胶酶的商业生产中[1,5]。随着果胶酶的应用越来越广泛,对其稳定性、高活性和特异性的要求也在迅速增加,筛选具有新特性、更高酶活性和大规模生产果胶酶的微生物的具有重要意义。
内生菌通常是指无症状地生活在植物组织内的细菌、真菌和放线菌[6]。生活于健康植物组织的内生真菌对植物有着深远的影响。一方面,内生真菌可以产生生物活性化合物,起到化学防御并促进植物生长的作用;另一方面,内生真菌还能产生如果胶酶[7-9]、纤维素酶[10-11]、脂肪酶[12]、淀粉酶[13-15]和蛋白酶[16-17]等多种酶类,帮助其侵入并定植于宿主植物组织中。这些真菌酶在生物降解中发挥重要作用,在洗涤剂和纺织工业、食品加工、医疗、制药以及农业等领域有广阔的应用前景[18-20]。BEZERR J D P等[21]从仙人掌中分离到两株具有分解果胶能力的内生真菌日本曲霉(Aspergillus japonicus)和产气栎生青霉(Penicillium glandicola)。SOPALUN K等[22]从泰国兰花中发现有25株内生真菌具有果胶酶活性,其中茶拟盘多毛孢(Pseudopestalotiopsis theae)DapR 02具有高产果胶酶的潜力,通过发酵条件优化,所产果胶酶的酶活达到1.524 U/mL。
本研究通过十六烷基三甲基溴化胺(cetyltrimethylammonium bromide,CTAB)沉淀法,从芦苇的植株中分离筛选出高产果胶酶的菌株,结合菌落形态特征、光学显微镜观察以及内转录间隔区(internal transcribed space,ITS)序列分析对筛选菌株进行鉴定,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定其发酵液的酶活,并对该菌株所产果胶酶的酶学特性进行了分析,为采用该菌株生产果胶酶的后续研究及应用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
芦苇健康植株采自福建武夷山天心湖边。
1.1.2 化学试剂
果胶、D-半乳糖醛酸:上海麦克林生化科技有限公司;十六烷基三甲基溴化胺、3,5-二硝基水杨酸、磷酸氢二钾、磷酸二氢钾、七水合硫酸镁、硝酸钠、硫酸铵(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
真菌分离培养基采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[9]:马铃薯200 g,蔗糖20 g,琼脂15~20 g,蒸馏水1 000 mL,自然pH。121 ℃灭菌20 min。
细菌分离培养基:蛋白胨10 g,酵母浸膏粉5 g,氯化钠10 g,琼脂粉15~20 g,蒸馏水1 000 mL。121 ℃灭菌20 min。
筛选培养基:果胶2 g,K2HPO41 g,FeSO4·7H2O 0.01 g,MgSO40.5 g,NaNO33 g,琼脂15 g,蒸馏水1 000 mL,pH 5.5。121 ℃灭菌20 min。
发酵培养基:桔皮粉1 g,KH2PO43.8 g,K2HPO4·3H2O 0.2 g,(NH4)2SO42 g,蒸馏水1 000 mL,pH 5.5。121 ℃灭菌20 min。
1.2 仪器与设备
SHA-B恒温振荡器:常州国华电器有限公司;SUP-080生化培养箱:上海精宏实验设备有限公司;Neofuge15R高速冷冻离心机:上海力申科学仪器有限公司;UV-1100紫外可见分光光度计:上海美谱达仪器有限公司;CX23正置生物显微镜:奥林巴斯工业有限公司。
1.3 方法
1.3.1 植物样品的预处理
将新采集的芦苇植株剪成3~4 cm长,用洗洁精清洗3次,自来水冲洗30 min,紫外灯照射30 min,然后用体积分数为70%的乙醇浸泡30 s,无菌水冲洗3次,接着用2.5%的次氯酸钠溶液浸泡5 min,无菌水冲洗3次。
1.3.2 内生菌的分离与纯化
将植物的外表皮剥离,取根的中间部分,切成0.5 cm×0.5 cm大小,分别插入到真菌分离培养基和细菌分离培养基中培养(真菌28 ℃,细菌37 ℃)。待在植物组织处长出菌落后,及时挑取外观不同的菌落转移至相应的新鲜分离培养基上,直至纯化。
1.3.3 产果胶酶内生真菌的筛选
(1)初筛
将1.3.2分离纯化得到的内生菌接种至果胶酶筛选培养基上,分别在37 ℃或28 ℃条件下培养3 d。加入10 mL 1%CTAB溶液,静置5 min后倾去,再加入1%NaCl溶液,静置5 min。测量透明圈的直径(Dp)与菌落直径(Dc)的比值(Dp/Dc),选择Dp/Dc值较大的菌株进行摇瓶实验。
(2)复筛
将纯化后的菌株接种至50mL液体发酵培养基中,28℃、180 r/min摇瓶培养72 h,发酵液于8 000 r/min、4 ℃条件下离心15 min,收集上清液,即为粗酶液,用于果胶酶活力测定,根据粗酶液中果胶酶的活性,确定产酶最优的菌株。
1.3.4 果胶酶活性测定
果胶酶活力测定参考张飞等[23]的方法,并稍加改进。取1 mL pH 5.0的1%果胶溶液,50 ℃预热5 min;加入1 mL预热过的适当稀释的粗酶液,立即摇匀,50 ℃水浴保温30 min,加入2 mL的蒸馏水及2.5 mL的DNS试剂,混匀,于沸水浴中煮沸10 min,流水冷却后加蒸馏水定容;同时以经煮沸灭活的粗酶液作对照,于波长540 nm处测定吸光度值。
果胶酶酶活定义:1 mL酶液在50 ℃、pH 5.0的条件下,1h分解果胶产生1mg半乳糖醛酸为一个酶活力单位(U/mL)。
1.3.5 菌种鉴定
(1)形态学观察
将分离得到的产果胶酶的内生真菌接种到PDA培养基平板上,28 ℃培养,观察菌落特征,通过显微镜观察菌株的菌丝、分生孢子囊以及分生孢子的特征。
(2)ITS序列分析
ITS序列分析委托北京信诺金达生物科技有限公司进行。将所测得的序列提交到美国国家生物技术信息中心(national center of biotechnology information,NCBI),通过基本局部比对搜索工具(basiclocalalignmentsearchtool,BLAST)与已知的序列进行比对分析。
1.3.6 菌株产果胶酶的酶学特性研究
(1)酶反应的最适温度
将适当稀释的粗酶液分别在不同温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃)条件下进行酶反应,反应时间30 min,测定酶活力,以测得的最高酶活为100%,计算各温度条件下的相对酶活,获得果胶酶的最适反应温度。
(2)酶的热稳定性试验
将稀释的粗酶液分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃保温2 h后在最适反应条件下测定酶活力,考察果胶酶的温度稳定性。
(3)酶反应最适pH值
将稀释的粗酶液分别在不同pH(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0)条件下进行酶反应,反应时间30 min,测定酶活力,以测得的最高酶活为100%,计算不同pH值下的相对酶活,获得果胶酶的最适反应pH值。
(4)酶的pH稳定性试验
将粗酶液分别用不同pH值(2.0、3.0、4.0、5.0、6.0、7.0、8.0)的缓冲液稀释,在常温放置24 h,然后在最适反应条件下测定酶活力,考察果胶酶的pH稳定性。
(5)底物浓度对酶促反应的影响
将果胶底物的终质量浓度分别调整为0.40 mg/mL、0.80mg/mL、1.25mg/mL、1.50mg/mL、2.00mg/mL、2.50mg/mL。以DNS法测定酶促反应所产生还原糖的量来计算酶促反应初速度,计算该酶分解果胶的米氏常数Km和最大酶解速率Vmax。
2 结果与分析
2.1 高产果胶酶内生菌的分离筛选
从芦苇中共分离得到9株内生菌,通过果胶酶筛选培养基平板初筛,获得4株透明圈明显的菌株,编号为z1~z4,通过液体发酵培养测定果胶酶活力复筛,结果见表1。由表1可知,分离筛选获得一株产果胶酶活力最高的菌株z4,提交至中国典型培养物保藏中心保藏,保藏编号为:CCTCC M 2019946。菌株z4所产果胶酶活力可达到40.52 U/mL,远高于王齐玮等[8]从大麻籽中筛选到的产果胶酶的内生细菌发酵所产生的果胶酶(酶活最高为28.1 U/mL)以及尹乐斌等[24]从脐橙果园土壤中筛选到的尖孢镰刀菌所产的421 U/L果胶酶酶活,但低于赵晓璐等[9]从荷叶中分离的内生真菌炭疽菌属HY2所产的62.9 U/mL的果胶酶酶活。
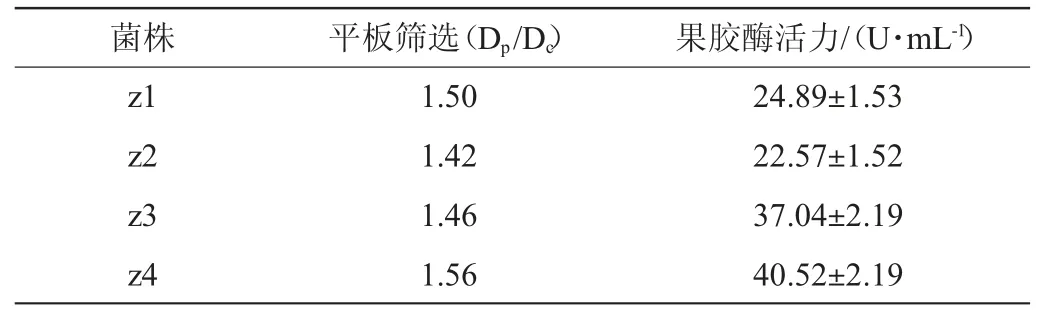
表1 产果胶酶菌株的初筛及复筛Table 1 Primary and secondary screening of pectinase-producing strains
2.2 内生菌株z4的鉴定
2.2.1 形态学观察
菌株z4在PDA培养基上培养,其菌落形态及显微形态特征见图1。由图1可知,菌落开始为白色绒毛状,几天后菌落中央变为黄色,之后整个菌落变为黄色呈半绒毛状,继续培养,菌落中央及边沿变为墨绿色,之后整个菌落变为墨绿色。菌株z4在显微镜下观察,可见其孢子囊呈球形或近烧瓶形,分生孢子呈近球形或椭圆形。形态学观察结果初步鉴定菌株z4为霉菌。
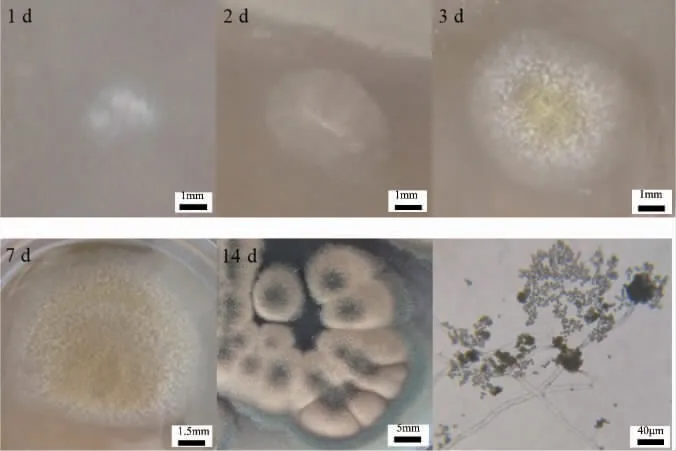
图1 菌株z4的菌落形态及显微形态特征Fig.1 Colony morphology and micro-morphological characteristics of strain z4
2.2.2 ITS序列分析
ITS序列分析结果由北京信诺金达生物科技有限公司提供。菌株z4的ITS序列长602 bp(GenBank 登录号为MW275931)。将z4菌株的ITS序列在NCBI中进行BLAST比对,所获得的同源序列均为曲霉属的ITS序列。将ITS序列与下载的相关菌株序列构建系统发育进化树,结果见图2。

图2 菌株z4基于rDNA-ITS序列构建的系统发育树Fig.2 Phylogenetic trees of strain z4 based on rDNA-ITS sequence analysis
由图2可知,多基因系统发育树分析表明,菌株z4与红绶曲霉在系统发育树中聚为一支。菌株z4的ITS序列与Aspergillus nomiusKS10(DQ467991.1,GenBank)和Aspergillus nomiusNN20(DQ467990.1,GenBank)的基因序列同源性达98%。结合菌落和显微形态特征,菌株z4被鉴定为红绶曲霉(Aspergillus nomius)。
2.3 酶学特性研究
2.3.1 温度对果胶酶活性的影响
果胶酶的活性和热稳定性对其在生物技术过程以及食品工业中的应用至关重要。研究表明,果胶酶在很宽的温度范围内(30~80 ℃)都是稳定且有活性的[25]。由图3A可知,由Aspergillus nomiusz4产生的果胶酶在30~70 ℃均有活性,其中,最适反应温度为45 ℃,当温度低于45 ℃时,果胶酶活力随温度升高而上升,超过45 ℃酶活力迅速下降,但是在50~70 ℃范围内仍保持50%以上酶活力。由图3B可知,通过对该酶的热稳定性研究发现,在温度30~40 ℃范围内保温2 h,其果胶酶活力仍保留80%以上;在20~40 ℃范围内保温2 h酶活力保留60%;当温度高于50 ℃时,酶活迅速下降,但是在70 ℃条件下保温2 h,仍具有一定的酶活力。以上结果说明,该酶最适反应温度为45 ℃,并且具有较好的温度稳定性。

图3 温度对果胶酶活性的影响(A)及热稳定性(B)Fig.3 Effect of temperature on pectinase activity (A) and thermal stability (B)
2.3.2 pH对果胶酶活性的影响
由Aspergillus nomiusz4产生的果胶酶在不同pH下的酶活力变化如图4A所示,该酶在pH 3.0~7.0范围内具有活性,在pH 6.0时酶活力最高,低于pH 5.5或高于pH 6.5的条件下酶活均明显下降,说明该果胶酶在弱酸性条件下显示出较高的活性。酶的pH稳定性结果如图4B所示,该酶在pH 5.0~6.0条件下放置24 h后酶活力保留85%以上,说明在此pH范围内酶活稳定;而在pH4.0以下或pH 7.0以上保存24 h,酶活力迅速下降。

图4 pH值对酶活力的影响(A)及pH稳定性(B)Fig.4 Effect of pH value on pectinase activity (A) and pH stability (B)
2.3.3 酶促反应动力学测定
以果胶浓度的倒数(1/S)为横坐标,酶促反应速度的倒数(1/V)为纵坐标,制作Lineweaver-Rurk双倒数曲线。由图5可知,Aspergillus nomiusz4所产果胶酶对果胶的水解作用符合米氏方程。标准曲线的回归方程为y=0.016x+0.01(相关系数R2=0.991 2),说明曲线拟合良好。由回归方程计算得到果胶酶的表观米氏常数Km为1.60 mg/mL,最大反应速率Vmax为100 mg/(mL·h)。与现有文献报道相比,Aspergillus nomiusz4所产果胶酶具有更高的底物亲和力[5,26]。

图5 双倒数法测定红绶曲霉z4所产果胶酶的动力学参数Fig.5 Kinetic parameters of pectinase from Aspergillus nomius z4 by Lineweaver-Burk determination
3 结论
本研究采用以果胶为唯一碳源的培养基进行平板分离,通过CTAB沉淀法从健康芦苇植株中筛选出产果胶酶的内生真菌,通过摇瓶培养测定各菌株所产果胶酶活力复筛,选出一株高产果胶酶的菌株z4,在28 ℃、150 r/min条件下培养72 h,其果胶酶酶活可达到40.52 U/mL。根据形态学特征和ITS序列分析,将z4菌株鉴定为红绶曲霉(Aspergillus nomius)。该菌株已于2019年11月18日保藏于中国典型培养物保藏中心,保藏编号为CCTCCM 2019946。该菌株所产果胶酶的最适反应温度为45 ℃,在30~40 ℃范围内保温2 h,酶活力保留80%以上,说明该酶具有较好的热稳定性;该酶的最适作用pH值为6.0,在pH 5.0~6.0条件下放置24 h,酶活力保留85%以上,说明该酶在此pH范围内稳定性较好。该酶对果胶具有较高亲和力,以果胶为底物时,米氏常数(Km)值和最大反应速率(Vmax值)分别为1.60 mg/mL和100 mg/(mL·h)。以上实验结果表明,芦苇内生真菌z4具有良好的果胶酶生产能力,今后可进一步研究优化其培养基和发酵条件以高效地生产果胶酶。
