襄阳地区中高温大曲曲皮和曲心真菌多样性解析
2021-07-04邓长阳黎婷玉刘文汇吴兴茹刘忠军
邓长阳,黎婷玉,刘文汇,吴兴茹,刘忠军,郭 壮
(1.湖北文理学院 湖北省食品配料工程技术研究中心,湖北 襄阳 441053;2.襄阳市酿酒生物技术与应用企校联合创新中心,湖北 襄阳 441053;3.湖北古襄阳酒业有限公司,湖北 襄阳 441100)
作为世界六大蒸馏酒之一,白酒不仅具有悠久的历史文化,同时独特的生产发酵工艺还赋予了其以酯类为主体的复合香味[1-2]。浓香型白酒作为我国白酒的典型代表之一,具有绵柔甘冽、芳香浓郁、入口甜、落口绵和尾净余长等特点,在我国白酒行业中占据着重要的地位[3]。大曲是浓香型白酒酿造过程中的最主要的发酵剂和糖化剂,在白酒的发酵过程中扮演着重要的角色[4]。大曲中富含着丰富的微生物群系,且以真菌为主参与了浓香型白酒的发酵生产[5],如霉菌具有蛋白酶、糖化酶和淀粉酶等丰富的酶系可对发酵基质中的碳水化合物和蛋白质等进行水解,进而促进发酵的进行[6];而酵母菌则具有酒精发酵和产香能力,对于酒精和香味物质的生产具有重要的作用[7]。
最早有关大曲中真菌类群的研究主要是基于传统微生物学手段完成的,如罗惠波等[8]对采集于泸州老窖的大曲真菌进行了分离鉴定,发现曲霉属(Aspergillus)为其优势种群。随着测序技术的迅速发展,以Illumina MiSeq为代表的第二代高通量测序技术在发酵食品微生物类群解析方面有着广泛的应用[9],如JI Z等[10]通过对麦曲进行高通量测序,解析了其真菌类群的多样性,为提升黄酒品质提供了一定的参考依据。
近年来,为了赋予酒体一定的酱香风味,中高温大曲逐渐被应用于浓香型白酒的酿造。本研究使用Illumina MiSeq高通量测序技术对襄阳地区中高温大曲的真菌多样性进行解析,同时结合多元统计学手段对其曲皮和曲心中真菌类群的差异进行甄别,以期为襄阳乃至华中地区白酒制曲工艺的改良提供一定的数据支撑。
1 材料与方法
1.1 材料与试剂
大曲:所有中高温大曲均采集自湖北省襄阳市某酒业有限公司制曲车间。
脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;FastPfu Fly DNA Polymerase、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)Mix和FastPfuBuffer:北京全式金生物技术有限公司;引物ITS3F/ITS4R(ITS3F:5'-GCATCGATGAAGAACGCAGC-3';ITS4R:5'-TCCTCCGCTTATTGATATGC-3'):武汉天一辉远生物科技有限公司合成;MiSeq高通量测序配套试剂:美国Illumina公司。
1.2 仪器与设备
ND-2000C微量紫外分光光度计:美国Thermo公司;UVPCDS8000凝胶成像分析系统:美国ProteinSimple公司;Illumina MiSeq高通量测序平台:美国Illumina公司;Veriti FAST梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;sigma 3K15台式高速冷冻离心机:德国SIGMA公司;R930型机架式服务器:美国DELL公司;YL90L3-4磨粉机:山西泰禾工贸有限公司。
1.3 方法
1.3.1 样品采集
所采集的中高温大曲以小麦为主要原料制作而成,润粮时间为30 min,成型后长宽高为37 cm×18 cm×7 cm,入库发酵时库房温度保持在58~60 ℃,曲块温度达到42 ℃进行第一次翻曲,每隔2~3天翻曲一次,发酵30 d后进行贮存成熟。样品采集时,使用酒精棉擦拭后的钢锯在1号中高温大曲6个侧面距表皮约1 cm的位置分别进行切割,靠近表面的部分定义为曲皮,编号为P1,其余部分定义为曲心,编号为X1,将切割下的曲皮和曲心分别使用粉碎机粉碎后按四分法取20 g左右装入灭菌的离心管备用。共取10个中高温大曲样品,各样品取样方法相同,编号依次为P1~P10和X1~X10,其中相同数字编号的样本来自于同一块大曲。
1.3.2 宏基因组DNA提取和Illumina MiSeq测序
参照王玉荣等[11]的方法采用基因组提取试剂盒对大曲中微生物的宏基因组DNA进行提取,并以其为模板,使用通用引物ITS3F、ITS4R对ITS2区域进行PCR扩增。将检验合格后的PCR扩增产物进行测序。
1.3.3 序列质控和生物信息学分析
参照郭壮等[12]的方法对下机序列进行质控,使用QIIME(v1.95)平台[13],依次使用PyNAST软件对序列进行比对[14]、使用UCLUST方法划分操作分类单元(operational taxonomic units,OTU)[15]、基于UNITE数据库对每个OTU的代表性序列进行注释[16]、使用FastTree软件构建系统发育树[17]和计算α和β多样性,进而对曲皮和曲心中真菌类群的丰度和多样性进行评估。
1.3.4 多元统计学分析
采用Venn图和瀑布图对曲皮和曲心中共有的OTU进行识别;使用Wilcoxon检验和主坐标分析(principal coordinate analysis,PCoA)分别对曲皮和曲心中真菌类群的α和β多样性进行计算;使用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析对曲皮和曲心中真菌类群的差异性进行甄别。本研究中所有的分析和绘图均使用R(v3.3.2)软件进行。
2 结果与分析
2.1 基于门和属水平的曲皮和曲心真菌构成分析
本研究采用高通量测序技术对曲皮和曲心中真菌类群构成进行了揭示,并对其在门水平上的注释结果进行了分析,结果见图1。
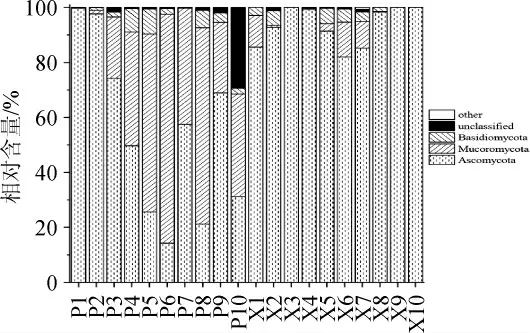
图1 中高温大曲曲皮和曲心中优势菌门相对含量的分析结果Fig.1 Analysis results of the relative content of dominant fungal phyla in the surface and the center of medium-high temperature Daqu
由图1可知,所有中高温大曲样品中共注释出7个真菌门,其中优势菌门(平均相对含量>1.00%)有3个,分别为子囊菌门(Ascomycota)(73.73%)、毛霉菌门(Mucoromycota)(21.39%)和担子菌门(Basidiomycota)(2.91%),三者的累计平均相对含量高达98.03%。由图1亦可知,3个优势菌门在曲皮和曲心中存在较大的差异,其中曲心主要以Ascomycota为主,其平均相对含量高达93.45%,而曲皮主要以Ascomy cota和Mucoromycota为主,其平均相对含量分别54.01%和38.98%,其累计占比达92.99%。值得注意的是,相较于曲皮,曲心中Mucoromycota的相对含量极低。大曲样品中优势真菌属的相对含量见图2。

图2 中高温大曲曲皮和曲心中优势真菌属相对含量的分析结果Fig.2 Analysis results of the relative content of dominant fungal genera in the surface and the center of medium-high temperature Daqu
由图2可知,从曲皮中共鉴定出6个优势真菌属(平均相对含量>1.00%),分别为隶属于Ascomycota的嗜热真菌属(Thermomyces)、曲霉属(Aspergillus)、双足囊菌属(Dipodascus)和毕赤酵母属(Pichia),平均相对含量分别为25.39%、8.23%、8.09%和5.35%;隶属于Mucoromycota的根霉属(Rhizopus),平均相对含量为38.83%;以及隶属于Basidiomycota的丝孢酵母属(Trichosporon),平均相对含量为2.28%。从曲心中共鉴定出9个优势真菌属,分别为隶属于Ascomycota的Thermomyces、热子囊菌属(Thermoascus)、Aspergillus、Rasamsonia和Dipodascus,其平均相对含量分别为56.67%、16.86%、9.22%、5.55%和1.43%;隶属于Mucoromycota的根毛霉属(Rhizomucor)和Rhizopus,其平均相对含量分别为2.01%和1.49%;以及隶属于担子菌门的Trichosporon,其平均相对含量为2.18%。经Wilcoxon检验发现,Rhizopus、Dipodascus和Pichia在曲皮中的含量显著偏高(P<0.05),平均含量分别为38.83%、8.09%和5.35%,而Thermomyces、Thermoascus、Rasamsonia和Rhizomucor在曲心中的含量显著偏高(P<0.05),平均含量分别为56.67%、16.86%、5.55%和2.01%。由此可见,中高温大曲曲皮和曲心中真菌类群的构成存在一定的差异。
2.2 曲皮和曲心中真菌类群群落结构的比较
本研究进一步对曲皮和曲心中真菌类群的4种α多样性指数进行了比较分析,其结果见图3。
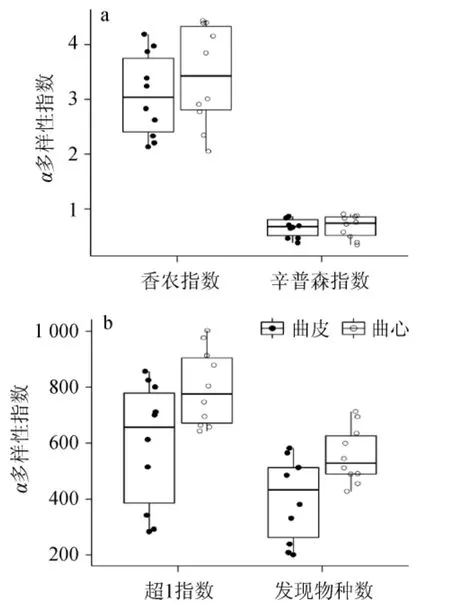
图3 中高温大曲曲皮和曲心α多样性指数的比较分析Fig.3 Comparative analysis of α diversity indexes in the surface and the center of medium-high temperature Daqu
香农指数和辛普森指数常用来评估样本中微生物的多样性,而超1指数和发现物种数则常用来评估样本中微生物的丰度[18]。本研究使用Wilcoxon检验对两类大曲中的4种α多样性指数进行显著性分析发现,其差异均不显著(P>0.05)。由此说明,曲皮和曲心中真菌类群的多样性和丰度并不存在显著性差异。本研究进一步基于非加权和加权的UniFrac距离对真菌类群的菌群结构进行了主坐标分析,其结果见图4。
由图4可知,基于非加权和加权UniFrac距离的主坐标分析均表明,中高温大曲中不同部位的样品在空间排布上呈现出明显聚类趋势。
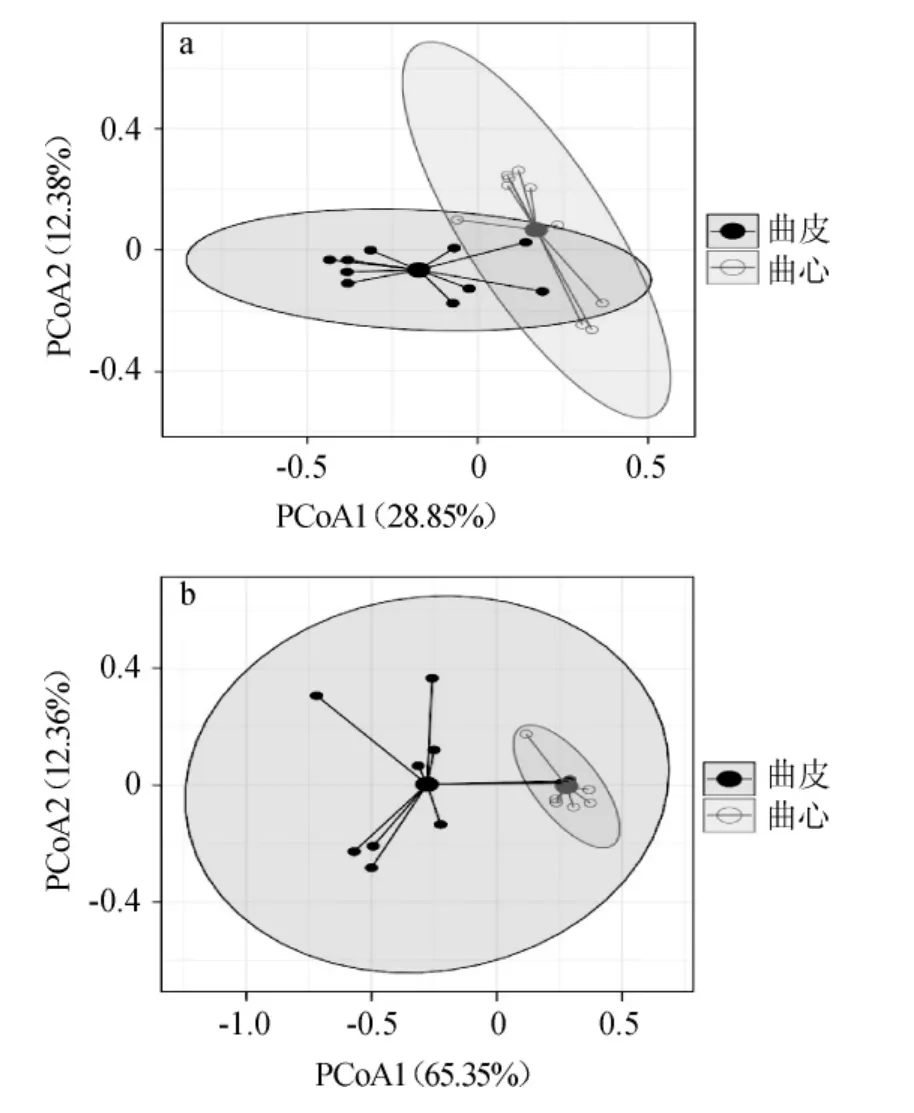
图4 基于非加权(a)和加权(b)UniFrac距离的主坐标分析Fig.4 Principal coordinate analysis based on unweighted (a) and weighted (b) UniFrac distance
由图4a可知,曲皮样本主要位于X轴负方向,曲心样本则几乎全部位于X轴正方向,而图4b亦可以观察到类似的现象。值得注意的是,相较于非加权UniFrac距离的主坐标分析,加权UniFrac距离的主坐标分析显示曲皮中的真菌群落结构组间差异更大。由此说明,曲皮中低丰度的真菌类群之间的构成差异较小,而优势菌属之间的相对含量存在较大的差异;但曲心中的低丰度物种差异较大,而优势菌属的相对含量之间并无明显的差异。因此,本研究对曲皮和曲心中的共有OTU进行了统计分析,结果见图5。

图5 中高温大曲曲皮和曲心中共有OTU的分析结果Fig.5 Analysis results of common OTU in the surface and the center of medium-high temperature Daqu
由图5a可知,所有大曲样品中共筛选出330个代表性OTU(在每组50%的样品中出现),曲皮中有73个代表性OTU,而在曲心中有290个代表性OTU,且两组的共有OTU有33个。由图5b可知,共有5个OTU在所有样品中出现,可被注释为Thermomyces和Aspergillus两个属,两个属分别占总序列数的33.34%和3.27%。而对比图2亦可知,Thermomyces和Aspergillus主要分布在曲心,而在曲皮中的相对含量较低。由此说明,曲皮中存在大量的非代表性OTU(在每组样品中出现的频率不足50%),且其平均相对含量较低;而曲心则存在着较多的代表性OTU,大部分OTU注释到的菌属隶属于优势菌属,这也导致大曲中部的低丰度物种的种类较少。此结果与图4所得出的结论相一致,进一步说明了结果的正确性。同时,本研究通过LEfSe分析对大曲不同部位中差异的微生物进行了解析,结果见图6。
由图6可知,本研究通过LEfSe分析共甄别出22个具有差异的微生物类群,其中在属水平上共甄别到10个差异菌属,但仅有两个隶属于优势菌属,分别为Rhizomucor和Thermoascus,且两者都主要分布在曲皮。由此说明,造成中高温大曲曲皮和曲心中真菌菌群结构差异的主要是由Rhizomucor和Thermoascus及若干低丰度菌属造成的。
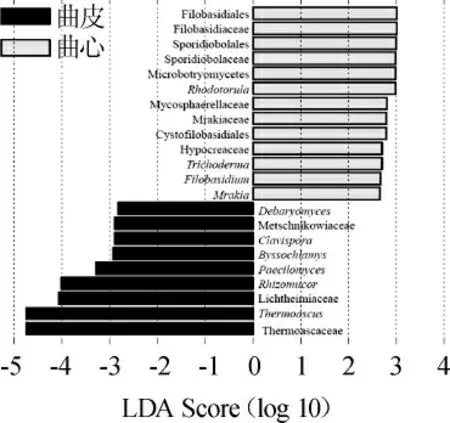
图6 线性判别分析效应大小分析结果Fig.6 Analysis results of linear discriminant analysis effect size
3 讨论
本研究采用MiSeq高通量测序技术对中高温大曲曲皮和曲心中的真菌多样性进行了解析,发现Ascomycota和Mucoromycota为其优势真菌门,这与前人关于大曲中真菌多样性的研究结果相一致[19-20]。本研究亦发现Thermomyces、Rhizomucor、Thermoascus、Aspergillus、Dipodascus和Pichia等为大曲中的优势真菌属,其累计平均相对含量高达93.12%。前期针对大曲微生物多样性研究的报道与本研究的结论存在一定的差异,孙利林等[21]研究发现,安徽省北部某酒厂高温大曲中主要优势菌属为Aspergillus和Thermoascus,而CHEN B等[22]通过研究发现,高温大曲中主要优势菌种为多变拟青霉(Paecilomyces variotii)和米曲霉(Aspergillus oryzae),导致这种差异的原因可能在于制曲工艺、原料和制作地环境等因素的不同[23-24]。
虽然同一份中高温大曲的制作工艺、发酵条件和原料等完全相同,但曲皮和曲心的微生物构成依旧存在着较大的差异。本研究结果表明,曲皮主要以Rhizopus和Rhizomucor为主,且不同大曲样本中存在较多的低丰度物种;而曲心则主要以Thermomyces、Thermoascus、Aspergillus和Pichia等大曲中常见的真菌属为主,且曲心的低丰度物种数相对较少。调查发现,在贮存成熟过程中同一份大曲曲皮和曲心的温度并不相同,由于曲皮直接与空气相接触,可以直接和空气进行热传递因而其温度较之曲心偏低。此外,曲皮的水分含量要低于曲心,加之曲皮与空气接触的更为密切,这些均可能是导致大曲不同部位真菌类群存在较大差异的原因。
不可否认的是,本研究使用MiSeq高通量测序技术对中高温大曲中真菌ITS2区域进行了测序,其仅能在“属水平”上展开分析讨论,且无法对真菌类群发挥的具体功能展开解析[25],这也使得本研究存在一定的局限性。因此,在后续研究中采用宏基因组学技术在“种”或“株”水平上对襄阳地区中高温大曲中真菌类群进行解析亦是十分必要的。
4 结论
襄阳地区中高温大曲曲皮和曲心真菌的丰度和多样性无明显差异,但两者菌群的构成存在显著的不同。在门水平上,曲心主要以子囊菌门(Ascomycota)为主,而曲皮以子囊菌门(Ascomycota)和毛霉菌门(Mucoromycota)为主。在属水平上,根霉属(Rhizopus)、双足囊菌属(Dipodascus)和毕赤酵母属(Pichia)在曲皮中的含量显著偏高,而嗜热真菌属(Thermomyces)、热子囊菌属(Thermoascus)、踝节菌属(Rasamsonia)和根毛霉属(Rhizomucor)在曲心中的含量显著偏高。进一步分析发现,Rhizomucor和Thermoascus及若干低丰度物种是造成襄阳地区中高温大曲曲皮和曲心真菌菌群结构存在差异的关键类群。
