肿瘤微环境响应型药物递送系统研究进展
2021-07-03杨锦昱谢锦珊白菁钰周宏磊程迪朱维平华东理工大学药学院制药工程系上海0037华东理工大学药学院药物化工研究所上海市化学生物学重点实验室上海0037
杨锦昱,谢锦珊,白菁钰,周宏磊,程迪,朱维平*(.华东理工大学药学院制药工程系,上海0037;.华东理工大学药学院 药物化工研究所,上海市化学生物学重点实验室,上海 0037)
随着人们生存环境的变化和生活压力的增大,肿瘤的发病率和病亡率逐年增加。根据《2018年全球癌症统计》的报道,有1810万癌症新病例和960万癌症死亡病例[1-2]。
恶性肿瘤存在易复发、易转移和易产生耐药性的特点[3],导致其临床治疗难度较大。手术、放疗和化疗对肿瘤起到一定的治疗效果,但它们也会对人体产生伤害。目前,靶向给药系统凭借其定位浓集、高效低毒的作用特点成为了研究热点。其中纳米级的靶向给药系统,包括聚合物胶束、脂质体、碳纳米管和树枝状聚合物等(见图1),能增加药物溶解性、改变药物体内分布、提高药物靶向性,从而提高治疗效果,降低不良反应发生率。但由于其体内稳定性差、肿瘤部位蓄积少、肿瘤穿透性差、细胞摄取率低和药物释放不完全,纳米递药系统仍需不断完善,以满足临床需求[4]。
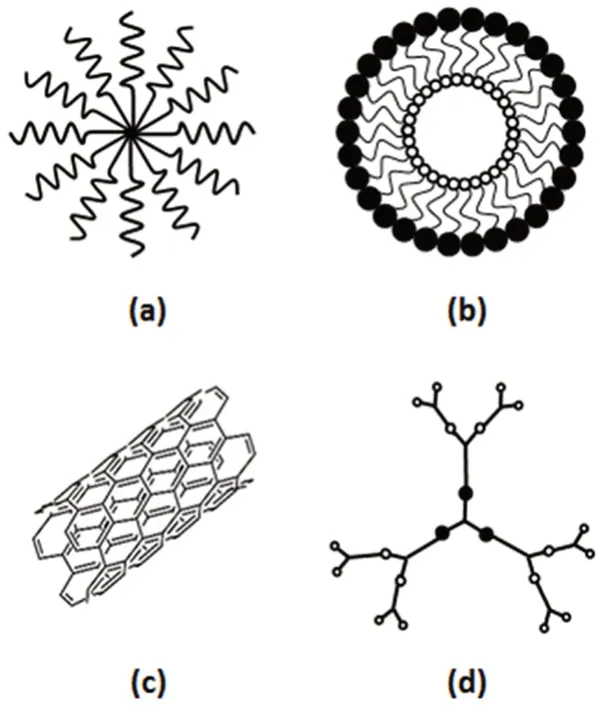
图1 用于癌症治疗中药物输送系统的不同类型的纳米载体Fig 1 Different types of nanocarriers for drug delivery systems in cancer treatment
对此,研究者们根据肿瘤微环境设计了靶向纳米递药系统,以增加对肿瘤的穿透作用,提高细胞摄取,加速药物胞内释放,实现肿瘤部位的高效递药,显示出良好的治疗效果。肿瘤组织中的细胞通过多种机制协作,来维持有利于肿瘤细胞生存和发展的微环境。与正常组织相比,肿瘤组织的特征在于其独特的病理生理指标(见图2),例如低氧或还原性微环境,细胞内高谷胱甘肽(GSH)的浓度,低pH值,酶的特异性过表达以及高活性氧(ROS)水平等,这些都可以作为前药的内源性触发因素,在不损害正常组织的情况下产生药理作用[5]。而特定的聚合物纳米载体能与特定的区域相结合,这些特定的区域通常表现出对氧化还原电位、温度、pH和光等刺激的响应,这些刺激响应性聚合物纳米载体由于具有增强疾病部位药物生物利用度的能力,在靶向药物递送应用中显示出巨大的潜力[6]。本文将对目前研究报道的一些肿瘤微环境刺激响应信号进行总结,包括肿瘤区域的乏氧、肿瘤细胞中H2O2大量积累、内涵体和溶酶体的低 pH 环境及肿瘤细胞内的高浓度GSH等。
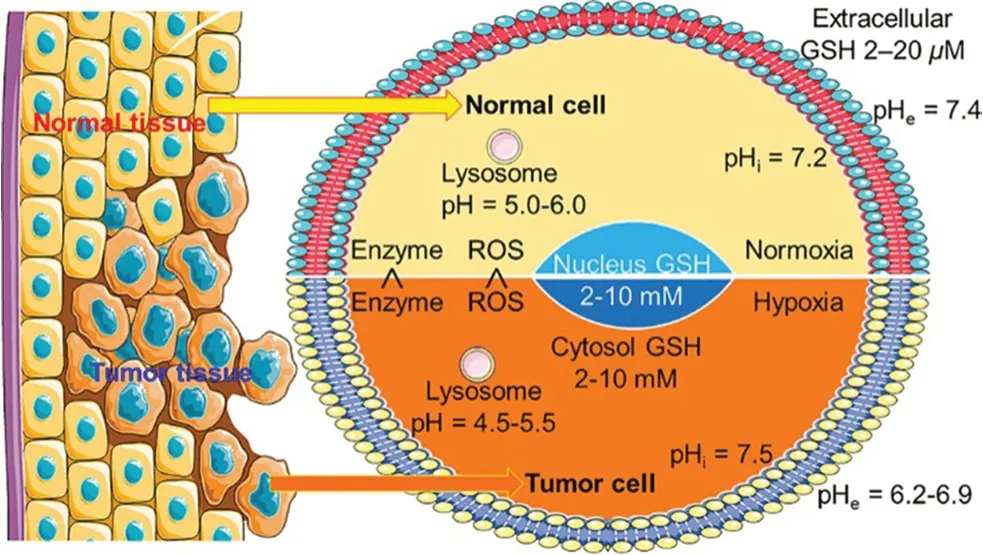
图2 正常和肿瘤细胞的不同微环境[5]Fig 2 Different microenvironments for normal and tumor cells[5]
1 基于肿瘤微环境响应型药物递送系统
1.1 pH响应
正常情况下,组织外基质中pH值接近7.4,但肿瘤细胞大多通过低效的糖酵解途径来获取能量,而乳酸和质子作为糖酵解的主要产物被泵出细胞,导致了肿瘤细胞外环境的酸化,一般pH为6.2~6.9[7]。与此同时,肿瘤细胞内早期内涵体pH在6.0左右,晚期内涵体pH一般在5.0左右;溶酶体pH在4.0~5.0[8]。由于大多数化疗药物的作用靶点在细胞核内,药物在肿瘤细胞内容易被隔离在酸性囊泡(如内涵体、溶酶体)内,难以到达作用靶点。利用这些pH的差异,可以构建pH响应性的药物递送释放系统,其主要策略包括设计聚合物载体随pH改变发生化学键断裂、构象或溶解性变化、电荷反转或质子海绵作用[4]。
1.1.1 pH响应的化学键断裂 通过酸敏感的基团(如缩醛键、腙键、亚胺键等)在酸性条件下断裂,使载体和药物分离,加速药物的释放和被摄取。
Kang等[9]将多柔比星(DOX)和树状多轮烷用腙键共价相连,形成两亲性pH敏感的PR-g-DOX胶束。这种胶束微粒在pH为5.0和6.0的微酸性环境中时,释放DOX的速度明显加快,而在正常生理条件下,几乎没有突释的现象。特别是在针对A549癌细胞的治疗中,PR-g-DOX胶束展现出更好的耐药性和更高的体内疗效。
Zhang等[10]探索出一种拥有高肿瘤靶向性和肿瘤细胞内化能力的药物递送系统。静脉注射装载紫杉醇的pH敏感Cl-Lip脂质体。该脂质体由R8肽修饰,用pH敏感的腙键连接长链聚乙二醇衍生物来提高选择性。当脂质体通过高渗透长滞留效应(EPR)效应到达肿瘤细胞间液时,低pH环境使腙键断裂从而暴露R8肽,在R8肽的介导作用下,药物被肿瘤细胞摄取从而发挥作用。
1.1.2 pH响应的构象或溶解性改变 通过聚合物上可解离的基团(如氨基、羧基)随pH的改变发生构象或溶解性的变化,使载体系统稳定性降低,促进药物的释放。
Liu等[11]探索出一种具有pH敏感的近红外荧光成像功能的新型聚合物胶束。该胶束以聚乙二醇甲基丙烯酸酯(PEGMA)为亲水外壳,以PMAA/DOX 复合物作为胶束内核。在酸性环境下聚甲基丙烯酸(PMAA)的羧基质子化,改变了其在水溶液中的溶解度和形态,导致内核解离,胶束崩塌并快速释放出DOX,表现出对HeLa细胞的有效细胞毒性。
1.1.3 pH响应的电荷反转 通过能发生电荷反转的两性聚合物在酸性环境下的表面电性调节,使外层载体因同种电荷相斥而体积膨胀或掉落,加速药物的释放和被摄取。
Ju等[12]设计了一种核-壳交联结构的纳米凝胶,由N-赖氨酰基-N'-琥珀酰基壳聚糖(NLSC)、N-异丙基丙烯酰胺(NIPAM)和牛血清蛋白(BSA)构成。其中,NLSC具有酸触发的电荷反转能力,能在中性条件下存在的NIPAM构造了纳米凝胶的聚电解质核心,而带负电荷的BSA通过在聚电解质核心上交联形成衣壳状的壳,在系统循环和pH响应溶胀-收缩过程中保留了纳米凝胶的稳定性。低pH时,NLSC中的氨基迅速质子化,产生静电排斥力,触发N-赖氨酰基-N'-琥珀酰基壳聚糖纳米凝胶(NLSC-NG)聚电解质核心的溶胀而释放药物,随后NLSCNG被转运至细胞质,恢复原有大小,从死细胞中排出,再被周围的肿瘤细胞摄取,发生类似病毒感染的过程。这种连续的递送系统,具有作为深层渗透抗癌药物的潜力(见图3)。
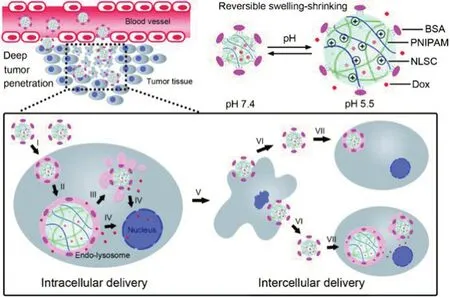
图3 可逆溶胀-收缩纳米凝胶(NLSC-NG)的细胞间递送系统示意图[12]Fig 3 Intercellular delivery system of reversible swelling-shrinking nanogel(NLSC-NG)[12]
Yuan等[13]设计合成了具有电荷翻转能力的两性离子聚合物聚己内酯-聚(磷酸丙基乙烯-巯基乙胺-琥珀二氯)[PCL-P(AEP-g-TMA/DMA)]。生理条件下,在微观范围内具有阴离子和阳离子基团的亲水性两性离子嵌段可以通过静电相互作用形成水合层,保持恒定的表面电荷。通过EPR效应在相对酸性的肿瘤组织中积累后,纳米颗粒通过减少阴离子部分而带正电,与带负电的细胞膜结合,有助于细胞摄取药物,增强治疗效果。
1.1.4 pH响应的质子海绵作用 阳离子聚合物[如聚乙烯亚胺(PEI)、聚组氨酸(p-His)、聚L-赖氨酸(PLL)等]的质子缓冲能力可以促进载体的内涵体/溶酶体逃逸,从而促进核酸的释放。内涵体和溶酶体的酸性环境对弱碱性的药物有蓄积作用,也可能使药物分解而失去活性。因此,进入内涵体和溶酶体的药物必须尽快从内涵体和溶酶体中逃逸到细胞质,这就需要使内涵体或溶酶体膜破裂。如PEI分子在生理条件下有15%~20%的胺质子化,在很宽的pH范围内对周围环境有缓冲作用[14]。当溶酶体内的 pH 下降时,PEI能够大量捕获质子,从而中和溶酶体的净电荷并引起氯离子内流,导致溶酶体内渗透压升高,最后溶酶体破裂,将内吞的药物/载体释放到细胞质中。
核酸可高精度地调节细胞功能,但其穿越细胞保护膜的效果较差,限制了其到达细胞内作用位点的能力。Chiper等[15]选择分子量在10~30 kDa的PEI作为合成载体。阳离子聚合物PEI与核酸的聚阴离子主链发生静电相互作用,并形成包裹核酸的阳离子颗粒,被细胞表面结合、内化。在肿瘤组织的酸性条件下,PEI发挥“质子海绵”效应,发生内涵体逃逸,促进核酸释放。
为了将siRNA全身性递送至实体瘤,Kim等[16]用载有20 kDa siRNA的单聚体聚离子复合物(uPIC)和20 nm金纳米颗粒(AuNP)构建了大小可调节且可逆稳定的纳米结构。其中,uPIC是通过电荷匹配的聚(乙二醇)-b-聚(L-赖氨酸)(PEG-PLL)共聚物的电荷匹配聚离子络合物制备的,利用PLL的质子缓冲能力逃离内涵体/溶酶体进入胞质,再被胞质中高浓度的GSH还原,使硫-金键断裂而快速释放出 siRNA,提高了 siRNA 的基因沉默效率。
1.2 氧化还原响应
肿瘤微环境的一个显著特点是高氧化还原水平。肿瘤细胞中,包括H2O2在内的ROS产生增加,处于高氧化水平[17]。由于高浓度的ROS会对细胞产生破坏作用,肿瘤细胞通过上调抗氧化系统来抵抗ROS的破坏作用,从而适应氧化应激,维持ROS的适当平衡[17-18]。因此,肿瘤组织中存在较多的高还原性物质(例如GSH、还原酶等),具有高还原水平。基于高氧化还原的肿瘤微环境,研究者设计了多种高ROS响应及高GSH响应的药物递送系统。
1.2.1 乏氧响应 乏氧是实体瘤的特征之一。肿瘤细胞无节制生长,且凋亡速度低,导致它对氧及其他能量物质如葡萄糖等的需求增加;肿瘤体积高速膨胀,一部分肿瘤组织由于远离血管导致血液供应不足出现乏氧。乏氧微环境会对药物输送造成巨大障碍,影响化疗、放疗和光动力治疗等需氧疗法的效果。目前基于肿瘤乏氧微环境的治疗方法主要有三种,即向乏氧肿瘤输送氧气;原位生成氧气;靶向肿瘤乏氧微环境[19]。
① 向乏氧肿瘤输送氧气:马寅初课题组[19]设计了一个独特的DNA-dual-targeting nanodroplet多功能智能纳米载药系统NDr(Au+PFOB+O2)。一方面该系统负载的超小粒径的high-Z元素的金纳米颗粒能利用其离子化能量集中于肿瘤部位,提高放疗增敏特性;另一方面,包载的液态氟碳(PFOB)负载氧气进行输送,有效改善肿瘤乏氧微环境,从而提高放疗效果。
② 原位生成氧气:借助MnO2催化肿瘤中的H2O2产生氧气是最常见的原位生成氧气策略[20];此外,过氧化氢酶也被发现能够催化肿瘤部位的H2O2产生氧气[21],有效改善肿瘤乏氧微环境,从而提高需氧疗法的治疗效果。
Chen等[20]通过基于白蛋白的Mn2+的生物矿化,设计了智能的多功能pH / H2O2响应的以人血清白蛋白(HSA)为涂层的HSA-MnO2-Ce6&Pt(HMCP)纳米颗粒(Ce6为一种光敏剂,Pt代表一种顺铂前药),其二氧化锰外壳可以响应性地被肿瘤组织内H2O2分解释放出氧气,改善肿瘤内乏氧环境。同时,在酸性的肿瘤微环境下,HMCP纳米颗粒将逐渐降解为小尺寸(<10 nm)的单个治疗性白蛋白-药物复合物,使肿瘤内通透性大大增强,可在光动力和化学疗法的结合中进一步改善治疗效果。
③ 靶向肿瘤乏氧微环境:光动力治疗(PDT)过程消耗氧气,乏氧激活前药(hypoxia-activated prodrugs,HAPs)本身无毒性,但可选择性杀死乏氧肿瘤细胞,因此可以基于此设计HAPs与PDT联合治疗,即PDT治疗过程消耗氧气,导致肿瘤环境乏氧恶化,将进一步促进HAPs被激活从而发挥抗肿瘤协同作用[22]。
Feng等[23]利用脂质体作为载体,用其同时负载光敏剂Ce6和亲水性乏氧激活前药巴诺蒽醌(AQ4N),再用聚乙二醇(PEG)对该脂质体表面进行修饰,最后利用Ce6与64Cu同位素螯合,制备成具有成像作用的AQ4N-64Cu-hCe6脂质体。该脂质体表面的亲水性PEG能够避免纳米体系在体内被降解,提高体系的血液稳定性,使该体系能够蓄积于肿瘤组织。给予激光照射后,体系中Ce6与周围氧气反应,产生ROS,杀死肿瘤细胞。ROS的产生消耗氧气,这一过程导致肿瘤乏氧环境恶化,促进体系中乏氧激活前药AQ4N被激活,还原成具有细胞毒性的产物,能够选择性杀伤乏氧肿瘤细胞,与Ce6产生协同抗肿瘤作用,从而显著提高肿瘤治疗效果。
Li等[24]先将乏氧激活前药替拉扎明(TPZ)包埋于卟啉金属有机框架PCN-224中,再将其与一种癌细胞膜仿生修饰的纳米粒混合组装成TPZ@PCN@MEM。经静脉注射后TPZ@PCN@MEM能够选择性地蓄积于肿瘤组织中。给予激光照射后,体系中的PCN-224被激发产生ROS,发挥PDT作用,消耗氧气,导致肿瘤乏氧环境恶化,进一步促进TPZ激活,选择性杀死乏氧肿瘤细胞,实现HAPs与PDT联合治疗。
Wang等[25]合成了以iRGD肽修饰表面的纳米粒,并负载光敏剂吲哚菁绿(ICG)和乏氧激活前药TPZ。该iRGD肽能够靶向到肿瘤组织并提高纳米粒的肿瘤组织穿透能力。给予近红外激光照射后,ICG发挥PDT作用,消耗氧气导致肿瘤乏氧环境恶化,激活TPZ的抗肿瘤活性,从而实现抗肿瘤的协同作用。
Chen等[26]将低毒性的兼性厌氧菌菌株VNP20009作为生物治疗剂及药物载体,使其吸附光热剂聚多巴胺,用于肿瘤靶向治疗。该药物递送系统通过一次注射给药和激光照射后,使VNP20009能够选择性蓄积于肿瘤组织,不仅消除了原位肿瘤,同时可避免肿瘤复发和转移的产生,取得了显著的肿瘤靶向治疗效果。
有关WDR62在大脑发育过程中的功能和作用机制研究,以及WDR62基因突变如何导致小头畸形的致病机制尚不清楚。现有研究认为WDR62通过调控JNK1的活性参与脑发育过程中神经干细胞发育,敲除WDR62或JNK1的表达可引起神经干细胞发育的提前分化,神经元谱系建立及神经元迁移异常[5, 6]。
Kulkarni等[27]以偶氮苯结构作为连接臂,将聚乳酸和PEG共价结合,合成乏氧敏感的二嵌段共聚物。该聚合物在水溶液中自组装形成囊泡,可用于包载抗肿瘤药物吉西他滨和厄洛替尼。在常氧条件下,该聚合物囊泡包封的药物可维持50 min不释放;而在乏氧条件下偶氮键(AZO)还原断裂,导致聚合物囊泡结构稳定性被破坏,从而快速释放吉西他滨和厄洛替尼,实现协同抗肿瘤作用。
Thambi等[28]将疏水性的2-硝基咪唑与亲水性的羧甲基葡聚糖共价结合,形成乏氧敏感的纳米粒,并负载抗肿瘤药物DOX。在肿瘤乏氧微环境中,载体中疏水性的2-硝基咪唑被还原成亲水性产物,导致载体结构被破坏,促进DOX释放,进而发挥抗肿瘤作用。体外研究显示,在常氧条件下该纳米体系中DOX释放缓慢,但在乏氧条件下,DOX释放显著增加。
Ahmad等[29]利用酰胺反应,将6-(2-硝基咪唑)己基胺(NID)结合到甲氧基聚(乙二醇)-b-聚(谷氨酸)上,制备了乏氧敏感的纳米粒,并负载化疗药物。该体系的亲水性外壳PEG能够增强纳米体系在体内的循环稳定性;NID作为体系的疏水部分,促进材料胶束化,提高材料的载药能力,且其在乏氧条件下结构改变,导致整个纳米体系结构被破坏,从而促进药物释放,提高靶点药物浓度,增强其抗肿瘤作用。
Liu等[30]设计了一种乏氧敏感的前药胶束,以偶氮键为连接臂,将己硫醇化的PEG(PEG-C6)与化疗药物康普瑞汀(CA4)共价结合,形成两亲性分子PEG-C6-AZO-CA4。该两亲性分子在水中自组装成胶束,可负载化疗药物DOX;由于实体瘤组织的高通透性和EPR效应,胶束在肿瘤组织中蓄积,并在肿瘤乏氧微环境促使体系中乏氧敏感的偶氮苯结构还原断裂,导致载体结构被破坏,引起胶束解体,促进药物DOX释放,实现DOX 与CA4的协同抗肿瘤作用。
1.2.2 GSH响应 肿瘤细胞内的GSH浓度(2~10 mmol·L-1)很高,高于正常细胞[31];而细胞外区域(如血浆和其他体液)中的GSH浓度仅为2~20 μmol·L-1。因此可以利用GSH浓度的巨大差异来实现药物在肿瘤细胞内的快速释放,从而大大提高药物的生物利用度,增强治疗效果[32]。
Lin等[33]设计了用透明质酸(HA)包被的还原响应性壳聚糖纳米粒子。利用壳聚糖(CS)与铜螯合剂D-青霉胺(D-pen)共轭形成二硫键获得CS-SS-D-pen共轭物,DOX和D-pen中Cu(Ⅱ)离子以Cu(Ⅱ)-DOX络合物的形式进行包载(见图4)。肿瘤细胞内高表达的GSH还原CS-SS-D-pen的二硫键以释放D-pen。释放的游离D-pen通过一系列反应引发ROS的生成,释放DOX,实现了GSH响应性药物释放。
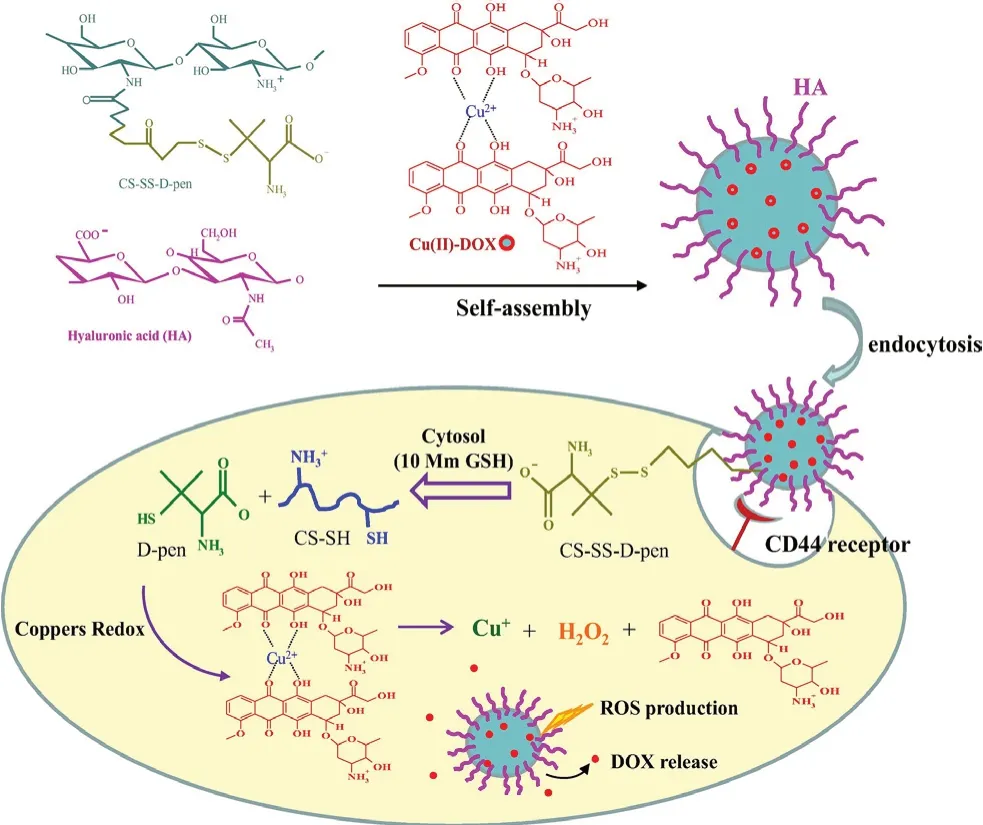
图4 靶向CD44和氧化还原触发的ROS产生和DOX释放[33]Fig 4 CD44-targeting and redox-triggered ROS production and DOX release[33]
Wang等[34]开发了分级响应的纳米药物(HRNM)用于化学疗法的程序化递送。HRNM是由环状RGD肽共轭三嵌段共聚物形成的,GDPC7A-POEG-PssCPT,由疏水性PC7A链,亲水性聚[低聚(乙二醇)单甲醚甲基丙烯酸甲酯](POEG)片段和疏水性多还原反应性喜树碱(CPT)前药(PssCPT)链组成。在细胞内高水平的GSH响应下,活性CPT药物将迅速释放,发挥抗肿瘤作用。
Liu等[35]通过将厚朴酚(HNK)和5,6-二甲基黄嘌呤酮-4-乙酸(DMXAA)的共轭物与GSH响应性纳米载体聚(α-硫辛酸)聚乙二醇结合,制备出一种新型的纳米药物。纳米药物在肿瘤部位高GSH水平时解体,实现了HNK与DMXAA在肿瘤部位的共同递送。通过HNK的近程杀伤和DMXAA的远距离杀伤,实现了4T1乳腺癌的联合治疗,其肿瘤抑制率达到93%,为肿瘤治疗提供了有价值的候选治疗方案。
Feng等[36]开发了一种有效的分步骨肉瘤(OS)靶向脂质体系统,将骨靶向部分阿仑膦酸盐(ALN)与HA(CD44的配体)缀合。该ALNHA共轭物通过生物可还原的二硫键(-S-S-)与DSPE-PEG2000-COOH偶联,获得功能化的脂质ALN-HA-SS-L,将其后插入装有DOX的预制脂质体中。一旦脂质体被肿瘤细胞内化,细胞内GSH就会通过-S-S-键的裂解促进聚合物从脂质体脱落,从而使药物从普通脂质体中释放出来。Li等[37]制备基于CD-PEG Azo-PCL的GSH/光双响应的新型超分子药物载体(简称CPAP)用于DOX的细胞内递送。癌细胞中高浓度的GSH可以刺激药物载体主动释放药物,从而有针对性地释放抗癌药物。而在GSH和光同时存在的情况下,载有药物的CPAP(CPAP @ DOX)显示出最快的药物释放,其有望成为抗癌药物的智能纳米载体。Lu等[38]基于宿主-客体的相互作用,制备了一种双重反应性靶向纳米颗粒药物递送系统,命名为DOX @ MSN-SS-N=C-HA,用于癌症治疗。MSN分别通过pH敏感的苯胺亚胺键和氧化还原敏感的二硫键经苯环修饰,通过载有化学治疗的药物DOX-CD负载了化学治疗药物DOX。载体进入癌细胞后,酸性环境以及高浓度的GSH导致载体迅速释放DOX用于细胞凋亡。
Yang等[39]制备了具有良好的生物相容性和可调稳定性的双交联PMAABACy/Fe(Ⅲ)-co-PEGMA950纳米凝胶装载化疗药物。共价交联结构的引入使载体对肿瘤细胞内高浓度的GSH敏感,诱导其结构转化,实现药物的释放,见图5。
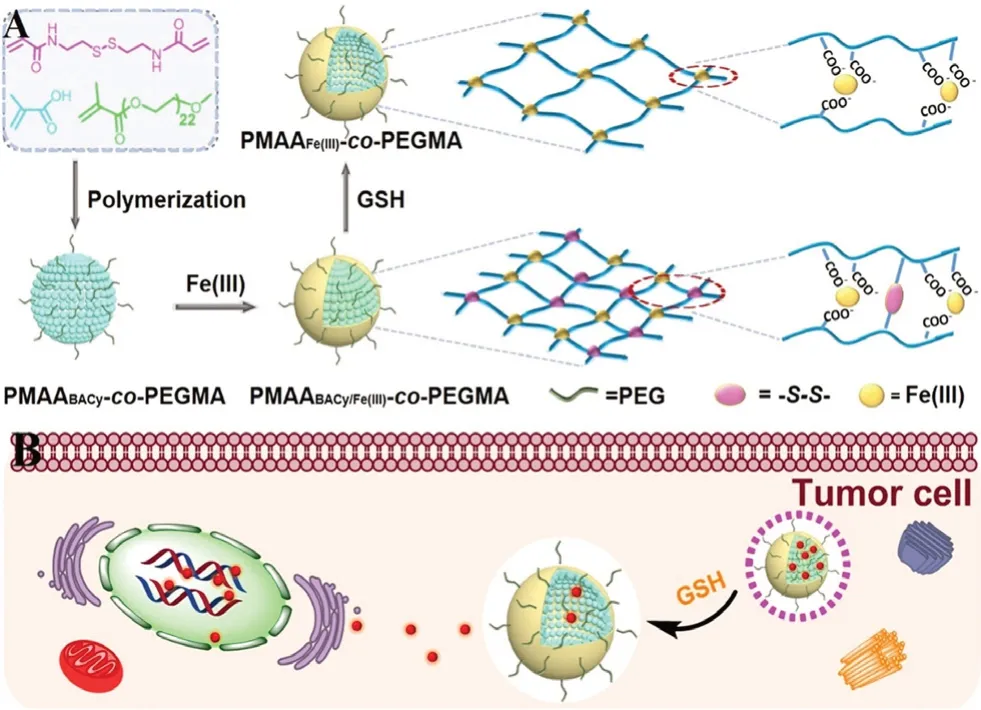
图5 PMAABACy / Fe(Ⅲ)-co-PEGMA950的制备(A)及其GSH诱导的结构转化和药物释放(B)示意图[39]Fig 5 Illustration of the preparation of PMAABACy/Fe(Ⅲ)-co-PEGMA950(A)and its GSH-induced structural transformation and drug release(B)[39]
Guo等[40]通过原位还原法用AuNPs修饰介孔二氧化硅纳米粒子,并引入了巯基修饰的聚乙二醇作为还原反应型“守门员”构建了MSN-Au-PEG纳米平台。体外数据表明,响应细胞间较高的GSH浓度,可以使MSN-Au-PEG @ DOX可控地释放负载的DOX。此外,修饰的AuNPs在550 nm处照射后可产生ROS,诱导肿瘤细胞凋亡。结合化学疗法和光动力疗法,MSN-Au-PEG @ DOX表现出增强的抗肿瘤效果,显示了未来联合疗法的巨大潜力。
夏颖等[32]设计合成了一种由肝癌细胞膜包覆的氧化还原敏感脂质体纳米粒,利用肝癌细胞膜的靶向作用准确到达肿瘤部位,并在肿瘤细胞内高浓度GSH 的作用下迅速断裂,释放所载药物。Maggini等[41]设计了含有二硫键(ss-NPs)的氧化还原反应性介孔有机硅纳米粒子,肿瘤细胞中高浓度的GSH可选择性激活细胞内的分解过程,有利于药物的释放。
1.2.3 高ROS响应 ROS包括超氧化物、过氧化氢和羟基自由基。ROS是癌症的重要信号分子,相比于正常细胞,在许多癌细胞系中,ROS水平升高[18]。肿瘤细胞中ROS代表性成分H2O2大量积累[42],因此,科学家们设计了多种基于H2O2响应的纳米载药系统,用于实现肿瘤靶向治疗,以减轻化疗的副作用,或增强其他疗法的治疗效果,如光动力疗法、氧化疗法等。除此以外,H2O2及其他肿瘤微环境特征双响应的纳米载药平台也是研究的热点。
He等[43]开发了一种细胞特异性的,可激活H2O2并生成O2改善PDT治疗的纳米颗粒(HAOP NP),它具有高度选择性,并且可以有效治疗癌症。纳米粒子装载光敏剂和过氧化氢酶,包裹含淬灭剂的聚合物外壳,并用肿瘤靶向配体c(RGDfK)进行修饰。当HAOP NP被富含αvβ3整联蛋白的肿瘤细胞选择性吸收后,细胞内的H2O2进入纳米粒子,由过氧化氢酶催化生成O2,从而导致外壳破裂并释放光敏剂,实现PDT治疗,同时HAOP NP在PDT过程中连续产生O2,大大提高了PDT在乏氧肿瘤中的疗效。
Ge等[44]报道了一种新型的过氧化氢响应的纳米药物平台。棕榈酸抗坏血酸酯(PA)是一种氧化强化剂。将喜树碱(CPT)聚合物前药胶束与PA共聚,在肿瘤细胞环境内响应产生H2O2,不仅能上调肿瘤内H2O2水平,增强肿瘤内氧化应激、实现氧化治疗,随后还可以实现自给自足的H2O2反应性药物释放,触发喜树碱释放实现化疗,从而实现新型的协同氧化疗法。
Xu等[45]设计了对过氧化氢及过氧亚硝酸盐响应的治疗急性髓系白血病(AML)的前药(SAHA)。通过用芳基硼酸基团修饰结构中的辛异羟肟酸部分,得到化合物5-82。化合物5-82在AML细胞内及病灶周围H2O2或过氧亚硝酸的活化作用下,形成酚中间体,随后通过1,6-消除作用释放出游离的SAHA和短寿命的化学反应性醌甲基化物(QM),达到治疗的目的,见图6。
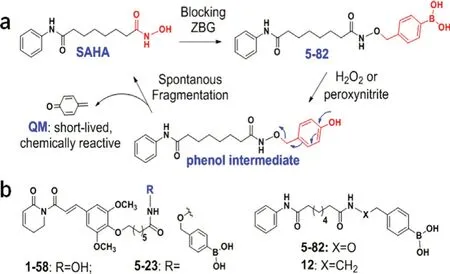
图6 芳基硼酸掩蔽的异羟肟酸前药的设计(b)及其激活机制图(a)(以SAHA和5-82为例)[45]Fig 6 Design of arylboronic acid-masked hydroxamic acid prodrug(b)and its activation mechanism exemplified with SAHA and 5-82(a)[45]
Wang等[46]设计并合成了ROS响应的FAPEG-TK-PLGA共聚物。聚合物自组装成稳定的小尺寸DDS。DDS中的叶酸(FA)用于靶向癌细胞,ROS可以迅速裂解DDS中的TK连接子,被包裹的DOX迅速释放到细胞质中,从而诱导口腔鳞状细胞癌(OSCC)细胞凋亡。亲水性PEG壳和疏水性PLGA核,在水溶液中表现出高稳定性,此外还具有足够的载药量和出色的ROS敏感性。该聚合物作为治疗OSCC的新型药物递送系统具有巨大的潜力。
Noh等[17]报道了一种H2O2/pH双响应的混合抗癌药物QCA,在癌细胞中释放醌甲基化物和肉桂醛。QCA经H2O2介导的硼酸酯氧化而释放QM(特别是C-B键会迅速断裂),并形成含有酚结构的化合物,酚盐会迅速自发地发生1,6-消除,形成QM。
Shu等[47]设计了一种H2O2/GSH双响应的硫缩酮纳米颗粒(TKN),用于紫杉醇(PTX)的药物递送。结果表明,纳米颗粒用H2O2或GSH处理后,药物的释放率大大增加,证实了纳米颗粒对H2O2及GSH的响应降解。而TKN降解所得的产物为硫辛酸和丙酮,具有生物可降解性。由此得到的双响应药物递送系统不仅可以提高生物利用度,同时也可减轻化疗的不良反应。
Shi等[48]合成了新型氧化还原双响应的基于两亲嵌段共聚物(ABP)并负载DOX的纳米颗粒(BSN-DOX)。结构中含有聚环氧乙烷的亲水性嵌段和带有二硫键连接的苯基硼酸酯基作为侧基的疏水性嵌段。苯基硼酸酯的自消去离去基团被肿瘤细胞外较高浓度的过氧化氢激活,随后通过1,6-消除反应迅速分解为对醌甲基化物,促使纳米颗粒的降解,使DOX从BSN-DOX中快速释放,达到可控治疗的目的。
2 结论
传统纳米递药系统存在着诸多问题,多年来,研究人员为改善纳米递药系统存在的诸如体内稳定性差、生物利用度低、代谢不稳定等问题,不断设计开发可实现靶向可控给药的纳米递药系统,如针对肿瘤微环境的特异性,对纳米载药系统或已有的治疗药物进行结构上的修饰或优化,希望在肿瘤部位或肿瘤细胞内响应性降解为生物小分子,减少毒性;同时可控地释放出药物,实现靶向治疗的目的。此外,研究人员结合肿瘤微环境也设计了双响应或多响应的纳米载药系统,实现氧化疗法、光动力疗法、化学疗法等多种疗法的互补及联合,最终得到响应性高、选择性好、制备简单、可生物降解、可控释放的纳米递药系统。当然,目前在载药系统的临床应用方面还有诸多挑战,如纳米材料在体内的毒性及安全性依然不能确定;大部分纳米载药系统的制备过程复杂,不适用于商业化生产;载药系统的质量、可靠性、稳定性不能保证等等。不过,也有一些纳米药物已经上市或是处于临床试验阶段,例如,NCT02043756、NCT00080418等,证明了纳米药物递送系统的可行性和重要性,相信在更多研究人员的努力下,纳米药物递送系统将能很好地应用到临床医学上,帮助解决一些治疗难题。
