Box-Behnken响应面法优化芍药甘草汤的提取工艺
2021-07-03刘蕾蕾刘冬涵张紫薇毕嘉谣钟宛凌杜守颖白洁北京中医药大学中药学院北京102488
刘蕾蕾,刘冬涵,张紫薇,毕嘉谣,钟宛凌,杜守颖,白洁(北京中医药大学中药学院,北京 102488)
芍药甘草汤出自东汉名医张仲景所著《伤寒论》,收录于国家中医药管理局公布的第一批《古代经典名方目录》,方由白芍、炙甘草组成,是仲景为误汗亡阳,阳复后的脚挛急证而设[1],目前,对芍药甘草汤的研究多集中在药理作用机制及临床应用方面,尚未见其有关其现代制剂工艺的研究报道。
根据规定,在经典名方现代制剂的开发过程中,必须以物质基准为核心抓手,保证现代制剂和传统汤剂质量属性的一致性[2]。提取工艺的参数优化不是以转移率为目标,而是通过关键质量属性保证提取物与物质基准的一致性[3]。用现代提取工艺开发制剂,调整工艺参数使其与古方用砂锅煎煮汤液的关键质量属性一致,是本试验的重点。
芍药甘草汤物质基准的关键质量属性包括芍药苷、甘草苷、甘草酸的含量,出膏率和指纹图谱相似度。质量标准是一个范围,响应面法可以通过给定的响应值范围确定在该范围内的因素水平,因此本文选择响应面法对其制剂工艺进行优化。首先确立物质基准的质量标准,然后选一批对应的饮片进行提取工艺的考察,以指标性成分含量和出膏率的综合评分为指标,在单因素试验的基础上,利用响应面法优化提取工艺,使提取液与物质基准对应实物的关键质量属性保持一致。
1 仪器与试药
JM-B10002电子天平(余姚市纪铭称重校验设备有限公司);BSA 224S电子分析天平、MC京制00000246号电子天平[赛多利斯科学仪器(北京)有限公司];KQ5200DA型数控超声波清洗器(昆山市超声仪器有限公司);Thermo Fisher U3000 高效液相色谱仪[DAD检测器,CM7.2色谱工作站,赛默飞世尔科技(中国)有限公司];HH-6型电热恒温水浴锅(北京科伟永兴仪器有限公司);DZF-6051型真空干燥器(北京利康达圣科技有限公司);G20型医用离心机(北京白洋医疗器械有限公司);FD-2A型真空冷冻干燥机(北京博医康试验仪器有限公司)。
白芍饮片(浙江磐安县,批号:20190801~20190805;四川中江,批号:20190901~20190905)和炒甘草饮片(自炮)经北京中医药大学刘春生教授分别鉴定为毛茛科植物芍药Paeonia.lactifloraPall.的干燥根、豆科植物甘草Glycyrrhiza uralensisFisch.的干燥根和根茎。
芍药苷(批号:110736-201842,含量:97.4%)、甘草苷(批号:111610-201607,含量:93.1%)、甘草酸铵(批号:110731-201720,含量:97.7%)(中国食品药品检定研究院);乙腈、甲醇、磷酸(Fisher,色谱级);纯净水(杭州娃哈哈集团有限公司)。
2 方法与结果
2.1 物质基准制备
称取白芍55.20 g、炒甘草55.20 g,加饮用水600 mL,武火煮沸转文火煎煮65 min(按古方考证之后的煎煮方式),300目尼龙筛网滤过,滤液放冷至室温,精密移取10 mL药液至30 mL西林瓶中,冻干72 h(冷凝器温度-86℃,样品温度-40.9℃,真空4 Pa),取出加塞压盖,即得物质基准对应实物。
2.2 物质基准特征图谱方法的建立
2.2.1 色谱条件 Purospher RP C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈(A)-0.1%磷酸水(B),梯度洗脱(0~6 min,95%B;6~10 min,95%→88%B;10~19 min,88%→85%B;19~25 min,85%→81%B;25~30 min,81%B;30~40 min,81%→75%B;40~50 min,75%→60%B;50~60 min,60%→50%B;60~65 min,50%→95%B);流速为1.0 mL·min-1;检测波长为230 nm;柱温为30℃;进样体积为5 μL。
2.2.2 供试品溶液的制备 取芍药甘草汤物质基准冻干粉1支,精密移取5 mL水复溶,超声处理(功率250 W,频率40 kHz)30 min,离心滤过,取续滤液,即得。
2.2.3 精密度考察 取同一份供试品溶液,按“2.2.1”项下色谱条件连续进样6次,测定其指纹图谱,图谱导入《中药指纹图谱相似度计算软件》(2012版本)进行分析,计算图谱之间的相似度,结果均大于0.99,表明仪器精密度良好。
2.2.4 重复性考察 取同一批次供试品溶液6份,按“2.2.1”项下色谱条件平行进样,测定其指纹图谱,计算图谱之间的相似度,结果均大于0.99,表明该法测定的重复性良好。
2.2.5 稳定性考察 取同一份供试品溶液,按“2.2.1”项下色谱条件,分别于0、3、6、9、12、24 h进样测定,计算不同图谱之间的相似度,结果均大于0.99,表明供试品溶液在24 h内稳定性良好。
2.2.6 16批物质基准指纹图谱研究 将10批白芍(浙江磐安5批、四川中江5批)与10批炒甘草(内蒙古鄂尔多斯)饮片随机组合,按“2.1”项下方法制备16批物质基准,取物质基准冻干粉样品适量,按“2.2.2”项下方法制备供试品溶液,按“2.2.1”项下色谱条件测定,得HPLC指纹图谱,见图1。对色谱图进行全谱峰匹配,相似度在0.939~0.998,相似度良好,说明物质基准制备工艺稳定。
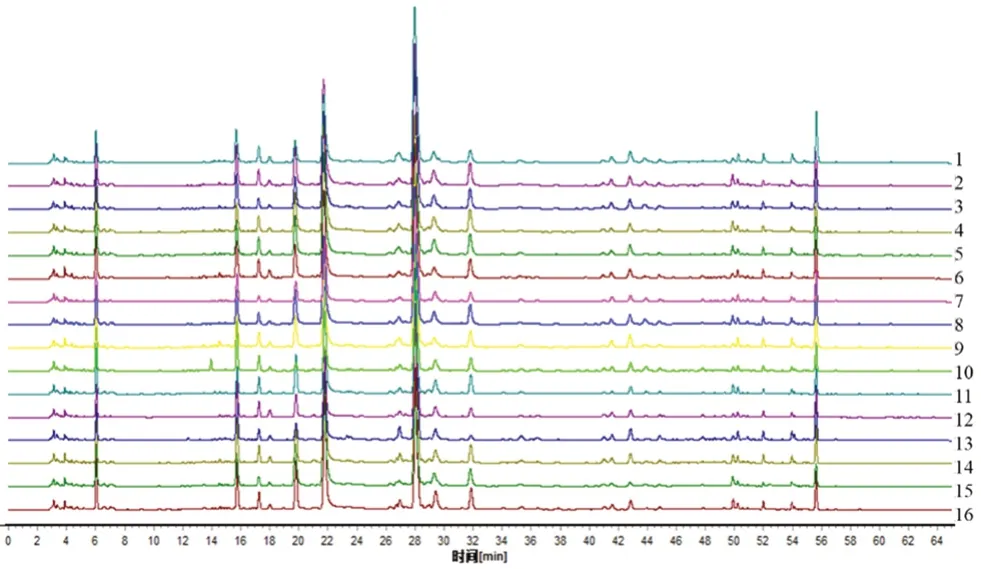
图1 16批芍药甘草汤物质基准指纹图谱Fig 1 HPLC fingerprints of 16 batches of Shaoyao Gancao decoction substance benchmark
2.3 物质基准中芍药苷的含量测定
2.3.1 色谱条件 采用Purospher RP C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈-0.1%磷酸溶液(17∶83)等度洗脱;流速为1.0 mL·min-1;检测波长为230 nm;柱温为30℃;进样体积为5 μL。
2.3.2 对照品溶液的制备 精密称取芍药苷对照品15.05 mg置于5 mL量瓶中,加甲醇溶解并定容,得到质量浓度为 2.93 mg·mL-1的对照品母液。将对照溶液母液用甲醇稀释,分别配制成质量浓度为0.14、0.36、0.90、1.50、1.88、2.35 mg·mL-1的芍药苷对照溶液。
2.3.3 供试品溶液的制备 取冻干粉约0.3 g,精密称定,置5 mL量瓶中,甲醇溶解后超声(功率250 W,频率40 kHz)处理30 min,放冷,用甲醇定容至刻度,摇匀,滤过,取续滤液即得。
2.3.4 方法学考察 根据2020年版《中国药典》[4]分析方法验证指导原则,按“2.3.1”项下色谱条件进行芍药苷含量测定的方法学考察。结果表明仪器精密度、供试品溶液稳定性(24 h内)、重复性、加样回收率及方法专属性均良好(见表1及图2)。
2.3.5 物质基准中芍药苷的含量 取16批芍药甘草汤物质基准样品,按“2.3.2”项下方法制备供试品溶液,按“2.3.1”项下色谱条件测定,每批平行3份,取平均值,结果见表2,芍药苷含量在0.54%~1.00%,均值为0.77%。
2.4 物质基准中甘草苷、甘草酸的含量测定
2.4.1 色谱条件 采用Purospher RP C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈(A)-0.05%磷酸水(B)梯度洗脱(0~8 min,86%B;8~15 min,86%→82%B;15~20 min,82%B;20~35 min,82%→50%B;35~36 min,50%→0%B),流速为1.0 mL·min-1;检测波长为237 nm;柱温为30℃;进样体积为5 μL。
2.4.2 甘草苷、甘草酸混合对照品溶液的制备精密称定甘草苷20.17 mg、甘草酸铵23.05 mg,置10 mL量瓶中,70%乙醇溶解并定容,即得含甘草苷1877.83 μg·mL-1、甘草酸2206.31 μg·mL-1的混合对照品母液。精密移取混合对照品溶液母液,用70%乙醇稀释,分别配制一系列质量浓度的甘草苷、甘草酸对照溶液,测定峰面积,绘制标准曲线。
2.4.3 供试品溶液的制备 取冻干粉约0.3 g,精密称定,置5 mL量瓶中,加入70%乙醇,超声处理30 min,放冷,定容至刻度,摇匀,滤过,取续滤液即得。
2.4.4 方法学考察 根据2020年版《中国药典》[4]分析方法验证指导原则,按“2.4.1”项下液相条件进行甘草苷、甘草酸含量测定的方法学考察。结果表明仪器精密度、供试品溶液稳定性(24 h内)、重复性、加样回收率及方法专属性均良好(见表1及图2)。
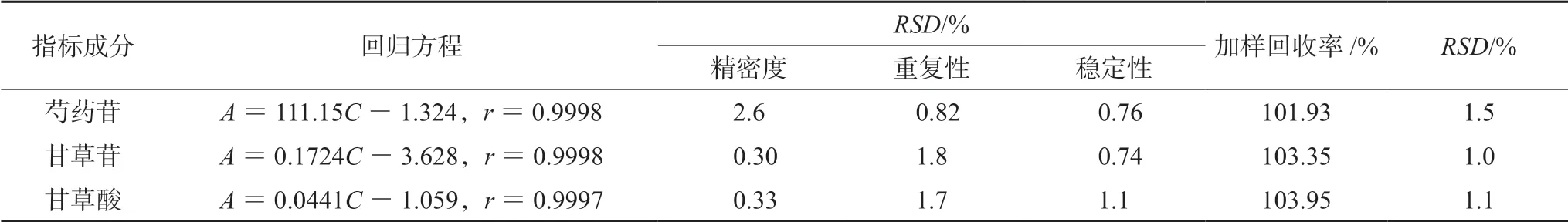
表1 芍药甘草汤物质基准中指标成分含量测定的方法学考察Tab 1 Methodology on determination of index components in substance benchmark of Shaoyao Gancao decoction
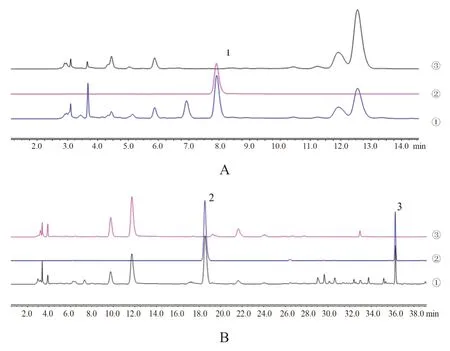
图2 芍药苷(A)和甘草苷、甘草酸(B)专属性测定色谱图Fig 2 Chromatogram of specificity determination of paeoniflorin(A)and liquiritin and glycyrrhizinic acid(B)
2.4.5 物质基准甘草苷、甘草酸的含量 取16批芍药甘草汤物质基准样品,按“2.4.2”项下方法制备供试品溶液,按“2.4.1”项下色谱条件测定,每批平行3份,取平均值,结果见表2。结果表明16批物质基准中甘草苷含量在0.45%~0.75%,均值为0.60%,甘草酸含量在0.38%~0.64%,均值为0.51%。
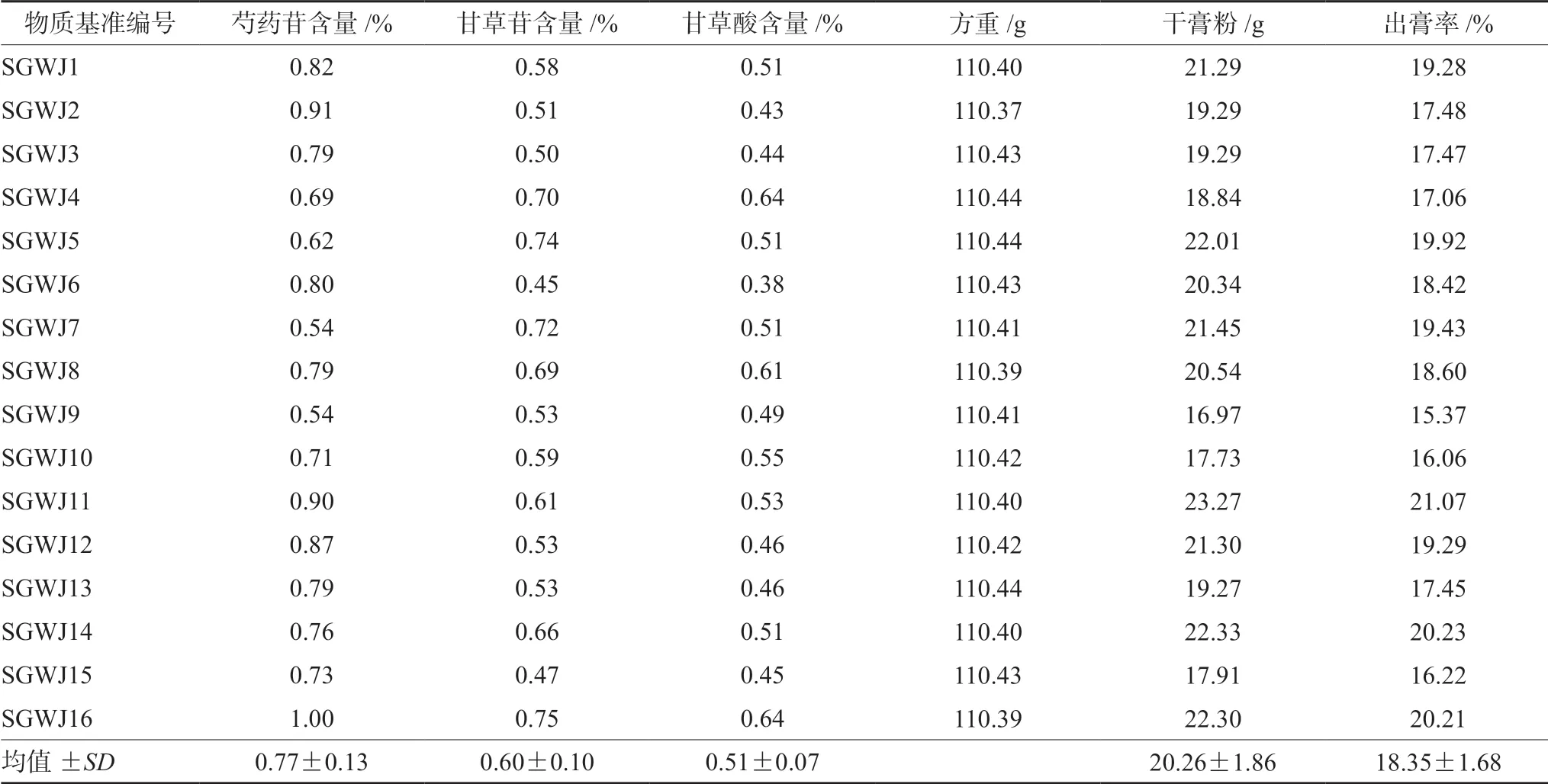
表2 16批物质基准指标性成分含量测定及出膏率结果Tab 2 Content of index components and dry extract rates of 16 batches of substance benchmark
2.5 物质基准出膏率测定
精密移取煎煮后药液100 mL,转移至已知重量的蒸发皿中,60℃减压干燥,称重,计算出膏率。公式为出膏率=m/M×100%,式中m表示干膏粉的质量,M表示饮片初始质量(方重),结果见表2。16批物质基准的出膏率在15.37%~21.07%,均值为18.35%。
2.6 提取液各指标的测定
称取白芍55.20 g、炒甘草55.20 g,置于合适圆底烧瓶中,加入一定体积的饮用水回流提取,300目尼龙筛网滤过,放冷至室温,饮用水补足体积,精密移取水液3 mL至10 mL离心管中,10 000 r·min-1离心5 min,取上清液进样。测定芍药苷、甘草苷、甘草酸的含量及出膏率。
2.7 单因素试验初步筛选提取工艺
为尽可能客观地反映各个因素对芍药甘草汤提取工艺的影响,拟采用综合加权评分法,将各个指标以综合评分(OD)的形式进行考察,对综合评分进行直观分析[5-6]。各指标的权重系数均为0.25,综合评分(OD)=0.25×(芍药苷含量+甘草苷含量+甘草酸含量+出膏率)
根据文献[7-10]和实际经验,以综合评分为指标,选定提取时间(0.5、1、1.5、2、3 h)和加水倍量(5、10、15、20倍)进行单因素考察,结果如图3所示。可以看出随提取时间加长,综合评分逐渐增加,提取2 h后评分增加渐缓,所以将响应面提取时间高水平定为2 h;加水倍量在5~20倍时,综合评分随加水量的增大而增加,加水至20倍时超出物质基准70%~130%的综合评分范围,所以将加水倍量高水平定为15倍。

图3 各因素对综合评分的影响Fig 3 Effect of various factors on the comprehensive score
2.8 Box-Behnken 法优化芍药甘草汤提取工艺
按照 Box-Behnken试验设计基本原理,在前期单因素试验结果的基础上,优化选取加水倍量(A)、提取次数(B)和提取时间(C)3 个影响因素,以芍药苷、甘草苷、甘草酸含量及出膏率的综合评分为评价指标,根据 Box-Benhnken中心组合试验设计原理,设计3因素3水平17个试验点的响应面分析,其中12个析因点,5个中心点,试验设计因素及水平见表3。

表3 响应面试验设计因素及水平表Tab 3 Factor and level
2.8.1 Box-Behnken试验结果 根据Box-Benhnken试验设计方案进行试验,每组平行3次,结果见表4。
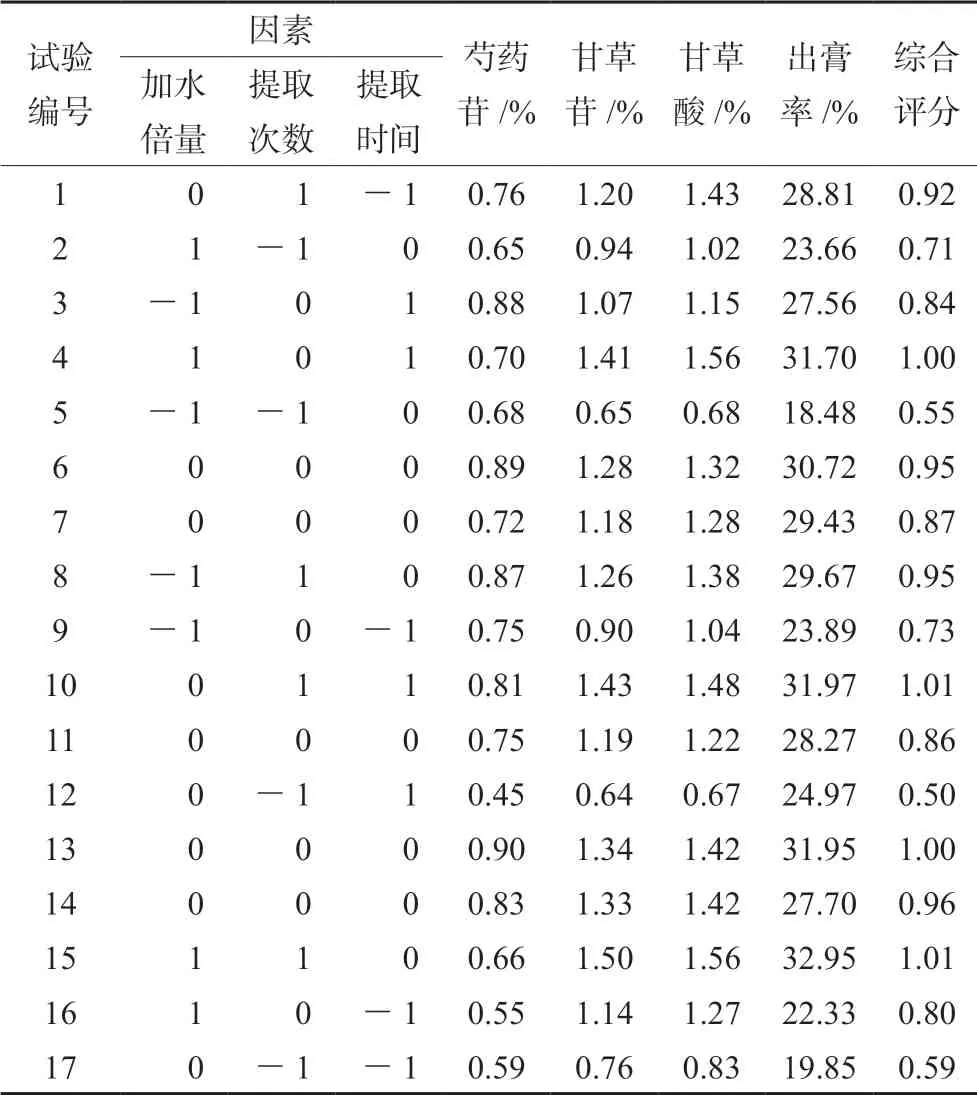
表4 Box-Behnken 试验设计及结果Tab 4 Box-Behnken design and results
2.8.2 模型的建立与显著性检验 采用 Design-Expert 10 软件对结果进行模型拟合,拟合分析结果见表5,由结果可知有两个模型的拟合结果的P值均小于0.05,根据有多个拟合模型结果显著时,选择最高阶多项式模型的原则,故而选择二阶多项式模型进行方程拟合。

表5 多种模型拟合分析Tab 5 Multiple model fitting analysis
对拟合模型进行ANOVA方差分析,由表6可知,回归方程使用的模型P<0.05,表明此模型有效可靠。失拟项是用来表示模型与试验拟合的程度,本次模型的失拟项P值为0.3766>0.05,表明该模型无失拟因素存在,模型与实际值能较好地拟合。模型相关系数R2=0.9357,说明该模型能解释93.57% 响应值的变化;调整决定系数adj-R2=0.8531,说明可信度较好,可以运用该模型分析。回归方程为:综合评分=0.93+0.055A+0.19B+0.039C-0.025AB+0.022AC+0.046BC-0.017A2-0.10B2-0.066C2。

表6 回归模型方差分析结果Tab 6 ANOVA of the regression model
该模型中,因素A、B、B2的P<0.05或P<0.001,表明加水倍量和提取次数对综合评分的影响较显著,各因素对综合评分的影响顺序为提取次数>加水倍量>提取时间。此外,各影响因素之间还存在交互作用。不同交互因素与综合评分的响应面分析见图4。图4A及图4B的响应面图坡度较陡,表明加水倍量与提取次数时间、提取次数与提取时间交互作用较强,对综合评分的影响显著,图C 的响应面图坡度平缓,表明加水倍量与提取时间的交互作用较弱,对综合评分的影响较小。
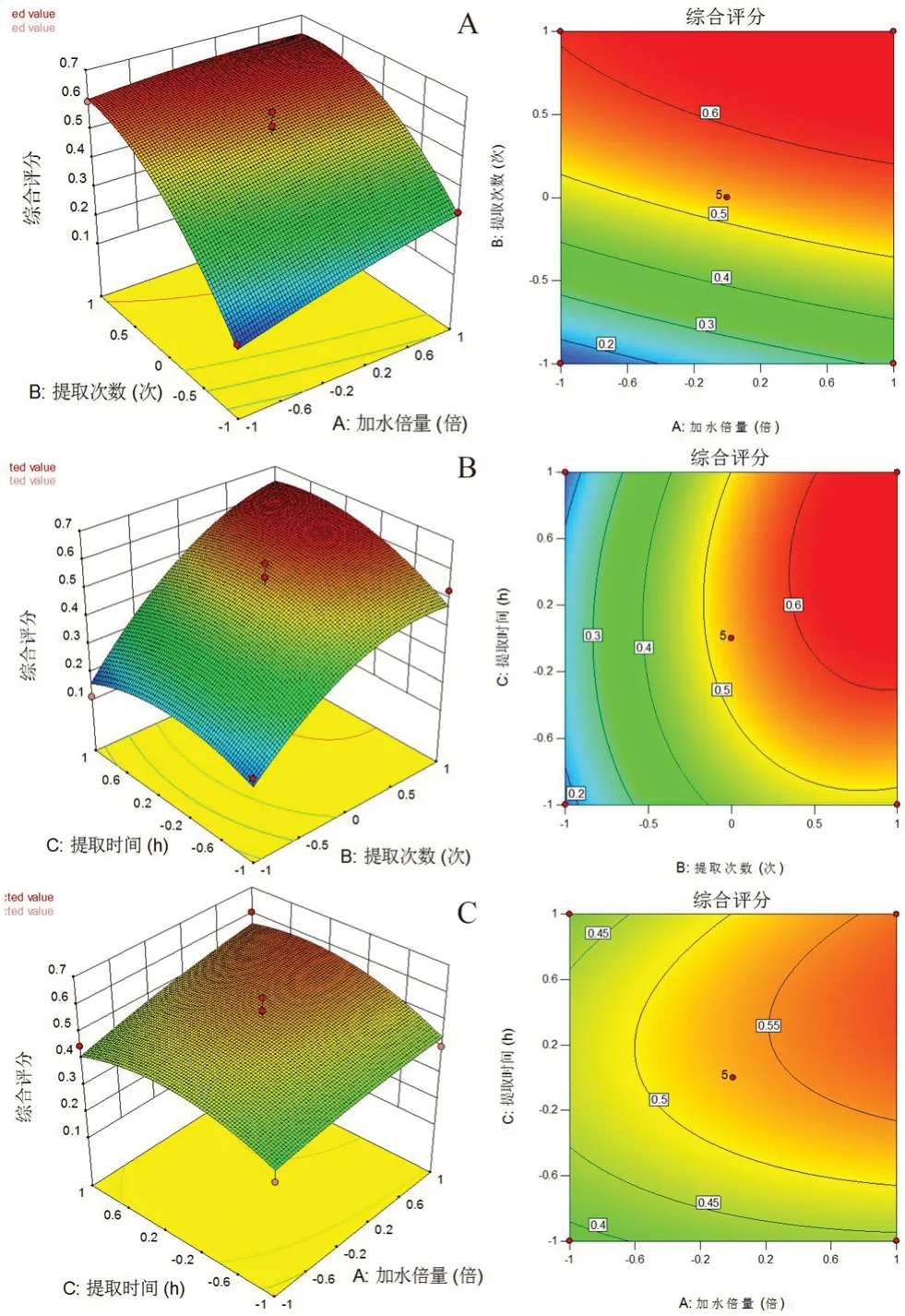
图4 各因素交互作用对综合评分影响的响应面图和等高线图Fig 4 Response surface and contour plot of interactive effect on the comprehensive score
2.8.3 优选工艺的预测与验证 采用Design-Expert 10软件对提取工艺进行优化,根据物质基准标准的70%~130%质量离散范围,将各指标范围均定离散范围内,综合评分的范围限制为高为0.362,低为0.670,得到最优工艺预测为加水5.134倍,提取1.016次,提取时间为0.555 h,此条件下计算的理论综合评分为0.510。为方便实际试验操作,将最佳工艺调整为加水5倍,回流40 min提取1次,验证提取工艺的可行性。
经过3次验证试验测得的芍药苷、甘草苷、甘草酸单处方含量均值分别为0.61%、0.61%、0.64%,出膏率均值为17.68%,综合评分为0.508,与响应面法预测值相接近,同时也在物质基准标准的70%~130%的离散范围内,3次验证试验指纹图谱的对照图谱(S1)与物质基准标准的对照图谱(S2)相似度比较结果为0.997(见图5),均符合质量要求。
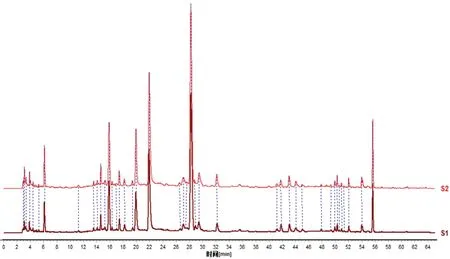
图5 芍药甘草汤物质基准(S2)与验证试验(S1)图谱Fig 5 Chromatogram of the substance benchmark(S2)and verification experiment(S1)of Shaoyao Gancao decoction
3 讨论
物质基准的质量控制包括指标性成分含量、特征图谱相似度以及出膏率3个指标,前期考察发现药材的产地与批次差异对汤剂的指纹图谱影响不大,同时17次响应面试验的指纹图谱相似度均大于0.95,所以综合评分的设立不包括指纹图谱相似度,只需验证试验时与物质基准对应实物的相似度。
在综合评分的比例分配上,由于本方只有两味药材,包含3个指标性成分,均在药典考察之列,所以重要程度相当,同时因为出膏率会影响后续制得颗粒的服用量,所以综合评分设立了4个指标,每个指标占比相同。
在单因素试验的设计上,结合经验与文献初步筛选影响芍药甘草汤提取工艺的因素,发现加水倍量、提取时间、提取次数3个因素对含量和出膏影响较大,故而将这3个因素作为响应面的设计因素。此外一般提取次数增加到一定程度时,药材中的有效成分已基本提取完全,再增加提取次数也难以使成分含量有较大改变[11]。所以直接将提取次数3个水平设定为1、2、3次。
响应面法是一种综合试验设计和数学建模的优化方法,可有效减少试验次数,并可直观体现影响因素之间的交互作用[12]。通过响应面法优选提取工艺时,软件给出的最优工艺在实际生产中并不能实现,综合考量之后将加水量定为5倍,同时延长了提取时间变为40 min,而芍药苷具有热不稳定性[13],可能是导致实际获得芍药苷比预测值偏低的原因,而甘草苷、甘草酸含量以及出膏率都与最佳工艺预测值相当,表明响应面法预测的可靠性。直观分析里第12组响应面试验综合评分为0.50,与预测的0.51也较接近,但可能由于加热时间太长使得芍药苷含量减少低于物质基准标准范围,所以舍弃。考虑到后续颗粒剂的质量,对提取液浓缩干燥后的干膏粉进行了含量测定,也在物质基准范围内,在确定了提取这个对含量影响最大的工艺后,后续可以通过略微调整浓缩干燥工艺进一步调整干膏粉的含量,以确保最终得到的制剂与芍药甘草汤剂质量一致。应用响应面法优化法得到的芍药甘草汤提取工艺稳定可靠,与物质基准质量一致,可以作为后续颗粒剂的提取方法。
