丹参总酚酸复合磷脂脂质体制备工艺研究
2021-07-03嵇晶潘旻程建明南京中医药大学药学院南京210023
嵇晶,潘旻,程建明(南京中医药大学药学院,南京 210023)
丹参总酚酸(total salvianolic acids,TSA)是从唇形科植物丹参Salvia miltiorrhizaBge的干燥根及根茎中提取的水溶性成分,是丹参的主要有效成分,其中丹酚酸B(Sal B)是含量最高的活性成分。研究表明,TSA具有抗氧化[1]、抗血栓[2-3]、保护各脏器[4-5]和抗肿瘤[6]等作用。临床用于治疗心脑血管疾病,主要剂型为起效迅速、生物利用度高的注射剂。水溶性的TSA吸收消除较快,无法长时间维持较高的血药浓度,本文拟以脂质体为载体提高其生物利用度[7-9]。
脂质体由磷脂材料组成,是一种具有类生物膜的磷脂双分子层结构的闭合囊泡,自1974年英国Gregoriadis等[10]首先将脂质体用于药物载体后得到广泛应用。脂质体也存在如载药量偏低、储存过程中药物易泄露等限制其发展的问题。复合磷脂制备技术由美国科学家报道[11],通过同时使用低相变温度和高相变温度的不同磷脂为膜材,制得具有高药物包封率、高稳定性、药物不易泄漏的复合磷脂脂质体,有效解决传统脂质体易泄漏等问题。丹酚酸类成分存在口服吸收差、消除快、生物利用度低的问题,本试验研究TSA口服脂质体的制备工艺,以提高其生物利用度。
关于TSA的脂质体制备工艺已有报道,如马金国等[12]以逆向蒸发法结合超滤离心制备了Sal B脂质体,包封率达到71.0%;张丽红等[13]以逆向蒸发法制备的脂质体TSA包封率为72.0%,Sal B包封率为68.6%。但目前的制备工艺均以单一不饱和卵磷脂制备,存在稳定性不够、药物易泄漏的问题。传统的脂质体制备仅优选出一种磷脂材料,只有一个相变温度(Tm),而复合磷脂脂质体可通过对磷脂种类和比例的筛选,灵活地调节Tm。本试验分别选用Tm高于40℃和低于30℃的两种磷脂酰胆碱作为膜材料,以制备Tm在31~37℃内的复合磷脂脂质体,提高脂质体的稳定性。
1 材料
1.1 试药
TSA中间体(自制,丹酚酸B和迷迭香酸含量分别是83.08%、3.22%,批号:20170925);大豆磷脂(SPC,纯度>90%,批号:SYSI-170501)、氢化大豆磷脂(HSPC,纯度>98%,批号:B50541)、胆固醇(CHO-HP,纯度>99.0%,批号:B61251)(药用注射级,艾韦拓医药科技有限公司;葡聚糖凝胶G50(100~300 nm,上海源叶科技有限公司,批号:S31673);Sal B对照品(上海源叶科技有限公司,纯度:98%,批号:Y26O7H23683);其余试剂均为分析纯。
1.2 仪器
Waters e2695高效液相色谱仪、Waters 2489 UV检测器(美国Waters公司);BT 125D型电子分析天平(德国塞多利斯公司);JY92-Ⅱ超声波细胞粉碎机(宁波新芝生物科技股份有限公司);1100D-WD旋转蒸发仪(上海爱朗仪器有限公司);STP FA2004型电子分析天平(上海上平仪器有限公司);Zetasizer Nano Zs 90纳米粒径测定仪(英国马尔文公司);Diamond DSC功率补偿型高灵敏度差示扫描量热仪(美国Perkin Elmer公司);DZF-6050型真空干燥箱(上海精宏试验设备有限公司);UV-7504紫外分光光度计(上海精密仪器仪表有限公司)。
2 方法
2.1 制备方法选择
根据文献报道[13],脂质体的制备以逆向蒸发法为宜,即称取处方量的磷脂与胆固醇溶于适宜的有机溶剂中,然后加入溶有药物的缓冲液,探头超声直至形成均匀乳剂,转移至茄形瓶中,减压旋转蒸发除去有机溶剂,再加缓冲液水合,继续减压蒸发,即得复合磷脂脂质体的水性混悬液。
2.2 磷脂比例筛选
2.2.1 空白复合磷脂脂质体制备 采用逆向蒸发法制备空白复合磷脂脂质体。固定处方磷脂总量为100 mg,精密称定不同比例的HSPC(Tm约50℃)与SPC(Tm约20℃),比例分别为9∶1、3∶1、1∶1、1∶3、1∶9(W/W),以6 mL氯仿溶解于15 mL离心管中,缓慢加入2 mL pH值为7.4的磷酸盐缓冲液(PBS),探头超声成均匀乳剂,50℃旋蒸除去有机溶剂成膜,减压干燥除尽有机溶剂,加入PBS缓冲液3 mL水合,500 W探头超声40次,超声5 s停3 s,过0.22 µm滤膜,即得空白复合磷脂脂质体。
2.2.2 高灵敏度差示扫描量热法(HSDSC)研究 精密吸取15 μL的空白复合磷脂脂质体,置于标准铝埚中,加盖密封,以PBS为对照,测定复合磷脂脂质体的Tm和相变峰半峰宽。以Tm范围窄、Tm在31~37℃为优。
2.2.3 粒径测定 精密吸取100 μL脂质体,以PBS稀释10倍,摇匀,置于比色皿中,利用测定其平均粒径,结果见表1。由表1可见,复合脂质体粒径随着SPC比例的增大而增大,最大粒径都在200 nm以内。从Tm来看(在31~37℃最优)仅HSPC/SPC比例为3∶1时才能达到。由以上结果固定两种磷脂比例为3∶1,对TSA脂质体的制备工艺做进一步研究。

表1 TSA复合磷脂脂质体的磷脂比例筛选结果Tab 1 Screen of HSPC/SPC ratio for total salvianolic acid composite phospholipid liposome
2.3 水合介质选择
根据张丽红等[13]的研究,Sal B在酸性条件下表观油水分配系数较大,降低水合介质的pH值可减少水合时脂质体中药物的泄漏,提高药物包封率,选择pH值为4.00的甘氨酸-盐酸溶液为水合液包封率较高。
2.4 有机溶剂考察
脂质体制备工艺中通常选用挥发性较好的有机溶剂作为有机相,如氯仿、甲醇、乙醇、乙醚等。固定处方中HSPC∶SPC=1∶3,磷脂∶胆固醇=4∶1,有机相与水相体积比为3∶1,药脂比1∶20,按逆向蒸发法制备,超声5 min,观察乳剂稳定性,旋蒸除去有机溶剂,加入pH值为4.00的甘氨酸-盐酸溶液水合,结果见表2。处方中HSPC、SPC两种磷脂与胆固醇在乙醇中溶解性比较差,未进一步考察成膜与水合情况,综合考虑成乳情况和成膜、水合情况,选用氯仿为有机溶剂成膜效果比较好。

表2 TSA复合磷脂脂质体的有机溶剂考察Tab 2 Organic solvents for total salvianolic acid composite phospholipid liposome
2.5 葡聚糖凝胶柱层析洗脱曲线及包封率测定
脂质体包封率(EE%)的测定方法,包括高速离心法、透析法、凝胶柱层析法、离子交换树脂法等,在实验室现有条件下,选择以葡聚糖凝胶G50分离TSA脂质体与游离药物,参考文献[8],以乙醇溶解脂质体,通过紫外分光光度法测定TSA含量;以5%的Triton X-100溶解脂质体,通过HPLC法测定Sal B含量。色谱图如图1所示,Triton X-100对测定无影响。
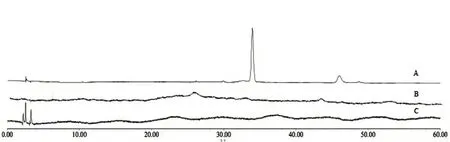
图1 辅料干扰性测定 HPLC色谱图Fig 1 HPLC chromatogram of liposome accessories interference
以HSPC与SPC比例为1∶3、胆固醇与复合磷脂比例为1∶4、丹酚酸冻干粉中间体与磷脂的比例为1∶20制备脂质体,精密吸取1 mL的脂质体过Sephadex G-50柱(1 cm×20 cm),以水合液为洗脱剂,分份收集,每2 mL为一流份,测定紫外吸光度,绘制洗脱曲线如图2所示。

图2 葡聚糖凝胶柱层析洗脱曲线Fig 2 Elution curve of glucosamine gel column layer
由洗脱曲线可以看出,脂质体部分集中在前6个流份,游离药物在脂质体部位之后出来,根据洗脱曲线收集2~6流份为脂质体部位,收集7~15流份为游离部位。考虑到葡聚糖凝胶柱层析分离的过程使脂质体稀释,分离的游离药物中指标成分含量较低无法测定,另取未处理的脂质体以无水乙醇溶解,并以空白脂质体稀释相同倍数为对照,测定脂质体中TSA总浓度和未分离的脂质体混悬液中TSA的浓度,计算TSA的包封率。另取未处理的脂质体,以5%的Triton X-100破乳,稀释后测定脂质体中Sal B的总浓度和混悬液中Sal B的浓度。
TSA包封率EE(%)=脂质体中TSA浓度/脂质体混悬液中TSA浓度×100%
SalB包封率EE(%)=脂质体中SalB浓度/脂质体混悬液中SalB浓度×100%
2.6 药脂比考察
固定处方中复合磷脂的用量,胆固醇和复合磷脂的比为1∶4,HSPC/SPC为1∶3,水合介质为pH值为4.00的甘氨酸-盐酸溶液,水化时间30 min,按丹酚酸冻干粉中间体与磷脂的比例分别为1∶10、1∶20、1∶30和1∶40制备脂质体,分别测定脂质体中Sal B与TSA的包封率。结果见表3。由表3可知,药脂比对复合磷脂脂质体的包封率有较大影响,药脂比越大包封率越小,即加入的药量过多时,超过处方中复合磷脂的药物负荷量,包封率降低,综合考虑复合磷脂脂质体的药物包封率与载药量,选择药脂比为1∶20。

表3 丹参总酚酸复合磷脂脂质体的药脂比考察Tab 3 Drug lipid ratio of total salvianolic acid composite phospholipid liposome
2.7 脂类浓度考察
固定处方中复合磷脂的用量,胆固醇和复合磷脂的比为1∶4,HSPC/SPC为1∶3,药脂比为1∶20,分别加入不同体积的氯仿,使磷脂质量浓度分别为5、10、15和20 mg·mL-1,制备脂质体并测定包封率。结果见表4。由表4可知,磷脂质量浓度处于较低水平时,所得的复合磷脂脂质体性质比较稳定,并且澄清度好,但药物的包封率比较低、载药量较小;磷脂质量浓度较高时,复合磷脂脂质体稳定性较差,易产生白色絮状沉淀,但包封率和载药量较高。可以看出,磷脂质量浓度在10~15 mg·mL-1时TSA包封率较高。

表4 丹参总酚酸复合磷脂脂质体的磷脂浓度考察Tab 4 Phospholipid concentration of total salvianolic acid composite phospholipid
2.8 正交试验优化脂质体制备工艺
在丹参总酚酸复合磷脂脂质体制备工艺单因素试验的基础上,以复合磷脂脂质体中Sal B与TSA的包封率与载药量综合评分(0.25∶0.25∶0.25∶0.25)为考察指标,选取对包封率影响较大的磷脂与胆固醇比例、有机相与水相体积比、药脂比、磷脂浓度4个因素为正交考察对象,各因素取3个水平进行正交试验设计。试验设计及结果见表5~7。

表5 正交试验因素与水平Tab 5 Factor and level for orthogonal test
载药量%=脂质体中药物含量/载药脂质体的总重量×100%
由表6直观分析表可知,4种因素对丹参总酚酸复合磷脂脂质体包封率与载药量的影响程度为D>C>B>A,因此药脂比是对包封率影响最大的因素,其次是磷脂浓度、有机相/水相比例、磷脂/胆固醇。根据正交试验结果,丹参总酚酸复合磷脂脂质体最佳制备工艺为A1B2C1D2,即磷脂与胆固醇质量比为3∶1、有机相与水相体积比为4∶1、药脂比为1∶15、磷脂浓度为12.5 mg·mL-1。表7方差分析结果表明,TSA冻干粉中间体与磷脂的比例对复合磷脂脂质体的包封率与载药量有显著影响。
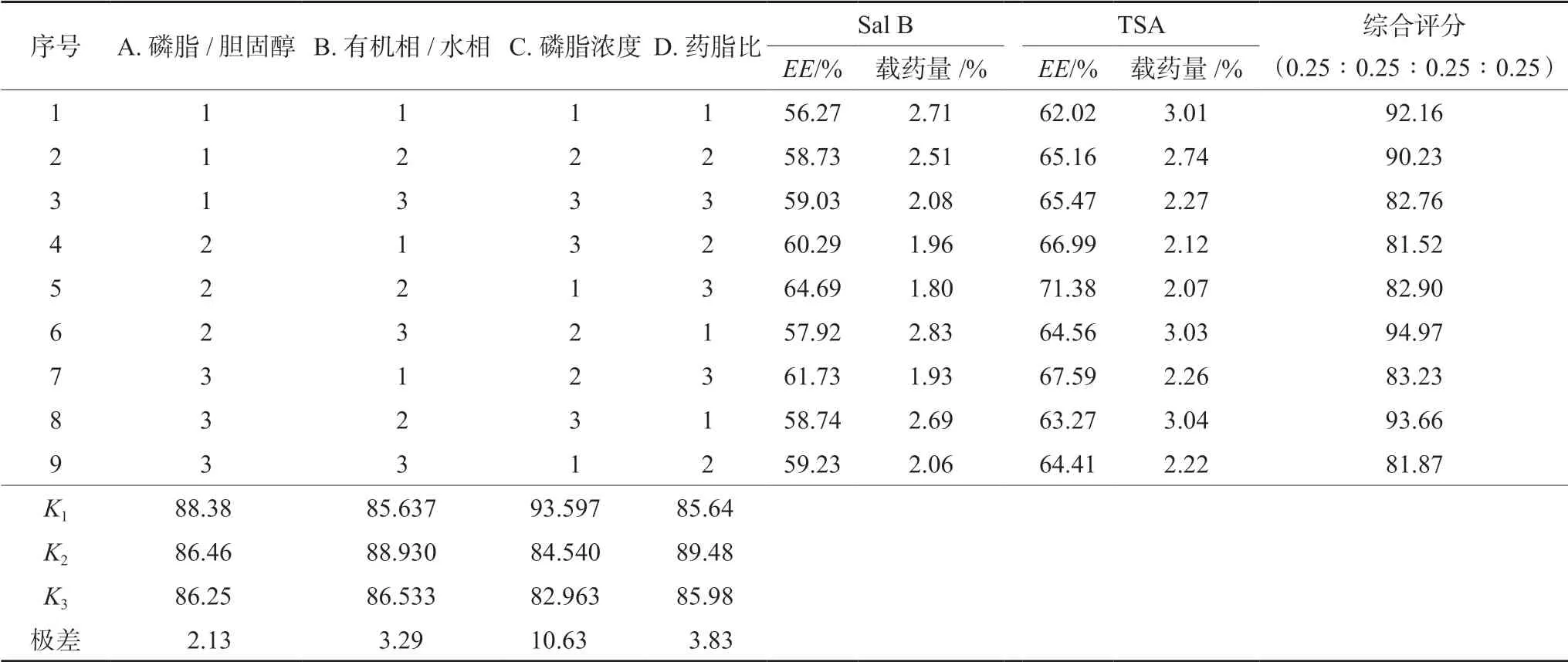
表6 正交试验设计与结果Tab 6 Orthogonal test design and results
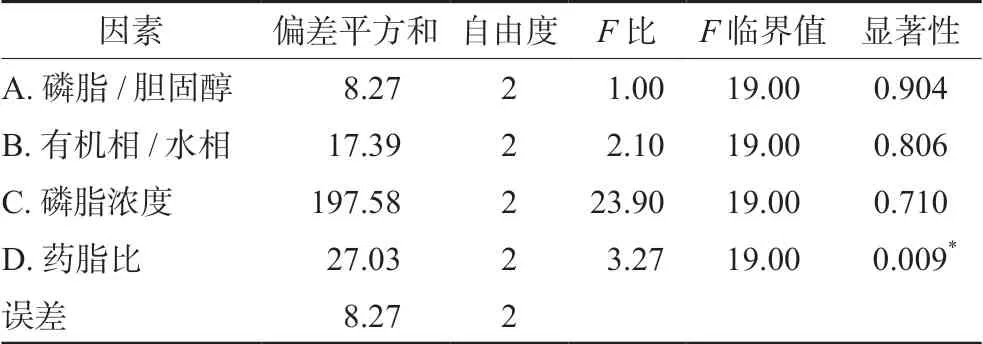
表7 方差分析结果Tab 7 Variance analysis
2.9 丹酚酸复合磷脂脂质体制备工艺验证
依据单因素和正交试验优选的最佳工艺条件,即采用逆向蒸发法制备,处方中 HSPC/SPC为1∶3,磷脂/胆固醇为3∶1,以氯仿溶解,脂类质量浓度为12.5 mg·mL-1,缓慢加入溶有TSA冻干粉的pH值为7.4的磷酸盐缓冲液,药脂比为1∶15,有机相与水相体积比为4∶1,探头超声成均匀乳剂,50℃旋蒸除去有机溶剂成膜,减压干燥除尽有机溶剂,加入pH值为4.0的甘氨酸缓冲液水合,500 W探头超声40次,过0.22 μm微孔滤膜,即得TSA复合磷脂脂质体。制备3批TSA复合磷脂脂质体,分别测定其包封率与载药量,并测定其粒径。结果如表8所示。最佳制备工艺得到的TSA复合磷脂脂质体粒径分布均匀,Sal B与TSA的平均包封率分别可达60.08%和69.45%,其中载药量以TSA计达2.92%,3批样品批间差异较小,工艺合理稳定。

表8 TSA复合磷脂脂质体工艺验证Tab 8 Verification of composite phospholipid liposome preparation technology
2.10 复合磷脂脂质体表征
以磷钼酸复染法,在投射电镜下观察空白复合磷脂脂质体与总酚酸复合磷脂脂质体的形态,结果如图3所示。

图3 丹参总酚酸复合磷脂脂质体的透射电镜图Fig 3 TEM of total salvianolic acid composite phospholipid liposome
3 讨论与小结
水溶性药物的油水分配系数受pH值的影响较大,制备脂质体一般存在包封率较低、易泄漏的问题,本文采用逆向蒸发法,选择高Tm磷脂HSPC和低Tm磷脂 SPC制备复合磷脂脂质体,以酸性甘氨酸缓冲液水合,可制得包封率更高、更稳定的丹参总酚酸脂质体。
本研究设计初期参考“双丹脂质体”的水化温度选择最适宜工业生产的常温制备脂质体[14]。有学者研究了水化温度及水化pH值对于包封率的影响,结果显示水化温度及水化pH对于包封率的影响居后[15]。张小灵等[15]运用3种计算方式分析不同因素对双丹脂质体包封率的影响,3种计算结果均证实了水化温度对包封率的影响居次位。优化试验结果显示最佳水化温度为35℃,是试验设计的最低水化温度,如增加常温组为对照则更有可对比性。考虑大生产的成本问题,本文没有考察不同水化温度对于包封率及载药量的影响,是本文的不足之处。从包封率结果来看,与文献[13]报道包封率结果相近,载药量结果下降明显。单从原料药材方面比较,本课题组通过优化提取浓缩及柱分离方法得到纯度分别达到82.48%、91.64%的Sal B与TSA,优于文献报道结果,但是文献对于载药量的具体计算过程没有给出,单从结果无法定义优劣。药典规定常温保存的温度为10~30℃,而人体内温度通常为 37℃,目前还没有Tm在30~40℃内的磷脂材料,通过复合磷脂脂质体技术可以制备Tm在30~37℃内的脂质体,则常温保存时温度低于Tm,脂质体膜处于胶晶相,药物不易泄漏,保证了药物的稳定性;给药后温度高于Tm,则脂质体膜转变为液晶相,被封闭的标识物的漏出量增加。脂质体的相变行为决定了其在生物体内的行为,在体内漏出药物保证了药物的生物利用度,丹参总酚酸复合磷脂脂质体可以兼顾药物的有效性与稳定性。
