吲哚菁绿-磷酸钙纳米粒的制备与质量评价
2021-07-03王杰戴俊东王静鞠佳芮郭鹏川朱笑颜姜临霞北京中医药大学北京102488
王杰,戴俊东,王静,鞠佳芮,郭鹏川,朱笑颜,姜临霞(北京中医药大学,北京 102488)
吲哚菁绿(ICG)是一种近红外(NIR)荧光染料,因其光学特性和良好的生物相容性,被美国FDA批准作为造影剂用于临床荧光成像和光声成像。同时,ICG 分子能够吸收近红外光,将之转化为热能和单线态氧,可用于光热治疗(PTT)和光动力治疗(PDT)。然而 ICG 的水不稳定性、光降解性、热降解性和易于与脂蛋白结合导致体内快速被清除(血液半衰期 2~4 min)等,限制了其在肿瘤诊疗方面的应用[1-3]。近年来,纳米技术的快速发展为这一问题的解决提供了技术支持。负载ICG的多功能纳米材料在控释药物、提高药物生物稳定性、利用度和增强药物输送的靶向性等方面具有诸多优势,在肿瘤早期诊疗领域有较大的应用前景[4-5]。
人和动物实体瘤的 pH 数据显示,正常组织中细胞外pH和血液pH恒定在7.4,超过80%的肿瘤细胞pH低于正常组织,范围在5.7~7.0[6]。肿瘤细胞内的内涵体和溶酶体具有更强的酸性(pH 4~6)。因此,酸性 pH 被认为是特异性触发抗肿瘤药物释放的理想条件[7]。研究表明,pH敏感型纳米载体可通过响应正常组织与肿瘤组织之间微小的pH差异,增强药物在肿瘤细胞处的靶向特异性,促进纳米药物进入肿瘤细胞,在降低不良反应的同时提高化疗药物的疗效。
磷酸钙纳米载药体系是一种典型的pH响应体系,具有良好的生物相容性和生物可降解性[8],在生物医药领域有着广泛的应用,包括基因转染[9]、基因沉默[10]、药物载体[11-12]、生物成像[13]等方面。磷酸钙在血液(pH 7.4)中几乎不溶解,在弱酸性病理环境(pH 5~6)中,则会加速溶解,促进药物释放,从而提高靶向部位药物疗效,降低正常组织毒性与不良反应[14]。这些特性使磷酸钙纳米载药体系成为一种更优良的药物载体。
本课题拟借鉴肿瘤靶向 pH 敏感纳米结构响应机制,制备具有 pH 敏感性的吲哚菁绿-磷酸钙纳米粒(ICG-CaP/NPs),并对其进行质量评价。为 ICG-CaP/NPs 的肿瘤靶向治疗,以及经肺给药对缺血性心脏病的靶向研究奠定基础。
1 仪器与试药
1.1 仪器
BSA223S-CW电子分析天平(德国赛多利斯科学仪器有限公司);IKA RT10高效10点加热磁力搅拌器(德国IKA公司);pH计[奥豪斯仪器(上海)有限公司];Sigma 1-6P小型台式低速离心机(德国赛多利斯科学仪器有限公司);ZetaSizer Nano-ZS马尔文粒径检测仪(英国马尔文仪器有限公司);Alpha 2-4 LD plus冷冻干燥机(德国Martin Christ仪器有限公司);JEM-1400 Plus 120kV高衬度透射电子显微镜(日本电子株式会社);756PC型紫外可见分光光度计(上海舜宇恒平科学仪器有限公司)。
1.2 试药
ICG对照品(上海源叶生物科技有限公司,纯度≥95%);卵磷脂(上海麦克林生化科技有限公司,纯度>90%);Mili-Q高纯水,无水乙醇、甲醇、无水氯化钙、十二水合磷酸氢二钠、二水合柠檬酸钠、氢氧化钠、磷酸、正庚烷均为分析纯(北京化工厂)。
2 方法
2.1 Box-Behnken响应面法优选ICG-CaP/NPs最佳制备工艺
2.1.1 试验设计与结果 通过查阅文献确定以氯化钙为钙源,磷酸氢二钠为磷源,柠檬酸钠为稳定剂和晶体调节剂,共沉淀法制备吲哚菁绿磷酸钙纳米粒。固定氯化钙溶液(100 mmol·L-1)与柠檬酸钠溶液(400 mmol·L-1)各5 mL混合,磷酸氢二钠浓度120 mmol·L-1。
本试验以粒径(粒径分布在50~100 nm)、载药量及包封率为评价指标,Ca/P、pH值、ICG加入量为考察因素,基于Box-BehnKen试验设计建立了3因素3水平的试验模型,考察ICG-CaP/NPs制备工艺并进行响应面优化分析,试验设计见表1。
取氯化钙溶液(100 mmol·L-1)与柠檬酸钠溶液(400 mmol·L-1)各5 mL混合,搅拌5 min;按表1的设计加入相应ICG和Na2HPO4,反应5 min,0.1 mol·L-1NaOH调对应pH,再搅拌5 min,反应液置于3500 Da纤维素透析袋,500 mL高纯水,400 r·min-1透析6 h,透析液冻干,即得ICGCaP/Nps冻干粉。采用Design Expert.V8.0.6.1进行模型拟合,并通过相关系数r2等对拟合模型进行评价,根据回归方程确定最佳制备工艺。
2.1.2 验证试验 按照“2.1.1”项下方法和确定的最佳制备工艺制备ICG-CaP/NPs,平行操作3份,测定其粒径、载药量和包封率,进行最佳工艺的验证试验。
2.2 最优处方制剂质量评价
2.2.1 微观形态 取 ICG-CaP/NPs 样品适量,用Mili-Q 纯化水稀释后,取少量滴至200目铜网上,1~2 min后滤纸吸去多余液体,再向铜网表面滴加1滴2%(w/w)磷钨酸溶液负染2 min,滤纸吸去多余液体,自然晾干,于透射电子显微镜下观察纳米粒粒径大小、形态及分布、纳米粒之间是否聚集。
2.2.2 粒径分布及Zeta电位的测定 采用动态散射纳米粒度仪测定CG-CaP/NPs的粒径及其分布、Zeta电位,重复测量3次。
2.2.3 DSC的测定 取ICG原料药、空白磷酸钙纳米粒、ICG原料药与空白磷酸钙纳米粒物理混合物和ICG-CaP/NPs适量,进行 DSC 分析。扫描温度0~280℃,扫描速度10℃·min-1,氮气流量50 mL·min-1,观察ICG-CaP/NPs中ICG的存在形态。
2.2.4 载药量与包封率的测定 精密称取ICGCaP/NPs 5 mg于5 mL量瓶中,加0.4%磷酸适量超声溶解,甲醇定容。采用紫外分光光度计在782 nm处测定样品吸光度,计算药物的载药量及包封率,计算公式如下:载药量(%)=纳米粒中包封的ICG质量/包封ICG的纳米载体的总重量×100%;包封率(%)=纳米粒中包封药物质量/投入的总药量×100%。
2.2.5 体外释放度 采用透析法进行药物释放行为的研究,具体试验操作过程如下:分别精密称量制备的磷酸钙纳米粒冻干粉80 mg,两份,精密吸取1.0076 mg·mL-1的ICG对照品溶液0.5 mL,两份,样品和对照品分别加入pH 7.4和5.5的磷酸盐缓冲溶液(PBS)25 mL溶解搅拌均匀。将4份溶液分别置于分子截留量3500 Da纤维素透析袋中,400 r·min-1磁力搅拌下透析,透析液500 mL,于0,1,2,4,8,12 h取透析袋中溶液测吸光度,取样后补等量相应空白缓冲液,计算释放量,并绘制曲线。
3 结果
3.1 Box-Behnken响应面法优选ICG-CaP/NPs最佳制备工艺
3.1.1 模型拟合 将表1试验数据运用Design Expert.V8.0.6.1 进行模型拟合,并通过相关系数r2等对拟合自模型进行评价,得出因变量粒径(Y1)与3个自变量Ca/P比值(A)、pH(B)、ICG加入量(C)的二次多项回归方程如下:Y1=73.50-31.29A+30.86B+3.93C-6.60AB+20.58AC+22.93BC+29.38A2+21.67B2+2.20C2,r2=0.9799,方差分析结果F=37.96,P<0.01(见表2);因变量载药量(Y2)与3个自变量Ca/P比值(A)、pH(B)、ICG加入量(C)的二次多项回归方程如下:Y2=1.31-0.029A+0.065B+0.00625C+0.062AB+0.01AC+0.0025BC-0.28A2-0.20B2-0.22C2,r2=0.9842,方差分析结果F=48.39,P<0.01(见表3);因变量包封率(Y3)与3个自变量Ca/P比值(A)、pH(B)、ICG加入量(C)的二次多项回归方程如下:Y3=66.57-6.41A+2.18B+1.40C+7.17AB-1.38AC+1.17BC-8.46A2-5.85B2-4.80C2,r2=0.9407,方差分析结果,F=12.33,P<0.01(见表4)。因变量粒径(Y1)、载药量(Y2)和包封率(Y3)分别与3个自变量Ca/P比值(A)、pH(B)、ICG加入量(C)的方差分析结果表明,模型具有显著差异性;失拟项不显著,说明该模型拟合度和可信度均有效,试验误差小,可以用此模型对ICG-CaP/NPs的制备工艺进行分析和预测。
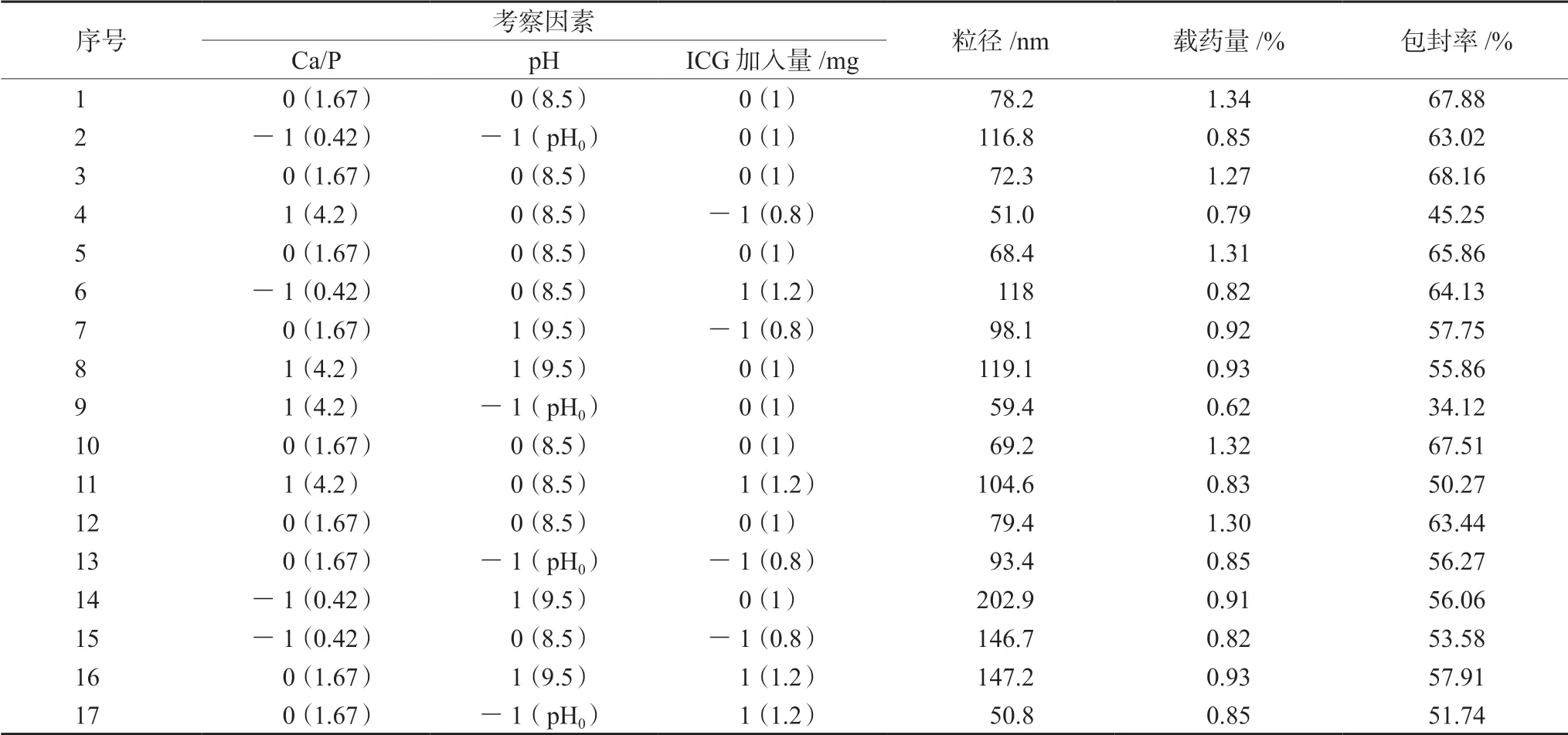
表1 Box-Behnben 中心组合方法试验设计及结果Tab 1 Design and results of Box-Behnben test
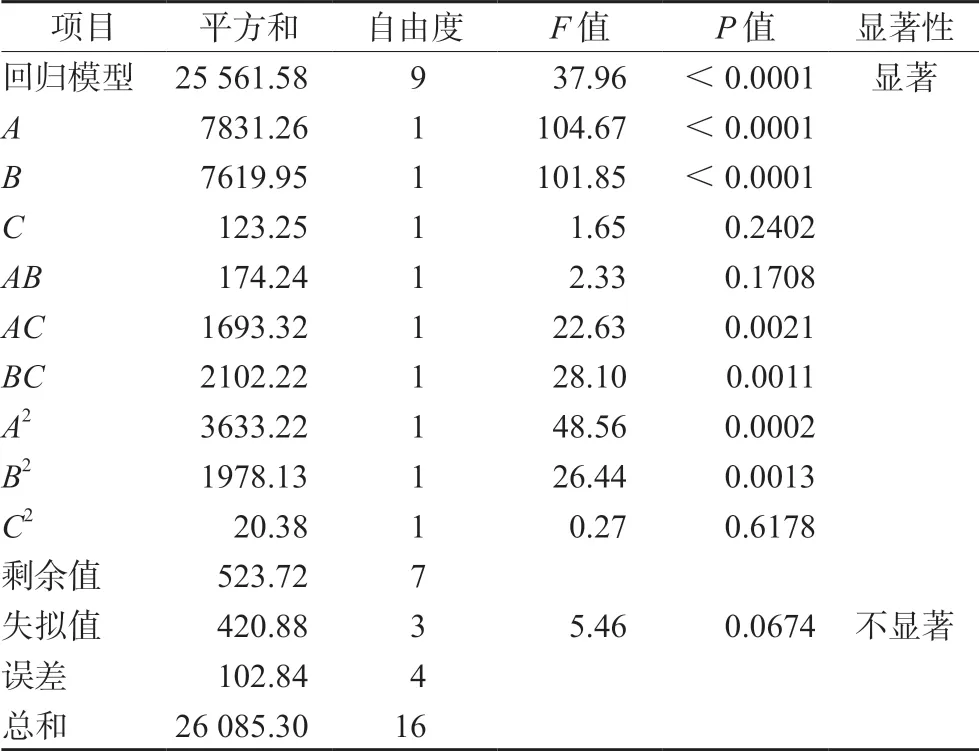
表2 粒径二次多项回归方程的ANOVA分析Tab 2 ANOVA of regression equation of particle size
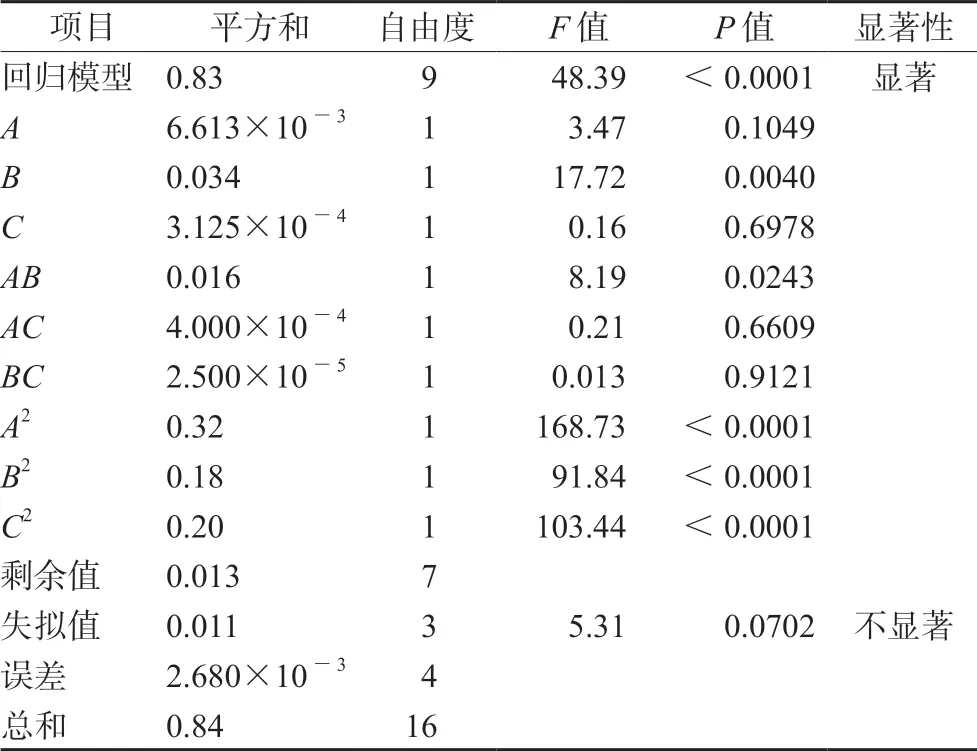
表3 载药量二次多项回归方程的ANOVA分析Tab 3 ANOVA of regression equation of drug loading
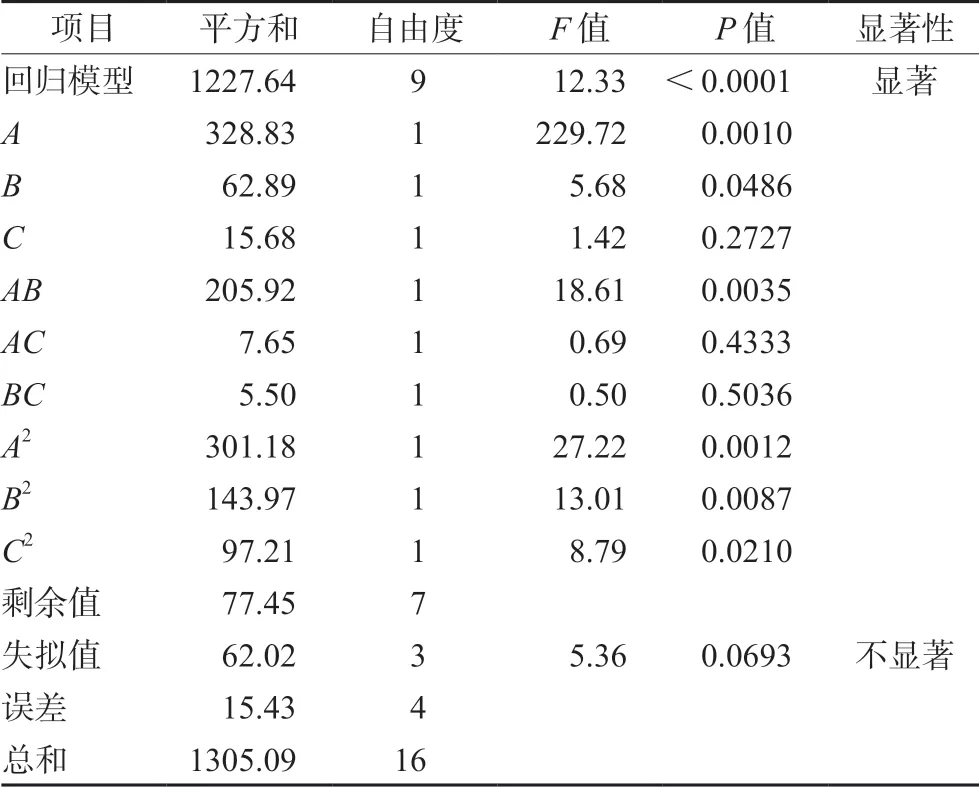
表4 包封率二次多项回归方程的ANOVA分析Tab 4 ANOVA of regression equation of encapsulation efficiency
3.1.2 模型优化分析 根据拟合方程,通过Design Expert.V 8.0.6.1 软件绘制ICG-CaP/NPs制备工艺评价指标随因素变化的等高线图和响应面图(见图1)。由等高线图可以看出,钙磷比和pH对载药量和包封率的影响成抛物线,即在一定范围内,随ICG用量和pH的增加,载药量和包封率均呈现先增大后减小的趋势,当钙磷比一定时,粒径随pH的增大而增大,两者成正相关。
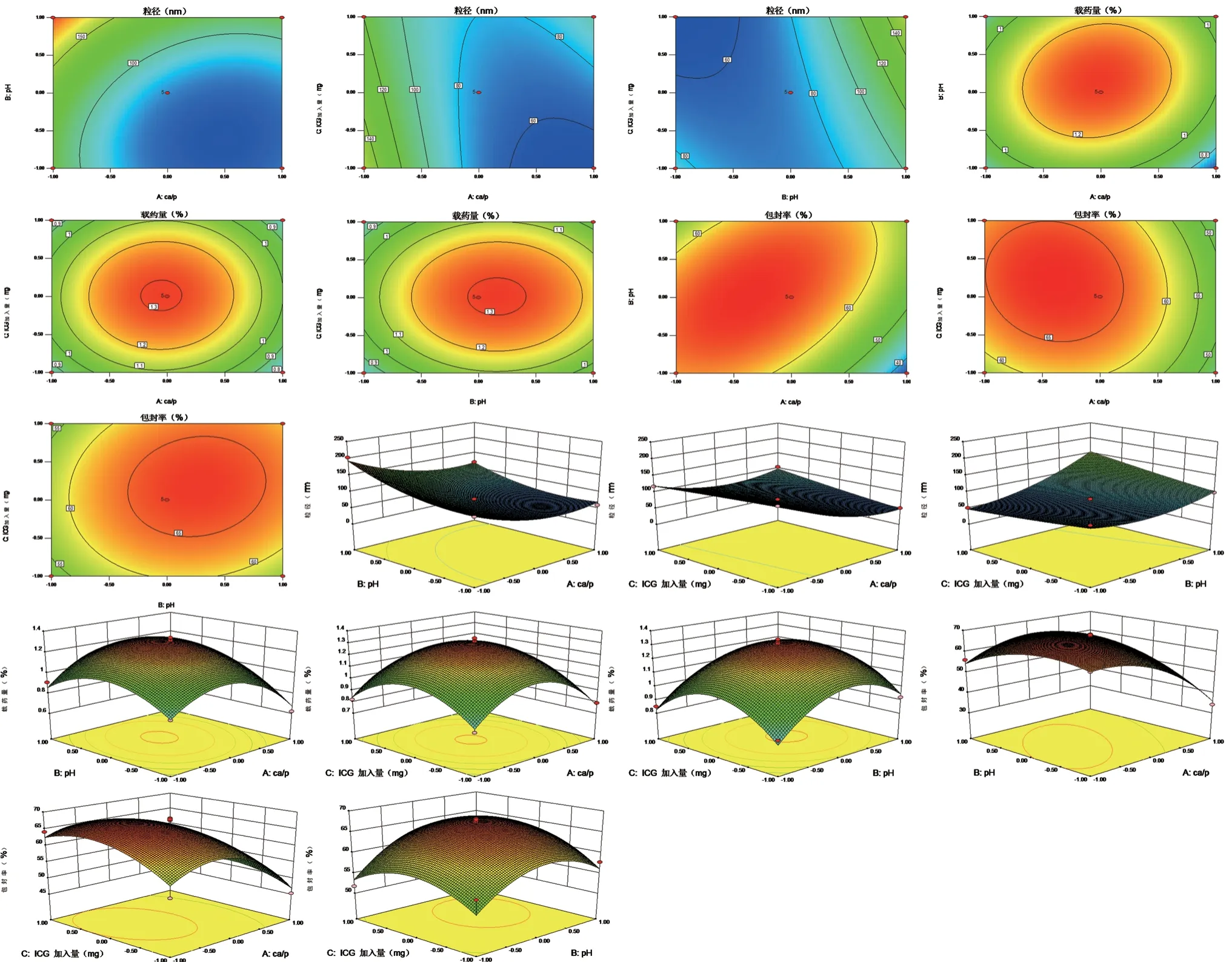
图1 自变量A~C的等高线图和相应曲面图Fig 1 Contour plot and response surface diagram of A~C
3.1.3 验证试验 根据“3.1.1”和“3.1.2”中的模型拟合结果和模型优化分析,选取响应值粒径(50~100 nm),载药量和包封率最大为优选条件,得到 ICG-CaP/NPs 制备工艺的预测值见图2,预测最佳工艺得到的粒径为80 nm,包封率和载药量分别为67.37%、1.31%。综合考虑粒径、载药量和包封率,确定 ICG-CaP/NPs 的最佳制备工艺为 Ca/P 比值1.67、pH 8.5、ICG加入量1 mg。按照优化的处方平行重复 3 次,得ICG-CaP/NPs平均粒径(73.5±4.5)nm,包封率和载药量分别为(64.94±1.31)%、(1.32±0.02)%。与预测值较为吻合,表明所建立的模型预测性良好,该工艺条件稳定可行。
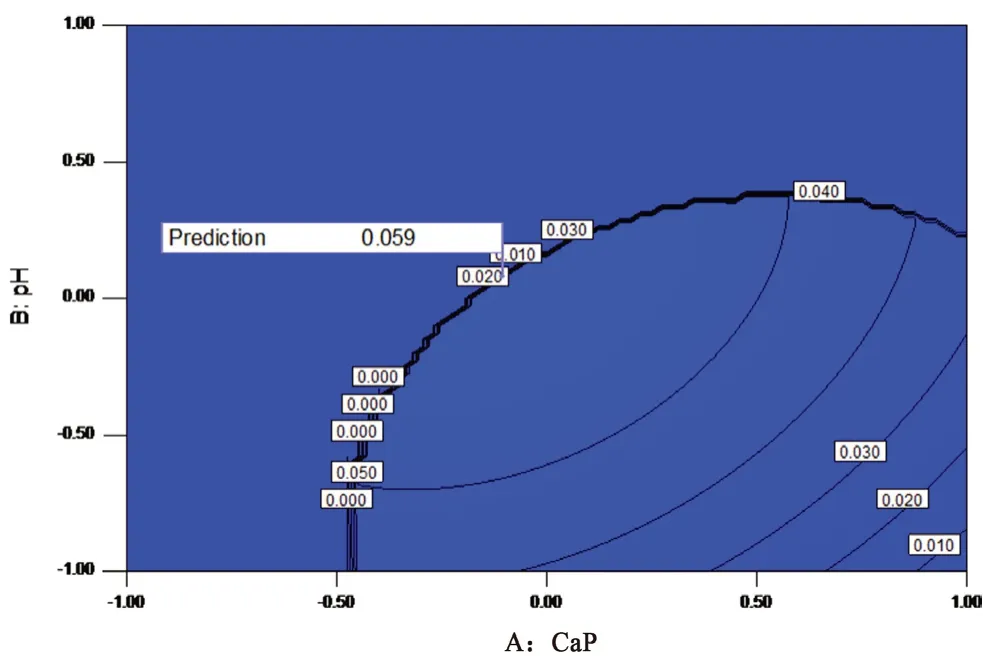
图2 ICG-CaP/NPs制备工艺预测值Fig 2 Predictive value of preparation processing of ICG-CaP/NPs
3.2 最优处方制剂质量评价
3.2.1 微观形态 图3可知,ICG-CaP/NPs 在形态上呈球形或类球形,形态规则,大小较均匀,纳米粒之间无聚集,粒径大小在50~100 nm。

图3 ICG-CaP/NPs透射电镜图(2000×)Fig 3 Transmission electron microscopy of ICG-CaP/NPs(2000×)
3.2.2 粒径分布及Zeta电位的测定 结果显示ICG-CaP/NPs粒径为(73.5±4.5)nm,PDI值为0.204,粒径分布均匀,Zeta电位为(-41.0±1.8)mV,结果见图4。
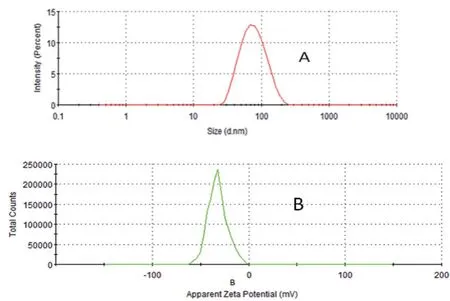
图4 ICG-CaP/NPs粒径(A)和Zeta电位(B)图Fig 4 Particle distribution(A)and Zeta potential(B)distribution of ICG-CaP/NPs
3.2.3 DSC测定 由图5可知,ICG原料在 243℃处有1个很明显的放热峰,对应于ICG 的熔点;而且ICG与空白CaP/NPs物理混合在 243℃处也有1个很明显的放热峰;而ICG-CaP/NPs 在243℃处没有ICG的峰,而且也无新的峰出现。由此说明,ICG 在纳米粒中以无定型状态存在。
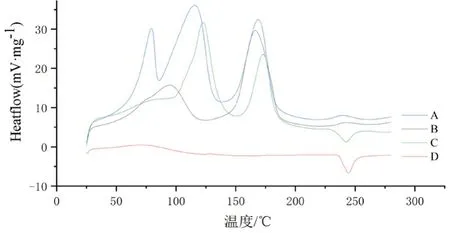
图5 ICG-CaP/Nps(A)、空白CaP/Nps(B)、空白CaP/NPs与ICG物理混合物(C)及ICG原料(D)的DSC图Fig 5 DSC of ICG-CaP/Nps(A),blank CaP/Nps(B),physical mixture of blank CaP/Nps and ICG(C),and ICG(D)
3.2.4 载药量和包封率的测定 ICG-CaP/NPs的平均包封率和载药量分别为(64.94±1.31)%、(1.32± 0.02)%,ICG-CaP/NPs 具有较高的包封率,但载药量较低,推测其可能原因是其载药能力主要依靠磷酸钙的物理吸附和钙离子与 ICG 中磺酸基的结合,吸附作用和离子键结合较弱,长时间透析容易解离。
3.2.5 体外释放度 由图6可知,ICG-CaP/NPs 在pH 5.5 条件下的释放速率与对照品溶液释放趋势基本一致,12 h累积释放量达 59.21%,远高于 pH 7.4时的释放速率。由此可知,磷酸钙纳米粒中药物的释放具有 pH 敏感性。在 pH 5.5 时释放完全,在 pH 7.4 条件下具有缓释作用。pH 5.5 条件下,ICG-CaP/NPs的释放度高于 ICG 对照品溶液,可能与纳米粒对 ICG 稳定性的保护作用有关。
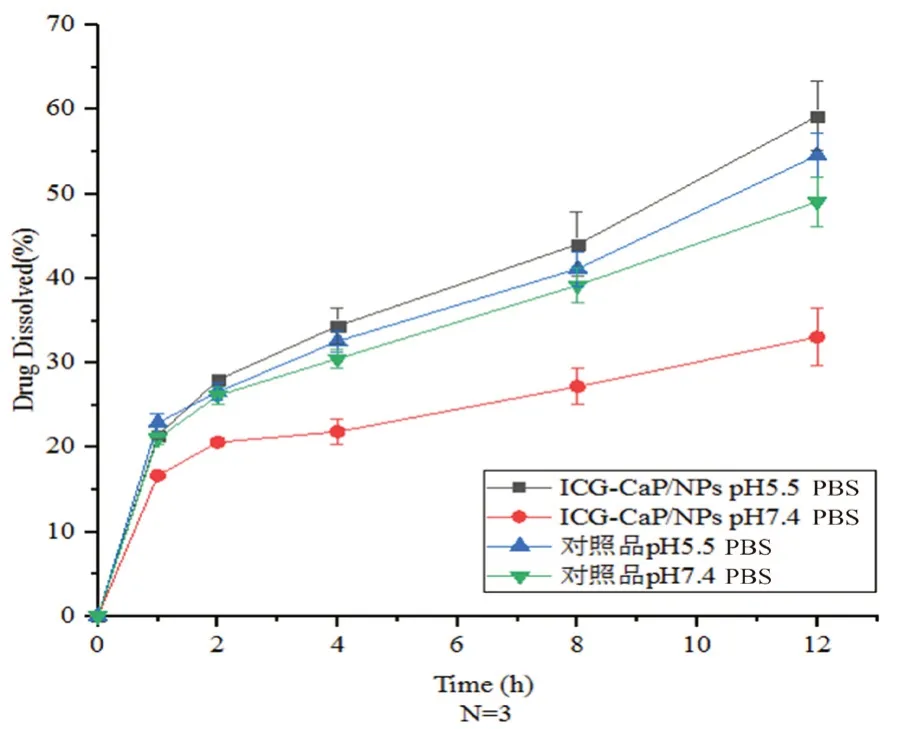
图6 ICG-CAP/NPs和ICG对照品的体外释药曲线Fig 6 In vitro release curve of ICG-CAP/NPs and ICG
4 讨论
本试验选用Box-BehnKen 试验设计建立 3 因素 3 水平的试验模型,考察 ICG-CaP/NPs 制备工艺并对处方进行优化分析。确定最佳工艺为 Ca/P 比值 1.67、pH 8.5、ICG加入量1 mg。预测工艺得到的粒径为80 nm,包封率和载药量分别为67.37%、1.31%。最优工艺制备下得到的ICG-CaP/NPs平均粒径(73.5±4.5)nm;Zeta电位(-41.0±1.8)mV;包封率和载药量分别为(64.94±1.31)%、(1.32±0.02)%。与预测值较为吻合。
测定纳米粒的包封率和载药量的方法主要有超滤离心法、高速离心法、透析法、葡聚糖凝胶柱法等,本试验选用透析法测定包封率和载药量。该试验载药性能取决于 ICG 中磺酸基与钙离子的离子键结合能力以及磷酸钙的物理吸附。本试验测得的载药量偏低,推测是由于磷酸钙纳米粒与 ICG 间的吸附作用和离子键结合较弱,长时间透析过程中容易解离,从而导致 ICG-CaP/NPs 载药量偏低。
测定释放度时,由于ICG在水溶液中不稳定,透析过程中会有所降解。因此本试验同时测定了ICG对照品溶液和ICG-CaP/NPs溶液在 pH 5.5和 7.4 条件下的释放度,对比对照品溶液和纳米粒溶液中 ICG 释放情况,使体外释放测定更加准确。
