液态活检
——细胞外囊泡在妇科领域的研究和应用进展*
2021-07-03孙淑根邱君君华克勤
孙淑根,邱君君,华克勤
(复旦大学附属妇产科医院,上海 200011)
液态活检(liquid biopsy)是指通过获取、分析体液(如血液、唾液、尿液、胸水、分泌物等)中生物标记物,反应其组织学来源相关信息的一种非侵入性的检测技术。凭借其本身微创、快速、稳定和易获取的优势,在疾病早期诊断、靶向药物选择、诊疗实时监测和预后判断中发挥着重要作用。细胞外囊泡(extracellular vesicles,EVs)是液态活检技术的重要组成部分之一,是由活性细胞分泌的脂质双分子结构的囊泡,可通过转运其内特异性小分子物质,如脂质、蛋白质、微小RNA(microRNA,miRNA)、长链非编码RNA(long noncoding RNA,lncRNA)等,在细胞旁分泌及细胞间交流中发挥重要作用。此外,研究表明,病理环境下分泌的EVs与疾病的严重程度、进展及预后密切相关,为EVs评估及预测临床结局奠定了理论基础,提示EVs在精准治疗方面具有巨大潜能。因此,对EVs功能机制进行深入研究,可为疾病诊治及相关生物标记物、治疗靶点的探索提供新思路。本文通过综述EVs在妇科疾病中的研究进展,探讨EVs在妇科领域的研究前景及方向。
1 液态活检技术概述
妇科疾病的早期精准诊断分型及后期动态随访一直是研究的热点。高效、经济、精准的诊断及分层诊疗,是患者获得良好预后的基础。近年来,液体活检技术初露头角。液态活检可通过简单的体液采样,动态监测患者的疾病状况,在疾病诊断、预后判断、疗效评估等方面发挥着重要作用。与传统组织病理活检相比,液体活检样本来源广泛,不仅具有微创、快速、重复性强等优点,还能通过基因组学、蛋白组学等新技术反应疾病全貌,最大限度减少人为操作误差。液体活检常见的检测项目包括循环肿瘤细胞(scirculating tumor cells,CTC)、EVs、循环肿瘤DNA(circulating tumor DNA,ctDNA)、循环肿瘤RNA(circulating tumor RNA,ctRNA)、循环蛋白质及肿瘤驯化的血小板(tumor-educated platlets,TEPs)等[1](图1)。2016年FDA通过了首个基于ctDNA的肺癌筛查,拉开了液体活检用于临床诊疗的序幕。
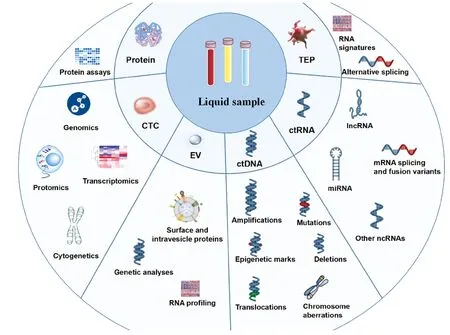
图1 液态活检分类[1]
2 EVs概述
2.1 EVs定义及分类 细胞间通讯在多细胞及人体内发挥着重要作用。经典的细胞间通讯可通过细胞间直接接触,或者分泌、释放和摄取化学分子,如激素、生长因子、神经递质完成,据此可分为内分泌、旁分泌及自分泌。近年来,EVs阐述了一种全新的细胞间交流方式,成为研究热点。EVs是由活性细胞分泌的具有脂质双分子结构的囊泡,其内携带包括DNA、mRNA、microRNA、lncRNA、蛋白质等在内的多种物质,广泛分布在人体多种体液中(图2)。EVs作为载体,可将其内含的分子从一个细胞或组织输送到另一细胞或组织,并保护其内容物不受细胞外酶的作用而降解或修饰,继而通过与受体细胞表面受体结合或通过胞吞胞饮传递其内容物发挥生物学效应[2]。细胞在应激、pH改变、缺氧、放射损伤等各种条件诱导下可产生并释放EVs。释放的EVs进一步参与机体各种生理过程,如组织修复,维持干细胞及内环境稳态,调节免疫功能及神经系统功能。因此,EVs在多种疾病,如肿瘤、自身免疫疾病、神经退行性病变的发生发展中起着重要作用[3]。在这些病理生理过程中,EVs作为“病灶细胞”的生物标记物,可以稳定地随体液循环至全身,并通过“胞吞”的转运作用跨越组织屏障,这意味着相较于CTCs和ctDNA,EVs及其携带的内容物在血液中可以更稳定存在,并与起源细胞具有高度相似性,这些特性使EVs在疾病诊断及治疗上具有广阔的前景。根据生物合成途径、组成及物理特性(如大小或密度),EVs可分为多种类型,其中最主要的3类为:微囊泡(Microvesicles,MVs)、外泌体(Exosomes,EXOs)和凋亡小体(Apoptotic bodies,ABs)(图3)。
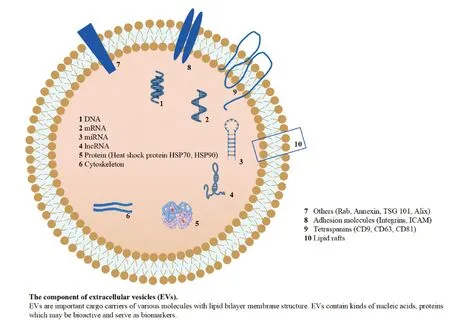
图2 EVs基本结构

图3 EVs分类
2.1.1 微囊泡(Microvesicles,MVs) MVs是在不同的诱导因素下,活体细胞的细胞膜蛋白重塑、脂质重新分布,继而出芽、分裂、衍化形成的富含胞内分子的双层脂质分子囊性结构。其直径范围一般在100~1000nm,也有部分研究将100~2000nm的EVs均定义为MVs。ARF-6是MVs的分子标记。此外,蛋白组学领域最新进展表明,KIF23、RACGAP1、exportin-2等也可作为MVs的分子标记[4]。
2.1.2 外泌体(Exosomes,EXOs) 外泌体是一类直径在30~200nm的EVs。内体转运复合物(endosomal sorting complexes required for transport,ESCRT)参与了外泌体生成。早期内体在胞内发育成熟为多泡体(multivesiclar bodies,MVBs),外泌体以腔内囊泡(intraluminal vesicles,ILVs)形式分布于MVBs内,随后MVBs与细胞膜融合、将其内ILVs释放到胞外,胞外的ILVs即外泌体。外泌体也可通过ESCRT非依赖途径如中性鞘磷脂酶(N-SMase)/神经酰胺、ARF6/PLD2合成释放。参与外泌体合成分泌的分子如:四分子交联体超家族(CD63、CD9、CD81、Alix、TSG101、syntenin-1、flotillin-1)是外泌体经典的相关分子标记。外泌体可根据来源、内容物分为多种亚型,在肿瘤进展、免疫调节、生殖等领域发挥重要作用[5]。
2.1.3 凋亡小体(Apoptotic bodies,ABs) 凋亡小体是细胞程序性死亡过程中通过质膜出泡形成的一种双层脂质分子结构的囊泡。其大小多在1~5μm之间,内含丰富的胞内碎片。凋亡小体表面特异分子标记包括凝血酶敏感蛋白(Thrombospondin)及C3b[6]。此外,线粒体膜离子通道蛋白VDAC1、内质网来源的钙网蛋白(Calreticulin)、磷脂酰丝氨酸(PS,phosphatidylserine)也可作为凋亡小体特异分子标记[7]。凋亡小体可在体细胞之间水平转运DNA,调节靶细胞功能,参与免疫反应。
2.2 EVs的研究现状 近年来,EVs作为生物标记物在部分疾病研究中已取得进展。囊泡表面膜受体及内容物决定了EVs的选择性、靶向性及功能,是EVs的重要特征。EVs内容物包括蛋白质、生物活性的脂类分子、各类RNA、DNA等。迄今为止,大多研究主要集中于EVs及其内容物(尤其是microRNA、蛋白质)在恶性肿瘤及常见疾病筛查、分型、预后及治疗的作用机制及临床应用[8]。这些研究证明,通过液体活检技术检测EVs内容物,与传统组织病理活检相比,具有更高的灵敏性及便捷性,使得在术前对疾病进行诊断、分期,并预测患者预后成为可能。因此,EVs在妇科领域的应用中有重要的临床意义及广阔的前景。
3 EVs与妇科恶性肿瘤
3.1 EVs与宫颈癌 宫颈癌是女性常见的恶性肿瘤之一,女性终身宫颈癌患病率可达0.6%,严重威胁女性的生殖健康和生活质量,因此早期诊断和术后规律随访是防治宫颈癌的关键[9]。目前我们多采用HPV筛查、脱落细胞学检查及阴道镜检查进行临床筛查。但在治疗后随访、早期发现复发等方面,缺少高度特异性和敏感性的生物标记物。已有文献报道,液体活检技术如CTCs、ctDNA、ctRNA在宫颈癌诊断及治疗方面有一定价值[10]。EVs作为液体活检技术之一,广泛分布于体液及阴道、宫腔灌洗液中,因其稳定性及特异性,也可作为宫颈癌筛查诊断及预后判定的新型分子(表1)。

表1 EVs作为生物标记物在宫颈癌中的临床应用
Liu等[11]研究发现,宫颈癌患者宫颈阴道灌洗液中富含EXOs,其内miRNA-21和miRNA-146a表达明显高于健康女性,EXOs中miRNA表达异常可能与HPV相关致癌基因E6/E7相关,提示EXOs可通过其内miRNA调节肿瘤的增殖与凋亡。在一项纳入121例的试验中,宫颈癌患者血浆中EXOs-miRNA-30d-5p及let-7d-3p表达异常可协助诊断宫颈癌前病变及宫颈癌[12]。此外,EXOs内lncRNA表达在患者与正常人之间差异显著,其中lncRNA-HOTAIR、MALAT1在HPV阳性患者及宫颈癌患者中表达增加;而lncRNA-MEG3表达下降[13]。Shi等[14]同样在宫颈癌及复发宫颈癌模型中发现,外周血中EXOs-ATF1和RAS表达上调,表明EVs在宫颈癌诊断中极具潜能。
3.2 EVs与子宫内膜癌 子宫内膜癌是女性第四大肿瘤,2019年新增子宫内膜癌患者占罹患肿瘤女性总数的7%。虽然大多子宫内膜癌患者因伴随明显的临床症状如绝经后出血而在早期确诊,但仍有20%的患者确诊时处于晚期。早期子宫内膜癌预后良好,5年生存率可达95%,而进展期子宫内膜癌5年生存率仅为16%[9]。与其他肿瘤相比,子宫内膜癌对传统化疗方案并不敏感,因此临床上急需可以早期诊断、预测复发、指导治疗的新型、灵敏、有效的生物标记物,液体活检提供了契机。在液体活检技术中,EVs因为其生物学特性,其内可携带大量的肿瘤信息并在体液中稳定存在。此外,ExoQuick等快速检测试剂的上市,也加快了EVs的临床转化。研究表明,Ishikawa细胞可通过EXOs向内膜成纤维细胞转运miRNA,以此调节内膜成纤维细胞内miRNA表达,通过吸取子宫内膜可有效分离EXOs,为子宫内膜癌无创“活检”开辟了新的途径[15](表2)。

表2 EVs作为生物标记物在子宫内膜癌中的临床应用
在协助内膜癌诊断方面,Dziechciowski等[16]发现在内膜癌患者外周血及宫腔中,总EVs(TF+)、内皮细胞来源(CD144+)及单核细胞来源(CD14+)的EVs水平明显增高,并且与组织学分级、临床分期相关。研究发现,除EVs数量增加外,在内膜癌患者外周血EVs中新型环状RNA:has-circ-0109046及has-circ-0002577表达上调[17]。ANXA2蛋白在外周血EVs高度表达,并与高复发风险及非内膜样腺癌组织类型相关,使用EV-ANXA2诊断内膜癌有良好的效能[18]。因EVs在体液中广泛分布,Srivastava等[19]分离了尿液中的EXOs,分析证明尿液中EXOs-miRNA-200c-3p在筛查子宫内膜癌中发挥作用。以腹腔冲洗液中EV-miRNA-383-5p、miRNA-10b-5p、miRNA-34c-3p、miRNA-449b-5p、miRNA-34c-5p、miRNA-200b-3p、miRNA-2110和miRNA-34b-3p为标记物诊断内膜癌,AUC均可达0.9以上[20]。
在子宫内膜癌预后方面,通过蛋白组学分析,发现在内膜癌患者外周血EVs富含一种黏附蛋白EVs-LGALS3BP,该蛋白在具有高复发风险的内膜癌患者中富集[21]。Li等[22]也发现,肿瘤微环境中成纤维细胞分泌的EXO中miR-148b表达下调,可有效促进肿瘤细胞侵袭、转移,与预后密切相关。多囊卵巢综合征(polycystic ovarian syndrome,PCOS)患者容易合并子宫内膜癌,进一步研究也提示PCOS患者血清EXOs中miRNA-27a-5p表达增高,可通过下调其靶基因SMAD4刺激子宫内膜癌细胞增殖和侵袭,是内膜癌高发的可能机制之一[23]。
EVs在子宫内膜癌治疗中也发挥着重要作用。研究表明,在人脐带间充质干细胞中过表达miR-302a后,其分泌的EVs富含miR-302a,可通过CyclinD1和Akt通路抑制子宫内膜癌细胞增殖及转移,有望成为新的治疗靶点[24]。
3.3 EVs与卵巢癌 卵巢癌是妇科常见的恶性肿瘤,2020年Cancer statistics中报道卵巢恶性肿瘤占女性所有恶性肿瘤死亡的5%,早期卵巢癌的5年生存率可达92%,而伴随远处转移的患者5年生存率仅为29%,因此有效的临床筛查手段,可很大程度上改善患者预后[9]。
EVs中miRNA含量最多,因此EVs作为生物标记物在卵巢癌发生机制及临床应用研究主要集中在miRNAs。近期研究表明,卵巢癌源性EXOs内miRNA表达与卵巢癌细胞内表达相似,可有效反映卵巢癌病灶的情况。在卵巢癌患者血清EXOs中miR-373、miR-200a、miR-200b和miR-200c浓度均显著高于健康女性,可作为鉴别卵巢良恶性肿瘤的指标。miR-200b和miR-200c水平的升高与III~IV期、CA125水平及总生存期缩短相关,提示这些miRNAs可能与肿瘤的进展有关,可用于诊断及肿瘤预后评估[25]。在组织类型方面,血清EXOs中miRNA-1290可作为高级别浆液性卵巢癌的分子标记物之一[26]。此外,miRNA-1290、miRNA-21、miRNA-141、miRNA-200、miRNA-214、miRNA-200b、miRNA-320、miRNA-21、miRNA-23b、miRNA-29a、miRNA-21及miRNA-30a-5p等miRNA分子在卵巢癌的诊断、分期预后方面发挥着重要作用[27](表3)。Yokoi将miRNA-142-3p、miRNA-26a-5p、let-7d-5p、miRNA-374a-5p、miRNA-766-3p、miRNA-200a-3p、miRNA-328-3p、miRNA-130b-3p等8种分子纳入模型,验证其诊断卵巢癌的效能,发现AUC可达0.97,敏感度和特异度分别为92%和91%,表明联合多种EV-miRNA指标,选择合适的组合,有助于进一步提高诊断效能[28]。

表3 EVs作为生物标记物在卵巢癌中的临床应用
除miRNA外,EVs内的其他分子也可作为生物标记物应用于临床。Qiu等[29]发现,以血清EXO-lncRNA-MALAT1作为生物标记物建立的诺曼图,也可有效预测上皮性卵巢癌的3年无复发生存率。在卵巢癌患者腹水中,EXOs中EpCam、CD24蛋白的表达水平与患者的预后及治疗反应相关,可作为卵巢癌的新型分子标记物。此外,EXOs内蛋白如Claudin-4、EpCAM、CD24、ADAM10、EMMPRIN与卵巢癌分期相关[30],可协助临床评估卵巢癌分期。血浆EXOs中蛋白除了协助诊断、分期外,在评估治疗效果、预测预后方面也发挥着重要作用,EXOs-TGFβ1、MAGE3、MAGE6[31]在对治疗反应敏感的患者中表达下降,可用于预测药物反应;而腹腔液中EXOs-sE-cadherin[32]与恶性腹水形成及腹膜广泛播散相关,可辅助临床诊断、协助全面评估患者病情并制定合理的治疗方案。
4 EVs与妇科良性疾病
4.1 EVs与子宫内膜异位症 子宫内膜异位症(以下简称内异症)是一种雌激素依赖性疾病,其特征是具有活性的子宫内膜在子宫腔外沉积、生长,盆腔腹膜和卵巢是常见的子宫内膜异位灶生长部位。因内异症具有类肿瘤的侵袭、复发特性,也被认为是一种良性转移性疾病。研究表明,育龄妇女发病率6%~10%,因其易反复复发,严重影响女性的身心健康。目前内异症的发病机制不明确,治疗效果不佳,缺乏有效的早期诊断及预后相关的生物学标记物,因此迫切需要更准确的无创诊断方法和更有效的治疗手段。Munros等[39]通过ELISA检测发现,内异症患者外周血中EVs表达水平明显增高。Muths等[40]通过分析恒河猴宫颈阴道分泌物,证明EVs数量与内异症相关,提示其在内异症中可能发挥重要作用。通过对内异症患者组织及血样本中EVs深度测序发现,内异症患者EVs中miRNA-lncRNA表达谱具有特异性,EVs可能通过影响神经血管生成、细胞侵袭、促进炎性反应等机制参与内异症的发生[41]。
新生血管形成和侵袭转移是内异症的特征之一,前期研究表明在异位微环境中,内异症患者异位病灶中血管生成因子和金属蛋白酶表达水平明显高于患者和健康人群在位内膜[42]。在血管生成调节方面,Harp等[43]通过深度测序对比内异症患者异位、在位子宫内膜间质细胞及健康女性在位子宫内膜间质细胞分泌的EVs内miRNA表达,结果显示内异症患者EXOs中miRNA表达谱与健康女性有明显差异。在异位子宫内膜间质细胞分泌的EXOs中,miRNA-21表达相对于健康女性组增高了11倍。这些高表达miRNA-21的EXOs可通过旁分泌的方式被人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVEC)内化,继而促进血管生成,介导内异症的发生。Qiu等[44]研究发现,卵巢异位囊肿囊壁来源的子宫内膜间质细胞可分泌富含aHIF的EXOs,通过EXOs将aHIF传递给HUVECs,促进VEGF-A、VEGF-D等促血管生成因子表达。EXOs-aHIF在内异症患者外周血中表达升高,并与组织中表达呈正相关,揭示了其作为生物标记物的临床可行性。
在侵袭特性方面,既往文献报道通过抑制金属蛋白酶的活性,可防止内膜样囊肿形成。EMMPRIN(CD147)是一种金属蛋白酶诱导剂,在子宫内膜上皮细胞分泌的EVs中广泛存在。EV-EMMPRIN通过与间质成纤维细胞相互作用,增加其内金属蛋白酶的表达,从而促进内异灶侵袭[45]。EV-lncRNA-TC0101441和EXOs-miRNA-22-3p可通过调节子宫内膜间质细胞侵袭转移能力,促进内异灶的产生。研究发现,III/IV期内异症患者外周血中EV-lncRNA-TC0101441表达明显增高,表明其在术前辅助内异症分期中具有潜在价值[46-47]。
内异症也被认为是一种炎性疾病,在内异灶部位,异位的子宫内膜受激素调节,不断经历出血、修复、纤维化、再出血的循环,伴随局部炎性反应。在病灶纤维化方面,正常子宫内膜间质细胞分泌的EXOs-miRNA-214可以通过下调α1胶原及结缔组织生长因子(CTGF)来抑制纤维化产生,而内异灶中EXO-miRNA-214表达相对降低,进而促进局部组织纤维化[48]。在炎症调节方面,子宫内膜上皮细胞来源的EXOs-miRNA-138可通过VEGF/NF-κB途径介导细胞凋亡和炎性反应[49];子宫内膜间质细胞来源的EXOs也可以通过促进巨噬细胞M2极化参与内异症发生[50]。通过对内异症患者腹腔液中EXOs进行miRNA测序发现,EXOs内miRNA-1908、130b、451a、486-5p、4488、432、342、425、505、6508、145、365a及365b等参与免疫调节的miRNA表达与正常人群相比存在明显差异[51]。此外,内膜样囊肿囊液中EXOs内核酸外切酶浓度及活性明显增高,可通过调节胞外ATP及腺苷水平,调节炎性反应,促进内异灶形成[52]。以上研究证明了EVs可通过不同机制参与异位症的发生发展,为EVs及其内容物作为生物标记物应用于临床提供了依据(表4)。但前期研究未充分阐明EVs其内分子参与内异症发生的具体机制,也未进一步评估其在内异症诊断、分期以及预后中的临床作用,有待在后续研究中改进完善。
4.2 EVs与多囊卵巢综合征 多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是女性常见的内分泌疾病。Koiou等[53]研究发现,PCOS患者外周血中血小板来源的MVs水平明显升高并且与卵巢内小卵泡平均数正相关。随后实验证明,PCOS患者中EVs水平增加与胰岛素抵抗标记物相关,此外PCOS患者中EVs中annexin-V和16种microRNA表达增高[54]。Sang等[55]鉴定了卵泡液中EV及其内容物,发现其中11个miRNA高表达,并且在生殖、内分泌及代谢相关途径中发挥重要作用,其中miRNA-132和miRNA-320显著降低,这两种miRNA的靶基因分别是在PCOS发病中发挥着重要作用的HMGA2和RAB5B。前期的全基因组研究发现,DENND1A是PCOS的候选发病基,PCOS患者尿液提取的EXOs中DENND1A mRNA表达明显增加,进一步证明EVs可作为PCOS的潜在生物标记物[56-57]。以上研究揭示了EVs及其内容在PCOS患者中的差异(表4),但有关机制及临床效能还需进一步验证。

表4 EVs作为生物标记物在妇科良性疾病中的临床应用
5 总结与展望
总而言之,作为液态活检技术重要组成部分的EVs,可通过不同的调控机制参与妇科各种良恶性疾病的发生发展。因其稳定性强、获取便捷、应用范围广,在疾病诊断、评估、治疗中都发挥着重要作用,有望成为新型有效的生物学指标和基因治疗的靶点。虽然前期研究已取得了一些成果,但EVs及其内容物在疾病发生发展过程中的具体机制未得到详尽阐述,其临床意义还需大样本研究来验证。尤其在内异症方面,EVs作为无创性液态活检技术用于诊断内异症、评估内异症严重程度、预测复发或生育结局等方面存在很多空白,是一个相对未开发的领域。因此,深入研究EVs及其内容物在妇科常见疾病中的作用及机制有助于全面了解疾病的发生,并为临床治疗提供新的靶点。EVs与传统机制,如肿瘤微环境、免疫学等交互作用也值得进一步探讨。相信随着分子信息学、基因技术、蛋白组学、代谢组学技术的成熟,EVs在妇科领域的更多功能及临床应用将得到进一步诠释,以促进妇科领域诊疗技术迅速发展。
