慢性间歇性低氧模型大鼠的甲状腺功能分析
2021-07-03王泽辉
田 慧,高 隆,王泽辉
(1. 榆林市第一医院内分泌科,绥德 718000 ;2. 榆林市第一医院呼吸内科,榆林 719000;3. 延安大学医学院基础医学院,延安 716000)
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)是一种病因不明的睡眠呼吸疾病,临床表现为夜间睡眠打鼾伴呼吸暂停和白天嗜睡[1-2]。由于呼吸暂停引起反复发作的夜间低氧和高碳酸血症,可导致高血压、冠心病、糖尿病和脑血管疾病[3-4],因此受到人们广泛关注。慢性间歇性低氧(chronic intermittent hypoxia, CIH)是OSAHS的主要病理特征,其表现为睡眠中反复出现低氧情况,而且它也是OSAHS导致心脑血管并发症的主要因素[5-6]。OSAHS和甲状腺功能减退症均为内科常见的疾病,它们在体征和症状方面有很多相似的临床表现,如:乏力、嗜睡、体质量增加、情绪低落等[7-8]。甲状腺、垂体等是高代谢器官,而OSAHS可造成组织缺氧,长此以往可能使这些组织器官(甲状腺、垂体)功能下降或异常[9]。因此,进一步明确OSAHS与甲状腺功能之间的关系显得尤为重要。本实验通过建立与OSAHS病理生理特征相似的CIH大鼠模型,检测各组大鼠血清中促甲状腺激素释放激素(thyrotropin releasing hormone,TRH)、促甲状腺激素(thyroid stimulating hormone,TSH)、三碘甲状腺原氨酸(triiodothyronine,T3)和甲状腺素(thyroxine,T4)的表达水平,同时观察各组大鼠甲状腺组织的病理变化和超微结构变化,探讨OSAHS与甲状腺功能之间的关系。
1 材料与方法
1.1 动物饲养
30只SPF级雄性SD大鼠,7周龄,体质量(200±20)g, 购自延安大学实验动物中心[SCXK(陕)2019-0014]。大鼠适应环境 [SYXK(陕)2019-0007] 2周后进行实验,动物实验经本单位动物福利伦理委员会批准(201902005)。
1.2 试剂和设备
TRH、TSH、T3和T4放射免疫分析试剂盒(北京北方生物技术研究所),HE染色试剂盒(北京索莱宝生物科技有限公司),甲苯胺蓝染色试剂盒(北京华威锐科化工有限公司),电子分析天平(日本SHIMADZU公司),光学显微镜和Leica 2065切片机(德国Leica公司),Hitachi-7500电子显微镜(日本Hitachi公司),γ-放射免疫分析仪(众成机电技术公司),动物低氧舱(上海塔望智能科技有限公司,型号:ProOx-810)。
1.3 动物分组和CIH模型制备
将30只SD大鼠随机分为对照(control)组、CIH组和复氧(reoxygenation,RH)组,每组10只。CIH组和RH组大鼠每日9∶00~17∶00放入低氧舱内。低氧舱内循环,先输入压缩空气30 s,后输入氮气30 s,以此循环[10]。实验过程中注意检测低氧舱内的氧浓度,使舱内氧浓度控制在体积分数8%~21%。实验过程中舱内产生的二氧化碳和水蒸气被生石灰和硅胶吸取。CIH组大鼠连续进行实验4周,其余时间均正常饮食饮水;RH组连续进行低氧舱实验4周后正常饲养4周(复氧),其余时间均正常饮食饮水;control组大鼠不予任何处理,正常饮食饮水4周。
1.4 大鼠灌注与取材
实验结束后,大鼠经腹腔麻醉后,将其四肢固定于解剖板上,并从颈静脉抽血约5 mL,于4 ℃以3 000 r/min 离心15 min,吸取上层血清(其中TRH采血管中预先加入TRH 抗灭活剂硫酸8-羟基喹啉、Tween-20和乙二胺四乙酸二钠),于-80 ℃冰箱保存。接着打开大鼠胸腔,由左心室插入静脉针头至升主动脉,剪开右心房,快速灌注4%多聚甲醛溶液,约30 min,至大鼠尾变硬。迅速解剖大鼠颈部肌肉,可看到甲状软骨和气管,在甲状软骨和气管环两侧可看到一对长椭圆形深红褐色组织,即甲状腺,轻轻摘除双侧甲状腺组织,用干纱布吸水后迅速置于电子天平上称重。甲状腺组织经戊二醛固定等步骤后制成切片,染色并摄影观察。
1.5 放射免疫分析
将-80 ℃冰箱中的血清置于冰上进行溶解,待其溶解后按照试剂盒上的说明书进行操作,计算血清中TRH、TSH、T3和T4的含量。
1.6 HE染色
将甲状腺组织用4%多聚甲醛溶液固定2~3h;然后对甲状腺组织进行包埋,并切成4 µm切片;切片放入苏木精染液中5 min,自来水清洗后,置于1%的盐酸乙醇溶液分化数秒,并用流水冲洗。切片放入伊红染液中染色3 min,流水清洗。之后切片置于梯度乙醇溶液(70%、80%、90%、100%)中脱水,各5min,再放入二甲苯Ⅰ、Ⅱ中透明,分别5min。将切片取出,用滤纸轻轻拭干切片上残余的二甲苯,在组织上滴加中性树胶封固,使用光学显微镜观察并摄影。
1.7 甲苯胺蓝染色
将甲状腺组织用4%多聚甲醛溶液固定2~3 h;然后对甲状腺组织进行包埋,并切成4 µm的切片;将切片用含30%乙醇的甲苯胺蓝溶液染色30 min;用无水乙醇洗10 min;中性树脂封固,光学显微镜下观察并摄影。
1.8 电子显微镜观察
将甲状腺组织用戊二醛溶液固定2~3 h,漂洗后用 l%锇酸溶液固定2 h,之后用丙酮溶液进行梯度脱水,甲状腺组织块包埋在电子显微镜标本模板中,置烤箱内加温烘干,并切成厚片或半薄切片。将切片转移到滴有蒸馏水的洁净载玻片上,展平,等待其干燥后,用甲苯胺蓝染剂染色,光学显微镜下定位,以确定观察区域。接着制作超薄切片,并将超薄切片转到有聚乙烯醇缩甲醛支持膜的铜载网上,将3%柠檬酸+0.1%醋酸铀染色液滴于石蜡板上,把贴有切片的铜网放在石蜡板上,染色15 min,清水洗净。使用Hitachi-7500电子显微镜摄影观察。
1.9 统计学方法
2 结果
2.1 CIH模型的鉴定
实验过程中,CIH组和RH组大鼠分别在低氧舱内氧最低浓度和氧最高浓度时,随机对CIH组和RH组大鼠进行血氧饱和度和动脉血气分析检测,其血氧饱和度为70%~92%,动脉氧分压为60.7~80.1 mmHg,接近OSAHS病理生理特点,提示CIH动物模型建立成功。
2.2 各组大鼠血清中TRH、TSH、T3和T4的含量
如表1所示,与control组比较,CIH组大鼠血清中TRH、TSH、T3和T4的表达水平明显降低(均P<0.05);与CIH组比较,RH组大鼠血清中TRH、TSH、T3和T4的表达水平明显升高(均P<0.05)。
表 1 各组大鼠血清中TRH、TSH、T3和T4的含量Table 1 The serum levels of TRH, TSH, T3 and T4 in each group of rats( ± s, n=10)

表 1 各组大鼠血清中TRH、TSH、T3和T4的含量Table 1 The serum levels of TRH, TSH, T3 and T4 in each group of rats( ± s, n=10)
注:TRH为促甲状腺激素释放激素,TSH为促甲状腺激素,T3为三碘甲状腺原氨酸,T4为甲状腺素。Control为对照组,CIH为慢性间歇性低氧组,RH为复氧组。与control组比较,*P<0.05;与CIH组比较,#P<0.05。
-1-1-1-1 组别 TRH/(µg·L) TSH/(µg·L) T3/(µg·L) T4/(µg·L)Control CIH RH 37.67±2.45 24.56±1.87*32.45±1.56#2.22±0.56 1.45±0.31*1.98±0.35#1.25±0.47 0.66±0.07*1.22±0.32#85.78±3.24 57.67±2.54*78.95±2.38#
2.3 各组大鼠甲状腺质量变化
与control组大鼠甲状腺质量[(43.67±1.56)g]比较,CIH组[(71.78±1.67)g]明显增加(P<0.01);与CIH组大鼠甲状腺质量比较,RH组[(50.45±1.32)g]明显减轻(P<0.05)。
2.4 各组大鼠甲状腺组织的病理变化
HE染色结果(图1)显示,control组大鼠甲状腺组织含有均质嗜酸胶体的滤泡,并被具有中央核的简单立方嗜碱性滤泡细胞排列;CIH组大鼠甲状腺组织的正常滤泡结构丧失,其中胶体耗尽,一些滤泡细胞出现空泡,基核较暗;RH组大鼠甲状腺组织显示正常滤泡结构,但某些滤泡细胞仍呈空泡状,胶体出现了变化。
2.5 各组大鼠甲状腺组织中甲状腺滤泡的变化
甲苯胺蓝染色结果(图2)表明,control组大鼠甲状腺组织有完整的甲状腺滤泡,内衬滤泡细胞和轻滤泡旁细胞;CIH组大鼠甲状腺显示不规则甲状腺滤泡,腔内有脱落的滤泡和滤泡旁细胞;RH组大鼠甲状腺组织表现出完整的甲状腺滤泡结构,但有些滤泡细胞仍显示为空泡,并带有深色核。

图 1 HE染色观察各组大鼠甲状腺组织的病理变化(×100)Figure 1 HE staining to observe the pathological changes of thyroid tissue in each group of rats (×100)

图 2 甲苯胺蓝染色观察各组大鼠甲状腺的病理变化(×100)Figure 2 Toluidine blue staining to observe the pathological changes of thyroid in each group of rats (×100)
2.6 各组大鼠甲状腺组织超微结构的变化
电子显微镜检查结果(图3)表明,control组大鼠甲状腺具有正常的滤泡细胞,滤泡细胞中具有常染色体、完整的溶酶体和内质网;CIH组大鼠甲状腺滤泡细胞出现细胞核收缩,异染色质增加,基质损失,线粒体空泡,溶酶体和脂质滴增加;RH组大鼠甲状腺显示出或多或少完整的滤泡细胞结构,其中有常染色体、内质网和溶酶体。
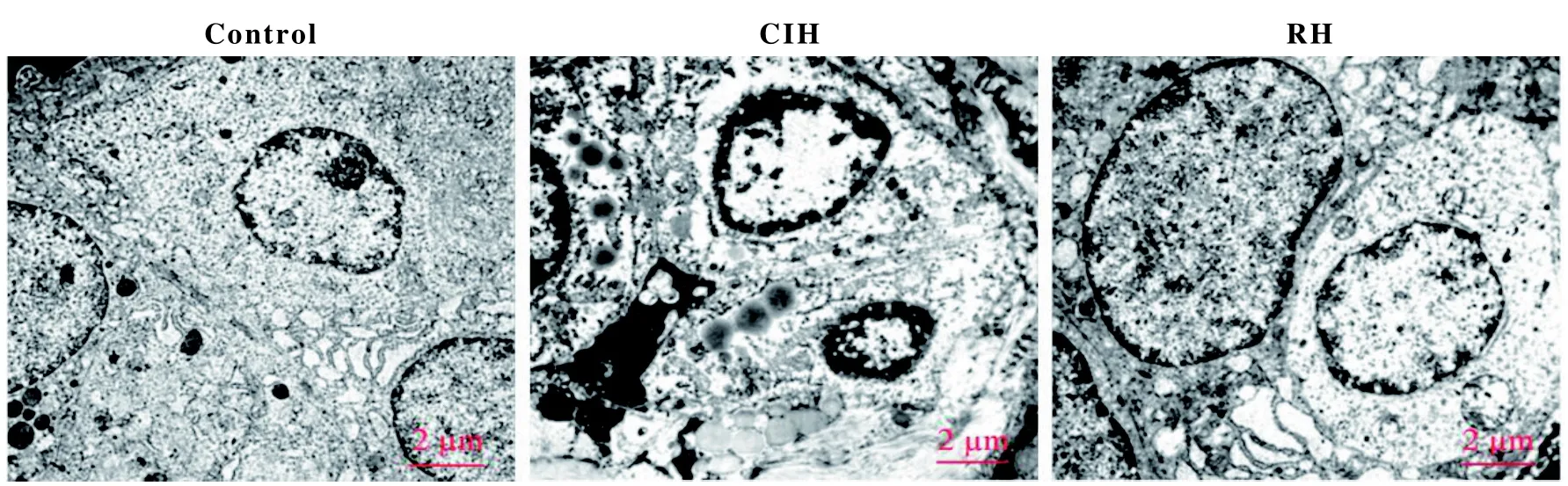
图 3 电子显微镜观察各组大鼠甲状腺超微结构变化(×5 000)Figure 3 Electron microscopy observation of the ultrastructural changes of the thyroid gland in each group of rats(×5 000)
3 讨论
OSAHS是一种常见疾病,会导致呼吸中断,吸氧时间减少(呼吸暂停或呼吸不足),然后在患者入睡时迅速进行重新充氧[11]。氧气吸入的减少导致缺氧、高碳酸血症和胸腔内压力降低[12]。在OSAHS期间,反复的低氧血症和高碳酸血症可能会导致神经功能障碍,儿茶酚胺、内皮素和肾素-血管紧张素系统紊乱,内分泌功能障碍,以及血尿动力学改变[13]。OSASH与全身性疾病相关,包括高血压、高脂血症、冠状动脉疾病、自身免疫性疾病和癌症[14-15]。
甲状腺功能减退是由多种原因引起的,其机制是甲状腺激素合成及分泌减少,或其生理效应不足所致机体代谢降低;按其病因分为原发性甲状腺功能减退、继发性甲状腺功能减退及周围性甲状腺功能减退三类[16]。甲状腺功能的调节是复杂的神经内分泌调节过程,受多种因素的影响。内分泌系统直接由下丘脑调控,产生TRH,通过垂体门脉系统进入腺垂体,促使腺垂体释放TSH,TSH可使甲状腺释放T4和T3。其中腺垂体除受到下丘脑的调节外,还受到甲状腺激素的负反馈调节[17]。
研究发现,OSAHS患者血清中游离T3、游离T4水平均明显下降[18]。本实验结果表明,CIH组较control组的血清TRH、TSH、T3、T4水平降低,说明OSAHS可能会引起下丘脑受损,使TRH的分泌减少,从而使TSH(腺垂体分泌)的分泌减少,最终使T3和T4的分泌降低,引起甲状腺功能减退症状。熊俊伟[19]研究表明,CIH可引起大鼠甲状腺质量增加,去除缺氧因素后甲状腺质量基本恢复正常。本研究中也对大鼠甲状腺进行了称量,发现CIH组大鼠甲状腺质量明显增加,说明OSAHS对甲状腺是有损伤作用的。从HE染色、甲苯胺蓝染色和电子显微镜观察结果可知,CIH组大鼠甲状腺组织有一定程度的损伤;然而,进行4周复氧后RH组大鼠血清中TRH、TSH、T3、T4水平升高,甲状腺质量减轻,甲状腺组织的损伤程度减小。
综上所述,OSAHS对甲状腺有一定的损伤作用,但是复氧可以减轻其损伤,因此在临床上可以对OSAHS患者给予持续正压通气治疗。在本实验中没有对下丘脑和垂体进行深入的研究,因此OSAHS的病理机制还有待进一步研究。
