开窗技术数值模拟在主动脉弓部病变中的应用
2021-07-03乔永辉栾靖旸符伟国
毛 乐, 乔永辉, 栾靖旸, 罗 坤, 竺 挺*, 符伟国
1. 复旦大学附属中山医院血管外科,上海 200032 2. 浙江大学能源清洁利用国家重点实验室,杭州 310027
随着腔内技术的发展,普通胸主动脉病变的治疗多采用胸主动脉腔内修复术(thoracic endovascular aortic repair, TEVAR)。但发生病变累及主动脉弓部及弓上分支的复杂胸主动脉病变时,因主动脉弓部解剖结构复杂、分支变异种类多,无法通过传统的TEVAR手术达到治疗目的。合理处理和保留弓上分支的血运,是复杂胸主动脉病变腔内治疗的要点和难点。
2004年McWilliams等[1]首次报道运用逆向的原位开窗技术在TEVAR术中保留左锁骨下动脉的灌注。但结合开窗技术的TEVAR(F-TEVAR)术后,主动脉弓部血管腔内的解剖结构也发生了较大改变,主动脉内的血流情况不明。血管腔内的血流动力学情况与手术效果密切相关,获取术后主动脉内的血流情况可增进医师对手术的理解并改良操作,提高手术的近远期效果。但在实际临床工作中,实时、精准地获取血管腔内的血流动力学参数十分困难。依托计算机技术、医学影像学技术、数字图像处理技术的快速发展,计算流体力学(computational fluid dynamics, CFD)技术可在无创情况下得到比有创手段(如血管造影)更多的血流动力学参数,为人体循环系统的生理学和病理生理学的研究提供更多信息,成为研究心血管领域血流相关问题的一种重要方法[2-4]。
本研究运用数值模拟方法,建立可准确模拟F-TEVAR术后血液流动的数值模型,探讨影响F-TEVAR手术后血流动力学的因素,从而为改进F-TEVAR手术技术、提高手术治疗效果提供依据。
1 资料与方法
1.1 一般资料 选择2016年11月至2019年5月复旦大学附属中山医院血管外科收治的行F-TEVAR术患者10例。其中1例术中开窗困难,中转烟囱TEVAR术。其余9例患者中,男性8例,女性1例;年龄49~82岁,平均(65.0±9.0)岁。本研究通过复旦大学附属中山医院伦理委员会批准(Y2016-244),所有患者均知情并签署知情同意书。
1.2 随访方式 所有患者均严格按照随访计划,在手术后1个月、3个月、6个月、12个月来院随访,复查胸腹主动脉CTA。满1年后每年至少随访1次。
1.3 手术方法 F-TEVAR具体步骤:全身麻醉后,经皮股动脉穿刺或腹股沟区切开,行股动脉穿刺;经皮左肱动脉穿刺或肘窝区切开,行肱动脉穿刺。常规静脉肝素化(60~100 U/kg)后,行胸主动脉及弓上分支造影。将主体支架开口锚定于左颈总动脉开口处,释放主体支架,覆盖左锁骨下动脉开口;经左肱动脉注射造影剂,显示左锁骨下动脉根部;经左肱动脉导入Fu-star可调弯鞘,经鞘管导入穿刺针,头端气囊注入造影剂确穿刺针固定于左锁骨下动脉正中位置;反复调整DSA球管位置,确定穿刺点位置。扣动扳机,使穿刺针通过覆膜进入主体支架内,V-18导丝经穿刺针进入主动脉腔内;退出穿刺针,沿V-18导丝导入4 mm×30 mm球囊,扩张穿刺点;沿V-18导丝导入8 mm×40 mm球囊,扩张穿刺孔;沿V-18导丝导入10 mm×50 mm覆膜支架,释放,沿V-18导丝导入10 mm×39 mm球扩式支架,以穿刺点为中心释放。进行胸主动脉及弓上分支造影。
1.4 数值模拟 将患者个体化数据进行几何构建、边界条件设定、数值运算等[5]。
1.5 血流动力学参数
1.5.1 血流流线 血流流线用来描述血流的方向及流速,显示血流质点在任一时间点上的运动方向,可用于观察湍流、涡流、二次流和狭窄引起的高速血流等。
1.5.2 血流量分配比(flow distribution rate, FDR) FDR反映远心端各血管血流量与升主动脉血流量的比值,公式为FDR=Q出口/入口×100%。其中,本研究设定的4个出口分别为无名动脉、左颈总动脉、左锁骨下动脉和降主动脉。Q出口为通过这4个出口特定平面的血流量。入口设定为升主动脉,Q入口为通过入口特定平面的血流量。忽略主动脉上其余的细小分支血管,如肋间动脉。

2 结 果
2.1 围手术期情况 10例胸主动脉病变累及弓部的患者中,9例成功,技术成功率90%(9/10)。围手术期未出现脑梗死、心肌梗死等严重并发症,无死亡。
2.2 随访结果 结果(表1)显示:9例患者均获得随访,随访时间为18~48个月,中位随访30个月。无开窗支架梗阻、无靶血管(左锁骨下动脉)丢失;9例患者双上肢血压压差均小于30 mmHg;再干预率为0,死亡率为0。病例2和病例3在第1次随访中观察到轻微的Ⅰ型内漏,后续随访时内漏均消失,余患者未观察到内漏。病例3在第1次随访时出现步态不稳、双下肢无力等脑梗死症状,经神经内科会诊,诊断为非致残性轻微脑梗死,给予药物保守治疗,活动不受限。

表1 F-TEVAR术后患者的随访结果
2.3 血流流线分布 结果(图1)显示9例F-TEVAR病例术后收缩期峰值主动脉及弓上分支血管内的血流流线分布。流线颜色越接近蓝色代表流速越低,流速越高则越接近红色。收缩期时主动脉内的流线平顺,无明显涡流。9例患者F-TEVAR术后,开窗支架内均出现了红色的高速血流(>1.5 m/s),且红色流线多集中在开窗孔周围。血流在通过主动脉弓部后趋于稳定,在主动脉降部表现为绿色、均一、稳定的流线分布。
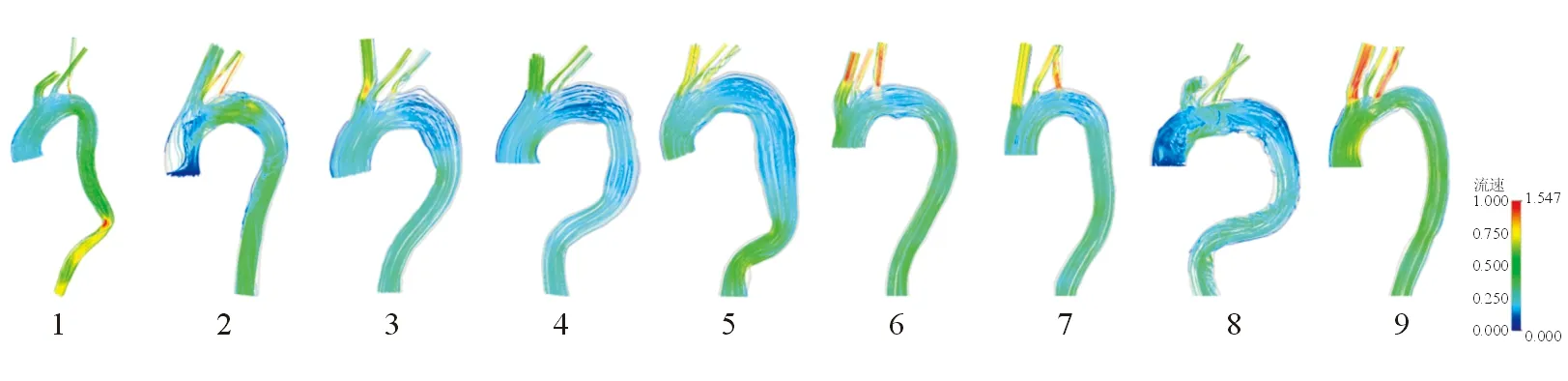
图1 F-TEVAR术后收缩期峰值的主动脉及弓上分支血流流线分布图(病例1~9)
2.4 流速分布 截取2个特殊切面来观察主动脉及支架内的流速分布。结果(图2)显示通过开窗支架开口主动脉弓短轴平面收缩期和舒张期的流速分布。该切面可很好地观察主动脉弓内的血流进入开窗支架的方式以及开窗支架内的血流情况。通过该切面可观察到开窗支架部分进入主动脉弓的结构,支架在主动脉弓部的血液中形成了一个圆柱形的“沟槽”(图2A)。在收缩期峰值(图2B),主动脉弓内的血流通过开窗支架时,在支架内形成了喷射状的红色高速血流;在部分开窗支架内,观察到了红蓝相间的混杂流速信号。在舒张期末(图2C),开窗支架内出现了红色的高速反流血流并射向主动脉弓。相较于收缩期峰值主动脉弓内均一高速的血流,舒张期末主动脉弓内血流流速分布不均一,出现了蓝绿相间的混杂流速信号,且有较多涡流。
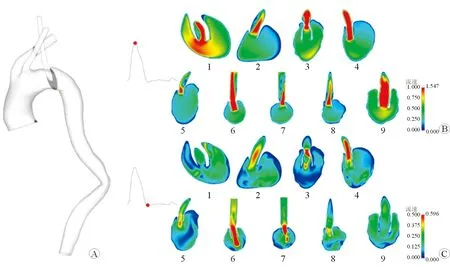
图2 主动脉弓部短轴切面流速分布图
结果(图3)显示,通过开窗支架开口、左颈总动脉开口、无名动脉开口水平平面主动脉弓部收缩期峰值和舒张期末的流速分布。该切面可以很好地观察3个开口处主动脉弓部的血流情况以及开窗支架对主动脉弓部血流的影响(图3A)。在收缩期峰值期间(图3B),开窗支架内可观察到红色的高速血流。因开窗支架使主动脉弓部血液流动的面积减小,血流在经过开窗支架和主体支架之间的“通道”时增快。进入主动脉弓部的开窗支架一定程度上阻挡了血流流向降主动脉,因此在开窗支架升主动脉侧和降主动脉侧出现了蓝色的低速血流区域。在舒张期末(图3C),开窗支架内可观察到红色的回流。相较于收缩期峰值,舒张期末主动脉弓部血流流速低且不均一,但开窗支架和主体支架之间“通道”内血液流速仍较快。
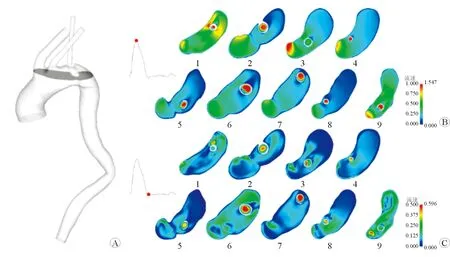
图3 主动脉弓部水平切面流速分布图
2.5 FDR 结果(表2、图4)显示:F-TEVAR术后,无名动脉的FDR即右侧头臂灌注的血流量占心输出量的11.2%~27.3%,平均值为(19.1±4.5)%。F-TEVAR术后右侧头臂的灌注较健康个体显著增加(P<0.05)。F-TEVAR术后,左颈总动脉的FDR占心输出量的1.5%~6.9%;平均值为(3.6±1.3)%,左锁骨下动脉的FDR占心输出量的1.3%~7.6%,平均值为(3.0±1.3)%。将上述两者血流量相加,F-TEVAR术后左侧头臂(左颈总动脉+左锁骨下动脉)的血流量占心输出量的2.8%~9.3%,平均值为(6.6±1.5)%。F-TEVAR术后左侧头臂的灌注较健康个体显著减少(P<0.000 1)。F-TEVAR术后出现左右灌注量严重不均等(右侧与左侧比值为3∶1)。

表2 F-TEVAR术后各大血管的血流分配比 %
结果(图4)显示:F-TEVAR术后,降主动脉的血流量(即体循环的灌注)占心输出量的64.5%~82.8%,平均值为(73.6±6.0)%。F-TEVAR术后降主动脉的血流量与健康个体差异无统计学意义(P=0.09)。
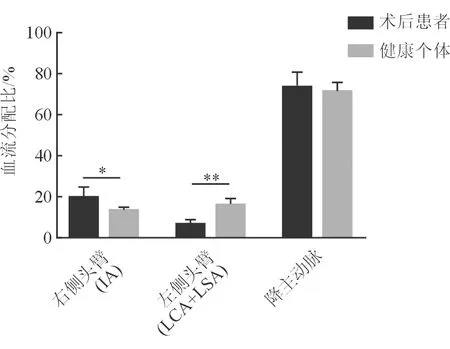
图4 F-TEVAR术后患者和健康个体血流分配比的比较
3 讨 论
近年来,在医工结合、学科交叉的背景下,国内外学者将工科领域研究动力机械流动问题的数值模拟方法应用到心血管领域,为心血管病治疗方式的改进和医疗器械的设计提供了新的思路。基于CFD技术的医疗软件FFRct(HeartFlow公司)与传统有创的血流储备分数(fractional flow rate, FFR)检测相比,能通过无创的方式对冠状动脉进行狭窄病变功能学评估[6-7]。Rijnberg等[2]将CFD技术运用到先天性心脏病领域,优化单心室病变的手术方案,提高了术后循环系统的效率,减少术后并发症,从而提高手术效果。Menichini等[8]将CFD技术运用于B型主动脉夹层临床结局的预测,使部分主动脉夹层假腔更倾向于血栓化的患者获得了药物保守治疗的机会,从而免于手术。
3.1 血流流速 本研究通过开窗支架开口处主动脉弓内血流流速的模拟结果证实,开窗支架伸入段对主动脉弓部血流产生影响,表明F-TEVAR术后主动脉弓和弓上分支内的血流异常。与流线结果相同,在开窗支架开口处主动脉弓短轴切面可观察到支架内红色高速血流,并且在舒张期仍存在逆向的向主动脉弓部回流的高速血流,这进一步验证了狭窄的存在。对经过开窗支架开口主动脉弓冠状位切面流速分布的观察发现,由于开窗支架伸入段的存在,来自升主动脉的血流在通过主动脉弓时流动面积变小,需要从开窗支架和主体支架之间流向降主动脉,因此在开窗支架和主体支架之间可观察到加速血流。在开窗支架的后方出现了深蓝色的低速尾流,这可能与附壁血栓的形成相关。而主动脉弓部血栓的脱落会引起肠坏死、肾梗死、下肢动脉栓塞等严重并发症。随访中,尚未发现外周动脉栓塞事件,术后CT也未提示主动脉弓部存在血栓。
为了减少开窗支架伸入段对主动脉弓部血流的影响,术者应减小开窗支架伸入主体支架的长度,但伸入段过短会影响整个开窗结构的稳定性,导致开窗支架脱落,因此伸入段对主动脉弓部血流的影响和开窗系统的稳定性之间存在矛盾。目前,常用策略为在不覆盖椎动脉的情况下将桥支架总体长度的1/3~1/4伸入主体支架内,但缺乏循证依据支持。因此,在保证整个开窗结构稳定的前提下,如何减小桥支架对主动脉弓部血流动力学的影响是F-TEVAR手术后续研究的重要内容。
3.2 血流分布 F-TEVAR手术改变了主动脉腔内正常的解剖结构,而异常的解剖结构可能会对血流的分布产生影响。本研究对比了健康个体与F-TEVAR术后主动脉弓与弓上分支血管内血流量,描述了F-TEVAR术后血流分布的变化。以往研究[9-10]发现,健康个体弓上三分支的血流量之和约占心输出量的30%,右侧头臂的血流量(无名动脉)和左侧头臂的血流量(左颈总动脉+左锁骨下动脉)大致相等。通过对F-TEVAR术后血流分配的分析发现,术后右侧头臂的血流量相对于健康个体增加(P<0.05),左侧头臂的血流量相对于健康个体则显著减少(P<0.000 1),但弓上三分支总的血流量与健康个体差异无统计学意义;降主动脉血流量在术后患者与健康个体差异也无统计学意义。这表明F-TEVAR术后,主动脉弓上三分支的血流进行了重新分布,左右头臂的血流量比例从健康个体的1∶1变为1∶3。
目前,对于造成F-TEVAR术后主动脉弓上分支血流重分布的原理尚不清楚,可能是由于F-TEVAR术后特殊的开窗结构阻止了血流进入左侧头臂,而主动脉弓部存在的支架阻止血流正常输送至降主动脉,而使一部分额外的血流进入右侧头臂。因此,拟行F-TEVAR手术的患者需要在术前评估Willis血管环是否完整,否则术后左右头臂严重的灌注不均可能增加脑血管意外的发生。本研究随访中尚未发现严重的神经相关并发症,这可能提示纳入患者的Willis血管环完整,右侧头臂多余的血流均通过Willis环输送到了对侧;也可能与本研究纳入的病例数过少导致结果偏倚有关,将在后续的研究中增加病例,加强证据力度。
综上所述,F-TEVAR是治疗累及主动脉弓部胸主动脉病变的有效手术方式。但F-TEVAR术后主动脉腔内解剖结构发生改变,主动脉弓部及弓上分支血管内血流动力学存在异常,主动脉弓上分支的血流进行了重分布,左右头臂的灌注不均等。可根据F-TEVAR术后血流动力学变化来改良手术方法和支架设计。
