成纤维细胞生长因子10与呼吸系统疾病防治
2021-07-03侯东妮宋元林
宋 娟, 侯东妮, 童 琳*, 宋元林*
1. 复旦大学附属中山医院呼吸与危重症医学科,上海 200032 2. 上海市呼吸病研究所,上海 200032 3. 复旦大学呼吸病研究所,上海 200032
成纤维细胞生长因子10(fibroblast growth factor-10,FGF-10)是在20世纪90年代被发现的1种分泌型生长因子[1-2]。FGF-10可参与脊椎动物胚胎发育中多种脏器的形成,具有促进上皮细胞增生和伤口愈合作用。FGF-10在肺的胚胎发育过程以及成年肺组织损伤修复中起着重要作用,对肺内干细胞库的稳态和活化发挥着重要调控作用[2-3]。因此,其在肺部疾病的预防和治疗中具有潜在价值。
1 FGF-10的生物学特性
从系统进化角度来讲,22个FGF基因可以划分为7个亚家族(FGF-1、FGF-4、FGF-7、FGF-8、FGF-9、FGF-11、FGF-15/19,表1)。这7个亚家族又可根据其各自的生物学功能被分为:经典分泌型FGF(FGF-1、FGF-4、FGF-7、FGF-8、FGF-9亚家族)、内分泌型FGF(FGF-15/19亚家族)和胞内FGF(FGF-11亚家族)。其中FGF-10最早是由Emoto等[1]从人肺组织中分离出来的包含208个氨基酸的单链多肽,具有肝素结合特性,由于其与角质细胞生长因子(keratinocyte growth factor,KGF,又名FGF-7)在性质、功能、结构等方面的相似性而被命名为角质细胞生长因子-2(keratinocyte growth factor-2,KGF-2)。FGF-10是FGF-7亚家族的一员,其表达受Wnt信号通路的调控。3D类器官模型研究[2]发现,FGF和Wnt信号通路的协同作用对肺上皮的发育和损伤后修复起着至关重要的作用,分泌的细胞主要为成纤维细胞等间充质来源细胞。间质来源的分泌型FGF-10与细胞外基质中的硫酸乙酰肝素蛋白多糖(heparin sulfate proteoglycans, HSPG)紧密结合,后者对稳定FGF-10的结构、限制FGF-10弥散、增加其与FGF受体的亲和力发挥着重要作用[3]。FGF-10-HSPG-FGFR2二聚体的形成激活下游受体酪氨酸激酶。FGF-10与其受体(fibroblast growth factor receptor-2-Ⅲb, FGFR2Ⅲb)结合后,活化下游RAS-促分裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)或磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)-蛋白激酶B(protein kinase B, PKB,可称AKT)信号通路。FGF-10主要与成纤维细胞生长因子受体FGFR2Ⅲb结合,也能以较低的亲和力与FGFR1Ⅲb结合。同样结合于FGFR2Ⅲb受体,FGF-7结合受体后导致受体降解,细胞增殖;而FGF-10结合受体后,促进受体回收,细胞迁移。进一步研究[4]显示,FGF-10结合FGFR2Ⅲb受体后,使受体734位酪氨酸快速磷酸化,进而募集PI3K和SH3结构域结合蛋白4(SH3-domain binding protein 4, SH3BP4)形成复合体,促进受体回收(图1)。

图1 FGF与FGFR作用示意图

表1 FGF的分类及主要功能
FGF:fibroblast growth factor, 成纤维细胞生长因子;-:功能暂不明确。
FGF-10有着多种生物学功能。作用于上皮细胞,FGF-10可促进细胞迁移、分化和增殖,通过旁分泌的方式促进间质-上皮相互作用。FGF-10可促进伤口愈合,减少瘢痕生成。在脊椎动物胚胎发育时,FGF-10参与支气管、肺、四肢等多种脏器的形成。
2 FGF-10在胚胎肺发育中的作用
FGF-10对肺分支形态正常发育非常重要。肺发育期间肺泡上皮祖细胞的分化、增殖和存活受FGF-10调控。在肺发育早期,视黄酸和无翅型MMTV整合位点家族成员5a(wingless-type MMTV integration site family, member A, Wnt5a)刺激早期FGF-10表达[5-6],FGF-10主要在远端肺间质和气管腹侧面的间质中富集,对于调节上皮增殖和谱系分化、驱动上皮细胞损伤后修复起着重要作用。FGF-10通过激活Akt活化上皮细胞β-连环蛋白(β-catenin)信号,防止远端上皮祖细胞分化为表达Y染色体性别决定区域基因2(sex determining region Y-box 2, SOX2)的气道上皮细胞[3],远离FGF-10的上皮细胞逐渐分化成SOX2阳性气道上皮细胞。FGF-10也可以调节近端上皮分化,如FGF-10抑制SOX2阳性气道上皮细胞分化为纤毛细胞,促进其向基底细胞方向分化[7]。
FGF-10/FGFR2在小鼠肺上皮分支正常形态的形成中起重要作用。FGF-10-/-小鼠因为肺脏发育不良出生后即死亡,虽然有胚胎气管形成,但是随后的肺芽形成被破坏[8]。FGF-10的刺激对管状肺芽特定的生长方向起重要作用。当肺芽延长时,靠近肺芽末端间质中形成FGF-10表达高峰;当末端分支或侧芽发生时,则分别形成2个FGF-10表达高峰,单一表达峰或双表达峰受肺芽末端与肺边界的距离影响,距离较远时形成单峰,距离近时则形成双峰[9]。
此外,FGF-10-ETS异构体(E26 transformation-specific variant,ETV)-Sonic hedgehog(SHH)反馈抑制环路在肺发育过程中调控支气管分支的形成。在胚胎肺分支形成的过程中,FGF-10诱导末端气道上皮表达骨生成蛋白4(bone morphogenetic protein-4, BMP-4)和SHH,后两者又可反馈抑制邻近间质中FGF-10的表达。Hippo信号在进化过程中高度保守,对于调节器官形态、干细胞行为等非常重要,Hippo信号可通过阻断FGF-10和β-catenin来促进肺上皮祖细胞的谱系定向[10],具体见图2。此外,BMP-4还能促进间充质向支气管旁平滑肌分化,延缓上皮增殖,辅助调节肺分支的发生。FGF-10-鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene, KRAS)-SOX9信号驱动肺芽分支,以此来拮抗其过早分化[7]。

图2 末端气道上皮细胞与间质细胞相互作用
FGF-10的精密调节对正常肺形态的发生至关重要。FGF-10在胚胎肺发育中并不单独发挥作用,FGF-1和FGF-9可能通过自分泌形式介导FGF-10的信号转导和肺上皮分支形成。与FGF-9主要促进近端肺上皮如纤毛细胞和基底细胞的增殖和分化不同,FGF-7和FGF-10可直接诱导远端肺上皮分化。此外,在肺发育的假腺管期,FGF-9-FGFR3通过PI3K信号通路抑制远端上皮细胞的分化,FGF-10-FGFR2Ⅲb更多依赖MAPK信号通路促进上皮细胞增殖和分化,两者在一定程度上维持相对平衡[11]。
胚肺发育过程中,曾出现2波FGF-10阳性细胞,第1波FGF-10阳性细胞可转化为支气管旁和血管旁平滑肌细胞及脂成纤维细胞;第2波转化为脂成纤维细胞和1种Nkx2.1(-) E-Cad(-) Epcam(+) Pro-Spc(+)的未知细胞[12]。在成年肺中,FGF-10阳性细胞群则是组织原位间充质干细胞库。FGF-10信号对肺发育晚期脂成纤维细胞的形成具有重要影响。
3 FGF-10在呼吸系统疾病发病机制中的作用
3.1 支气管肺发育不良 支气管肺发育不良多发生于感染或受炎症反应刺激的早产儿,其病理机制是由于囊状气道的发育停滞,囊状气道分支减少导致成熟肺泡数量减少。FGF-10的分泌缺陷与支气管肺发育不良有关,患儿肺组织中多发现FGF-10表达下调[13]。正常FGF-10在肺间质细胞中的表达可被微生物产物或炎症反应干扰,这种干扰主要由核因子-κB(nuclear factor κB, NF-κB)信号介导,活化NF-κB入核并激活相关基因的转录表达,除了激活促炎基因的表达,NF-κB也可抑制正常发育过程中重要基因的表达[14]。在实验小鼠模型中,Toll样受体2(Toll-like receptor 2, TLR2)或Toll样受体4(Toll-like receptor 4, TLR4)的激活抑制FGF-10表达,进而导致囊状气道发育停滞[13]。炎症信号导致的FGF-10表达抑制与NF-κB依赖的NF-κB p65(RELA)、SP1/SP3和FGF-10启动子相互作用有关[14]。此外,有团队在小鼠模型中发现microRNA-421可靶向沉默FGF-10,可能与支气管肺发育不良的发生相关[15]。
3.2 慢性阻塞性肺疾病 FGF-10与慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)的发生有关。普通人群中高达26%的人存在气道分支异常,增加了COPD的患病风险[16]。FGF-10基因无功能突变的杂合子患者,因单倍体基因剂量不足,患者肺功能检查提示不可逆性气流受限(提示患有COPD)[17]。此外,COPD易感性与FGF-10基因单核苷酸多态性存在关联。研究[18]显示,FGF-10基因rs2973644和rs10473352多态性位点可能与中国北方汉族COPD患者易感性相关,rs1011814多态性位点与COPD的严重程度相关,rs1448044多态性位点与肺功能下降相关。肺发育早期关键基因(如FGF-10)的突变可导致肺结构的异常,在长期环境因素(如烟草暴露)的影响下增加疾病的患病风险。
3.3 肺 癌 FGF-10对肺癌细胞具有调控作用。FGF-10可使肿瘤细胞自我更新能力降低,体外给予肺癌细胞FGF-10刺激,可减少肿瘤干细胞的富集,从而减少化疗抵抗的肿瘤干细胞组成,使得肺癌细胞对化疗药物敏感[19]。
3.4 可吸入颗粒物相关呼吸系统疾病 可吸入颗粒物(particulate matter, PM)与多种呼吸系统疾病相关,急性大剂量暴露主要表现为肺部炎症细胞浸润增加和血浆蛋白渗出增加,FGF-10预处理可以抑制高迁移率族蛋白B1(high mobility group box 1 protein, HMGB1)-TLR4信号通路来减轻PM诱导的炎症反应[20]。FGF-10有抗氧化作用,可降低活性氧的生成,以此来拮抗PM引起的细胞毒性,进一步减少铜绿假单胞菌对上皮的侵袭[21]。
3.5 特发性肺纤维化 特发性肺纤维化是一种病因不明的进展型、间质性肺病,治疗手段有限,病死率高,主要表现为活化肌成纤维细胞的聚集和细胞外基质蛋白的沉积,以及由此而造成的肺泡结构和功能的破坏,气血交换受阻。肺纤维化小鼠模型研究[22]发现,FGF-10+细胞可以促进活化肌成纤维细胞的形成,在疾病缓解期,后者又可获得脂成纤维细胞的特性;此外,特发性肺纤维化患者肺组织中FGF-10的表达明显上调,以成熟的纤维化病变最为明显,然而,早期损伤后重塑区域活跃的纤维化病灶中FGF-10的表达水平则较低,FGF-10有可能拮抗促纤维化的细胞因子(如TGF-β1)从而起到保护作用。
4 FGF-10在急性肺损伤/急性呼吸窘迫综合征(ARDS)防治中的作用
4.1 ARDS ARDS的病因是刺激因素对肺造成急性损伤,由此造成缺氧性的呼吸衰竭,以难治性低氧血症、非心源性肺水肿、呼吸困难为临床表现。ARDS的病理生理特征主要为肺容积减少,顺应性下降,通气/血流比例失调。其病理机制包括失控的炎症反应,广泛的内皮细胞和上皮细胞损伤,导致气血屏障通透性增加,肺间质及肺泡内广泛的液体渗出,肺泡内透明膜形成。ARDS是多种公共卫生急症如甲流、SARS、COVID-19等致死的重要病因,据统计全球每年有超过300万ARDS患者,总体死亡率约为40%[1]。国内外对ARDS进行了大规模的研究,但是在临床实际应用中,ARDS的治疗迄今尚缺乏有效的手段。
4.2 FGF-10对肺泡上皮细胞具有保护作用 在脂多糖(lipopolysaccharides, LPS)引起的急性肺损伤模型中,FGF-10的表达显著下调,损伤修复期FGF-10又可上调表达[23]。体外实验[24-25]显示,FGF-10通过活化MAPK通路,能够减轻石棉、过氧化物和机械牵张力造成的肺泡上皮损伤。FGF-10对肺泡上皮细胞具有促进增殖作用,FGF-10使过氧化氢刺激的肺泡上皮细胞内细胞周期蛋白含量显著升高,打破过氧化氢引起的G0/G1期阻滞,促使细胞从G0/G1期向S期过渡,从而进入分裂增殖期[24]。FGF-10转基因小鼠研究[26]显示,FGF-10可显著减轻博来霉素诱导的肺部炎症损伤和纤维化,增加存活的肺泡Ⅱ型上皮细胞的数量。
另外,在博来霉素诱导的急性肺损伤模型中,FGF-10-FGFR2Ⅲb信号可驱动远端气道上皮p63+/Scgb1a1+/SOX2+的支气管上皮干细胞去分化成新的基底细胞,后者可进一步分化成Ⅰ型肺泡上皮和Ⅱ型肺泡上皮,从而启动损伤后修复,FGF-10-FGFR2Ⅲb对维持新生基底细胞的干性、诱导其分化十分重要[27]。FGF-10可预防高原肺水肿,降低死亡率,改善氧合,减少气血屏障的破坏[28]。FGF-10还可以通过激活PI3K/Thr308/AKT信号通路、抑制NF-κB信号通路双向调控Treg细胞和Th17细胞的平衡,从而缓解急性肺损伤[29]。此外,FGF-10对LPS、机械通气、缺血再灌注引起的急性肺损伤均有保护作用[30-32]。在铜绿假单胞菌感染性重症肺炎小鼠模型中,FGF-10通过增加肺内细菌清除、增加肺泡巨噬细胞的数量及促进肺内源性间充质干细胞增生来降低死亡率[33]。但在大部分动物模型中,FGF-10均为提前2~3 d气道内滴注给药,FGF-10能发挥预防肺损伤作用。一项采用损伤后给药的研究[34]显示,FGF-10仍有一定抗肺损伤作用,但与预防性给药相比,作用不及预防性给药显著。
5 FGF-10在肺部的作用机制研究进展
FGF-10对急性肺损伤具有保护作用,对于FGF-10在肺内发挥作用的机制研究仍在探索中,目前已知的机制主要包括FGF-10对上皮细胞、内皮细胞、肺间充质干细胞3个方面(图3)。
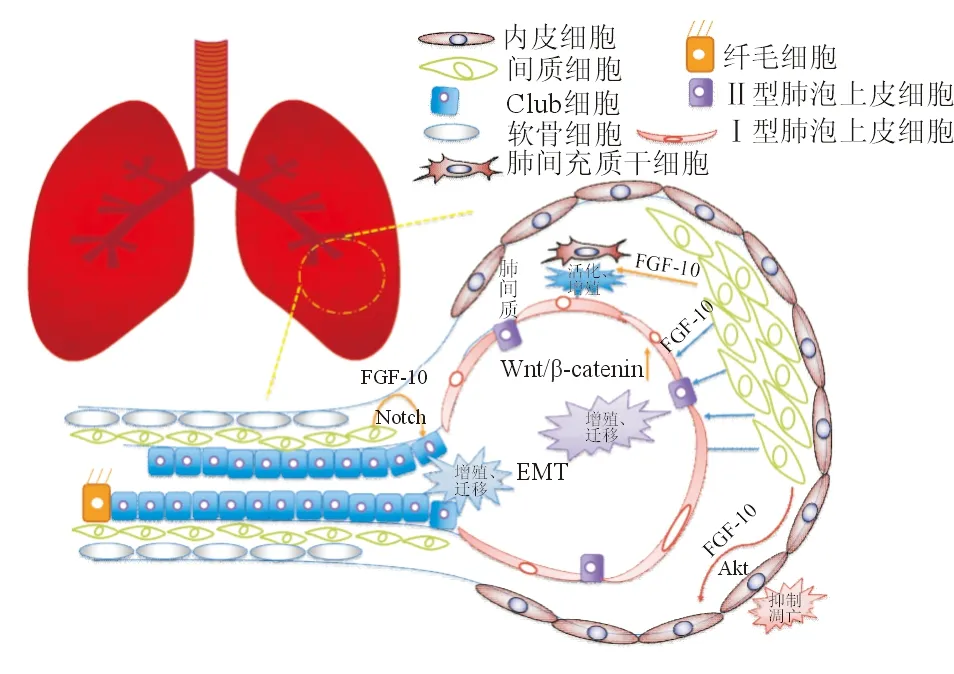
图3 FGF-10在肺部主要作用示意图
5.1 上皮细胞 有研究[30]发现,FGF-10能促进气道上皮细胞和肺泡Ⅱ型上皮细胞的增殖,增殖的肺泡Ⅱ型上皮细胞可通过迁移覆盖损伤的上皮,以修复和维护气血屏障的完整性。急性肺损伤时,肺表面活性蛋白的表达明显降低,FGF-10可增加表面活性蛋白(SP-A、SP-C)的合成,从而改善表面活性物质自稳态,对气血屏障的稳定有一定作用[30-31]。位于远端间质中表达FGF-10的细胞被认为是支气管旁平滑肌细胞的祖细胞[35]。当气道上皮被臭氧、博来霉素或萘损伤时,存活的上皮细胞分泌Wnt7b,Wnt7b活化支气管旁平滑肌细胞巢,使其表达FGF-10[35]。从细胞巢分泌的FGF-10随后作用于Club干细胞亚群(1种位于气道上皮的干细胞),打破静息状态,诱导增殖和启动上皮修复[35]。这种旁分泌作用对于活化尚存活的Club细胞非常重要。气道被萘损伤后,活化支气管旁平滑肌细胞分泌FGF-10,活化Club细胞内的Notch信号,诱导锌指转录因子(Snai1)表达。随后Club细胞经历短暂的上皮间质转化过程,以启动修复程序[36]。
5.2 内皮细胞 FGF-10对内皮细胞也有作用。体外研究[28,32]证实,FGF-10可上调AKT,抑制因缺氧诱导的肺微血管内皮细胞凋亡,FGF-10的这种抗凋亡作用可被PI3K抑制或EGFR抑制剂部分阻断。此外,在急性心肌梗死小鼠模型中,FGF-10可有效减轻心肌炎症和纤维化,抑制心室扩张,促进内皮细胞增殖,进而增加小动脉和毛细血管的稳定性,对心血管系统发挥保护作用[37]。
5.3 间充质干细胞 有研究[38]发现,间充质干细胞表面表达FGF-10受体,FGF-10对肺组织原位间充质干细胞具有调控作用。气道内滴注FGF-10可动员肺间充质干细胞,这些肺间充质干细胞可通过肺泡灌洗的方法被提取并分离培养[38]。将这部分肺间充质干细胞体外培养扩增后回输至急性肺损伤的大鼠肺内,可有效减轻肺损伤,促进损伤修复[38]。表达谱分析显示,FGF-10动员的肺原位间充质干细胞与骨髓间充质干细胞具有不同的功能特性和细胞内信号活化特征。这可能是肺间充质干细胞对肺损伤的保护作用优于骨髓间充质干细胞的原因之一[38]。因此,FGF-10可能通过动员肺间充质干细胞,从而发挥肺损伤保护作用。此外,本课题组前期比较过不同给药方式对FGF-10动员肺间充质干细胞的影响[38],发现FGF-10气道内滴注给药后3 d,可通过支气管肺泡灌洗液分离到肺间充质干细胞,而FGF-10通过静脉给药或磷酸盐缓冲液(phosphate buffer saline, PBS)气道内滴注后则难以分离到肺间充质干细胞。
6 FGF-10用于治疗人类疾病的安全性研究
美国人类基因组公司进行多项临床试验[39],将FGF-10用于治疗溃疡性结肠炎、糖尿病静脉溃疡、化疗所致的口腔黏膜炎等难治性上皮损伤,证实了FGF-10用于人体的安全性。新生源公司曾进行FGF-10用于浅Ⅱ度烧伤的Ⅲ期临床试验,前期研究结果显示其安全性良好。此外,本课题组连续观察了动物FGF-10气道内滴注给药后数月,未发现有致器官纤维化作用[28]。
综上所述,FGF-10参与细胞增殖、迁移、分化、凋亡以及胚胎发育等生理过程的调控,能动员肺间充质干细胞,促进损伤修复,抑制纤维化。其生物学特性以及对胚胎和出生后动物的作用及机制仍未充分阐明,其中包括FGF-10动员肺间充质干细胞的机制,仍需进一步深入研究。FGF-10对各种刺激因子造成的急性肺损伤及气道损伤均有保护作用,使用FGF-10重组蛋白治疗肺部疾病目前正在探索中,有望获得突破性进展。FGF-10作为一种旁分泌作用的蛋白,更适合局部给药,对FGF-10重组蛋白局部给药的研究将为FGF-10应用于人类疾病治疗提供新策略。
