磁性颗粒成像及其肿瘤诊疗研究进展
2021-07-03钟景金志发王楚天冯林刘文中
钟景,金志发,王楚天,冯林,刘文中
(1. 德国布伦瑞克工业大学电测量技术和基础电子技术研究所,下萨克森 布伦瑞克 38106;2. 中山大学附属江门医院放射科,广东 江门529030;3. 北京航空航天大学机械工程及自动化学院,北京100191;4. 华中科技大学人工智能与自动化学院,湖北 武汉430074)
癌症是危害人类健康的主要疾病之一。传统癌症治疗手段主要有手术、放疗和化疗。在化疗中,约1%的药物能到达肿瘤病变区域,而99%的药物都会被递送到其他组织或器官。传统化学药物治疗副作用大、治愈率低[1]。癌症的早期检测、药物的精准输送和新型肿瘤治疗技术的发展在癌症治疗中具有决定性意义。纳米技术给癌症的精准诊疗带来了曙光。科学家通过在药物中添加磁纳米粒子(magnetic nanoparticles,MNPs),通过物理靶向(如磁场)配合生物靶向技术实现药物向癌变区域的精准输送[2-4]。在此基础上,利用温度敏感的多聚体药物胶囊封装MNPs和特定的药物,当药物到达癌症病变区域,在该病变区域施加射频交变磁场,使得MNPs因磁滞损耗而产热;多聚体药物超过低临界温度(lower critical solution temperature,LCST)时,多聚体胶囊开始释放药物;当撤去外加交变磁场,多聚体胶囊低于LCST而停止释放药物[5-6]。磁纳米靶向药物有望实现药物的定点精准运输和释放,有助于降低化疗药物的副作用,从而提高肿瘤的治愈率。此外,磁纳米肿瘤热疗技术利用人体正常细胞和肿瘤细胞的可耐受温度的不同,在杀死癌细胞的同时可确保人体正常细胞的存活,从而实现癌症的精准治疗。研究显示,肿瘤细胞最高可耐受42℃,而人体正常细胞最高可耐受46℃[7-8]。在肿瘤热疗应用于中晚期癌症中,肿瘤病变区域的温度是一个关键性参数。当肿瘤病变区域无法达到下限温度42℃时,难以杀死癌细胞;当肿瘤病变区域超过上限温度46℃时,在杀死癌细胞的同时也会损害人体正常细胞,从而产生副作用。因此,研发一种全新的分子影像技术,使其实现在体MNPs浓度及其周围环境的温度和生物分子含量成像,将有助于实现癌症的精准诊疗,对于治疗中晚期癌症至关重要。
磁性颗粒成像(magnetic particle imaging,MPI)是一种全新的分子影像技术,能够实现实时的在体MNPs的三维空间分布成像。2005年德国飞利浦汉堡研究所研究人员首次在Nature上报道MPI技术及其仪器研发过程[9]。此后十多年来,MPI技术引起了德国[10-11]、中国[12-13]、美国[14]和日本[15]等国家研究人员的广泛关注,并获得了快速发展,涉及的领域包括工程技术、纳米磁性物理和生物医学等。目前,MPI主要包括基于零磁场点(field free point,FFP)和 零 磁 场 线(field free line,FFL)的2种成像方式。MPI的主要性能指标包括时间分辨率、空间分辨率和检测下限(limit of detection,LOD)。2017年Bruker基于FFP方式推出了一种商业化的MPI仪器。德国Buzug教授团队依据该仪器的测试结果显示,其LOD约为5 ng铁(测量时间为2.14 s)[16]。同年,美国Krishnan教授团队利用美国Magnetic Insight基于FFL的商业化MPI仪器研究结果显示,其LOD约为1.1 ng铁(信噪比约为3.9 dB)[17]。美国团队报道的LOD是在单点检测(非成像)下实现,其测量时间不详。MPI技术的空间分辨率取决于MNPs的磁学特性和外加梯度磁场的梯度,目前其空间分辨率为0.5 mm。根据德国Bruker的成像仪器实验报道,MPI的时间分辨率最快能够达到21.5 ms(20.4 mm× 12 mm× 16.8 mm的三维图像),能够实时看到小鼠心脏的跳动[18]。有关MPI的成像方法和仪器仍处于快速研发阶段。相关MPI的技术性能(包括空间分辨率和LOD)有待进一步提高。
1 磁性颗粒成像原理和仪器研发
1.1 成像的基本原理
理想情况下,在磁场激励下具有超顺磁特性的MNPs的磁化响应服从郎之万函数[19]。根据郎之万函数的非线性,在频率为f0的交变磁场激励下,MNPs的磁化响应不仅含有基波频率f0信号,还含有该基波频率的其他高次谐波i·f0信号,其中i表示谐波次数,f0表示激发磁场频率。MPI技术主要利用具有超顺磁性的MNPs在直流梯度磁场和交变磁场下的非线性磁化响应来实现空间编码和成像(见图1)[9]。在纯交变磁场(无直流偏置磁场)激励下,MNPs在时域上表现出很强的交变磁化响应信号,在频域上具有丰富的频谱信息;而在交变磁场的基础上额外叠加直流偏置磁场,MNPs会因直流偏置磁场的增大而迅速饱和,不再对交变磁场的激励产生任何响应。此时,MNPs在时域上表现出没有交变磁化响应信号,在频域上没有频谱信息。因此,为实现MNPs的空间编码,在成像区域通过一对反向的永磁体(或超导磁体)施加梯度磁场,这对反向的永磁体将在中心位置产生一个FFP。在成像区域中施加交变磁场,只有FFP区域的MNPs对外加交变磁场产生响应,具有交变磁化强度;远离FFP区域的MNPs会因直流偏置磁场达到饱和而不产生交变磁化信号。此时,测量得到的信号就包含MNPs在FFP位置的浓度信息。当将FFP在成像区域中移动,就能实现整个成像区域MNPs浓度分布信息的获取,即MPI。
1.2 MPI仪器研发
根据MPI原理,所有MPI仪器主要包括磁场激励和MNPs磁化响应测量2个部分。三维MPI仪器的基本框架为(见图2)[18]:一对反向的永磁铁(电磁铁)产生梯度磁场,配合三维Helmholtz或者螺线管线圈,从而产生三维磁场,最终采用探测线圈来检测MNPs的交变磁化响应。
MPI仪器中磁场激励部分含有梯度磁场产生装置和移动FFP/FFL的交变磁场产生装置。在基于FFP的MPI仪器中,梯度磁场可以利用一对反向永磁体或者通反向电流的电磁铁产生。目前,大多数MPI仪器都使用25 kHz的交变磁场激励频率,该交变磁场的幅值直接决定MPI成像区域(field-ofview,FOV)。如当梯度磁场在x轴上的梯度(Gx)为5 T · m-1,且在x轴上交变磁场幅值(Hac)为25 mT,则该MPI仪器在x轴上的成像区域(FOVx)为10 mm。而该交变磁场的产生是MPI仪器研发中的一个难点。根据MPI成像原理,MPI主要测量MNPs的高次谐波。为实现高精度和高灵敏度的MNPs成像,激励磁场中应尽可能是单一频率,如只有25 kHz的频率成分,而在驱动激励线圈产生该交变磁场时,功率放大仪器必然会产生非线性,使得激励的交变磁场中产生高次谐波,称为总谐波失真(total harmonic distortion,THD)。这些谐波失真信号会直接耦合到探测线圈中,从而降低MPI仪器的性能,如LOD。因此,在MPI仪器研发中,在激励线圈前段需要设计滤波器(如低通滤波器或带通滤波器),滤除功率放大器产生的谐波失真信号,从而尽可能产生单一频率(如25 kHz)的激励交变磁场(见图3)[20]。此外,考虑在25 kHz下激励线圈的阻抗,需要设计相应的共振电路,使得在相同功率下产生尽可能大的交变磁场。

图 1 磁性颗粒成像原理图Figure 1 Schematic diagram of the principle of magnetic particle imaging
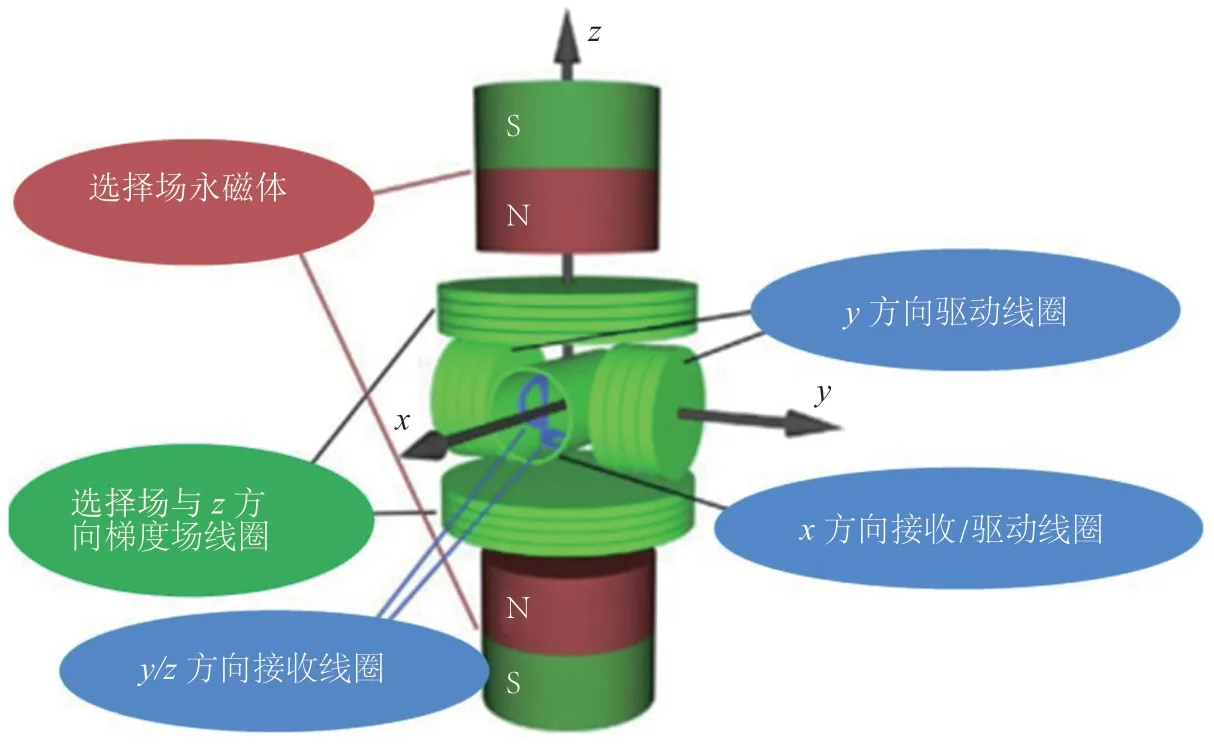
图 2 三维磁性颗粒成像仪器设计原理图Figure 2 Schematic diagram of a three-dimensional magnetic particle imaging scanner

图 3 典型磁性颗粒成像仪器的信号链Figure 3 Signal chain of a typical magnetic particle imaging scanner
MPI仪器中MNPs磁化响应测量部分是整个仪器研发中的核心。目前,考虑MNPs谐波信号测量所需要的线性度,MPI仪器中MNPs磁化响应测量部分主要利用探测线圈。在成像区域中,探测线圈的输出信号包括MNPs的磁化响应信号uM(x,y,z,t),也包括激励线圈中激励磁场耦合到测量单元的信号uH(x,y,z,t)。通常情况下,激励磁场耦合到探测线圈中的信号幅值可能比MNPs交变磁化强度高2~3个数量级(见图3)。其中,图3中的红色部分主要为交变激励磁场的耦合信号强度。因此,在探测线圈之后,必须设计带阻滤波器(陷波器)以滤除基波信号,从而使得输出信号主要为MNPs磁化响应的信号。在带阻滤波器(陷波器)之后,需要利用低噪声前置放大器放大输出电压信号,再利用数据采集卡采集获得时变的MNPs磁化响应,以便进一步的数据处理和图像反演[21],从而实现MNPs空间分布成像。
2 MPI在肿瘤诊断上的应用
精准的早期肿瘤诊断技术能够使肿瘤病人获得更充裕的干预时间,从而得到更有效的救治。通常情况下,随着肿瘤的增殖和转移,在特定的肿瘤病变部位会高表达出特定的生物分子。如乳腺癌细胞的产生和增殖会诱导microRNA-21的过表达[22];很多肝细胞癌患者的血液存在较高水平的甲型球蛋白[23];一些常用的肿瘤标志物,如糖类抗原CA19-9、癌胚抗原和癌抗原CA125,可以用来检测和诊断胆管癌[24]。因此,通过精密检测这些特定肿瘤的生物标志物,能够实现肿瘤的早期和快速诊断。而功能化的MNPs可作为生物分子检测的传感器,能够定量检测特定的抗原、抗体和病毒,从而实现相关疾病的早期诊断。其主要物理机制是:当MNPs绑定有特定的生物分子(DNA/RNA、蛋白质和抗体)时,其布朗弛豫时间会发生显著变化,从而影响其在交变磁场下的磁化强度及其频谱[25]。而MPI仪器能够检测MNPs在交变磁场激励下的频谱,通过重构技术不仅能够实现MNPs浓度的检测(成像),也能够分辨MNPs弛豫时间,从而实现特定生物分子的检测(成像)。该检测技术具有高灵敏度、易操作和定量检测的特性。
利用功能化的MNPs实现特定生物分子含量的定量检测是MNPs在生物医学领域的一个典型应用。研究发现,当MNPs绑定上目标生物分子时,一部分MNPs会形成聚集体,使得在交变磁场下MNPs的交流磁化率降低,从而实现抗生物素蛋白的检测[26]。另有研究利用抗凝血酶DNA功能化MNPs,实现了凝血酶的高灵敏检测,LOD约为2 pmol · L-1[27]。在旋转磁场(rotating magnetic field,RMF)下,待检测生物分子的存在使得MNPs旋转速度变慢,表现为MNPs的磁化强度相对激励磁场信号的时延增加(弛豫特性变化的表现)。因此,有研究利用MNPs在旋转磁场下的弛豫特性实现生物分子(抗体)的高精度检测[28]。另有研究利用磁粒子频谱仪(magnetic particle spectroscopy,MPS)实现肿瘤标志物蛋白酶(MMP-2)的检测[29]。原则上,MPI技术能够实现在体MNPs弛豫特性的成像,从而反演获得在体生物分子含量的图像。因此,通过测量MNPs在交变磁场下一次谐波和三次谐波的空间分布,计算三次谐波和一次谐波比值即可实现抗体空间成像技术(见图4)[30]:图像中红色区域的MNPs溶液中含有绑定有生物素的抗体,而其他地方的MNPs溶液中不含有抗体;当MNPs绑定有抗体时,其布朗弛豫时间变长,表现为其三次谐波和一次谐波的比值R3rd/1st降低;此外,在其他外界条件(如温度)相同的情况下,R3rd/1st只和MNPs的弛豫特性有关,而与其浓度无关。因此,通过三次谐波和一次谐波的图像获得的R3rd/1st图像可以直接计算出特定生物分子的含量。有研究利用MPI技术成像观测小鼠体内的肿瘤情况,注射MNPs到种植有乳腺癌的小鼠体内,再利用MPI实现了该MNPs的成像;该研究发现,种植有肿瘤的位置出现MNPs的富集,从而实现了肿瘤的成像[31]。目前,利用MNPs进行体外生物分子含量检测已有大量的研究,而在体检测仍处于初级阶段。利用MPI技术在实现MNPs浓度成像的基础上,有望实现MNPs弛豫特性的成像,从而能够用于特定生物分子含量的成像,并进一步发展为肿瘤的诊断技术。
图 4 基于磁性颗粒成像技术的抗体成像Figure 4 Imaging antibody with magnetic particle imaging
3 磁性颗粒成像在肿瘤治疗上的应用
3.1 靶向药物运输
目前,靶向药物运输仅仅实现了开环药物运输,而无法实现在体实时的药物分布检测。结合MPI技术和靶向药物运输将有助于实现具有闭环反馈控制的药物精准靶向;在药物运输过程中,可以通过控制MPI仪器的梯度产生定向运动,从而牵引包裹有MNPs的多聚体药物向特定的病灶运送。与此同时,利用MPI对MNPs的实时成像功能,可以实时监测药物的空间分布,从而构建一个基于MPI技术的实时药物追踪和驱动的闭环靶向药物运输系统。有研究设计了一套结合MPI技术和MNPs驱动的仪器(见图5)[32]:利用一对电磁铁产生梯度磁场用于实现MNPs的成像(成像模式),也可编辑电磁铁的电流产生聚焦磁场用于驱动MNPs在空间的移动(驱动模式);当该仪器工作在成像模式下,能够实现每秒2帧二维MNPs浓度的图像;当该仪器工作在驱动模式下,能够牵引MNPs向特定的位置移动。因此,通过编辑该仪器在成像模式和驱动模式之间切换,实现了MNPs在成像空间中按照设定的路径运动。该研究有望能够用于靶向药物的实时精准成像和运输。

图 5 靶向药物运输平台中实时的二维磁性颗粒成像图像Figure Real-time 2D magnetic particle imaging in the targeted drug delivery platform
此外,根据药物释放过程中MNPs弛豫时间及其磁化响应频谱的改变,可以利用MPI技术实现药物释放量的实时检测。当MNPs包覆在药物胶囊中,MNPs的磁化过程以尼尔弛豫为主导;当药物释放MNPs后,MNPs的弛豫模型包括布朗弛豫和尼尔弛豫。这些弛豫过程的变化会直接影响MNPs的磁化强度及其频谱特性。因而,可以通过研究MNPs弛豫模型的变化实现实时、在体和定量的药物释放成像。Zhu等[33]合成了一种纳米复合材料,该材料里面包覆有MNPs,并装载有阿霉素(DOX,见图6):当MNPs处于聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]的包裹状态时,MNPs被固定在PLGA中,即固定状态,则是尼尔弛豫主导;当MNPs随着药物释放出来,MNPs便可以自由移动,则是布朗弛豫和尼尔弛豫主导;随着药物的释放,DOX的释放量逐渐增加,并且可以自由移动的MNPs量逐渐增加。该研究发现,随着时间推移,药物释放量逐渐增加,MNPs的MPI图像强度也逐渐增加(见图6a、图6b),药物释放量和MNPs的MPI图像强度成正比例线性关系;随着组织厚度的增加,MPI图像强度几乎不变,而荧光成像(fluorescence imaging,FI)图像强度严重降低,表明MPI在应用于药物成像上具有较大优势。该研究有望实现定量的药物释放检测和成像,对于未来实现药物定量释放具有重要意义。

图 6 基于磁性颗粒成像监控的药物释放纳米复合材料示意图Figure 6 Schematic diagram of nanocomposite for magnetic particle imaging-based monitoring of drug release
3.2 肿瘤热疗
肿瘤病变区域的温度控制是肿瘤热疗法治疗肿瘤的关键之一。肿瘤病变区域的温度在体测量技术的发展有助于研发一套具有温度反馈控制的肿瘤热疗技术和系统,能够优化肿瘤病变区域温度过低或过高的情况,从而提高肿瘤热疗法治疗中晚期癌症的治愈率。研究发现,在射频磁场的基础上额外施加直流磁场能够实现温度的控制[34]。一般情况下,在直流磁场存在的情况下,MNPs的加热效率降低,从而可避免肿瘤病变区域温度过高。在此基础上,有研究提出了在射频磁场的基础上施加直流梯度磁场,从而实现定点定位的肿瘤热疗方案(见图7)[35]:当在人体施加一个交变磁场,在整个人体区域都会产生相对均匀的射频磁场,人体正常组织也会被加热;当利用单侧线圈施加射频磁场,只有人体浅表组织会加热,而无法加热人体深处组织;当在射频交变磁场下,施加直流梯度磁场时,只有FFP或零磁场区域(field free region,FFR)被加热。此外,利用MPI仪器中的FFL和MPI仪器的20 kHz的交变磁场能够实现肿瘤的定点定位加热;利用MPI可获得体内MNPs浓度分布图像,并可通过该浓度分布图像预测肿瘤热疗的吸收率(specific absorption rate,SAR);无外加磁场时,SAR直接和体内的MNPs浓度分布呈正比例关系;当利用直流梯度磁场产生的FFL时,只有FFL的位置会被加热,且根据测量的MNPs浓度和预测的SAR可预测温度变化的空间分布[36]。这些研究有望推动肿瘤热疗的进一步发展,进而实现定点定位的肿瘤热疗。

图 7 定点定位的磁流体热疗Figure 7 Localizing magnetic fluid hyperthermia
MPI技术不仅能够检测MNPs在体内的空间分布,还可以利用MNPs作为温度传感器实现温度成像。根据纳米磁学理论,MNPs的磁化强度及其频谱特性均具有温度敏感特性。通过测量MNPs在外加磁场下的磁化强度及其频谱可以反演获得温度信息。有研究利用MNPs频谱仪测量MNPs在不同温度下的三次谐波和五次谐波的幅值,并根据郎之万函数模型,利用三次谐波和五次谐波比值实现了非侵入式的温度测量[37]。另有研究通过解析郎之万函数模型探讨MNPs磁化曲线的温度敏感特性,实现了利用MNPs磁化曲线的非侵入式温度测量技术[19,38];再进一步研究在交变磁场下MNPs磁化模型,实现了利用MNPs在三角波和正弦波磁场激励下的非侵入式精密温度测量[38-39]。然而,这些研究均只能实现单点温度测量,而无法实现多维温度成像。利用MNPs作为温度传感器实现多维温度成像,仍面临空间编码方法不明确和MNPs浓度耦合等难题。2018年研究人员基于MNPs在不同温度下的频谱特性,利用彩色MPI技术测量MNPs在不同温度下的弛豫,实现了定性的温度成像[40]。同年,其他研究人员利用扫描磁粒子频谱仪,测量MNPs一次谐波和三次谐波的空间分布,并利用独立反演技术,实现了定量的温度成像[41-42]。因此,相关研究成果有望能够结合肿瘤热疗法,在射频加热的同时,检测肿瘤病变部位的温度(场),从而实现在体多维温度场的测量和控制。
4 总结和展望
从2001年首次提出磁粒子MPI思路开始,到2005年首次公开报道实现MPI装置,MPI技术至今已历经20年。目前,MPI技术在LOD、空间分辨率和时间分辨率上均得到了进一步优化。此外,由于纳米材料制备技术的进步,MPI示踪剂MNPs的性能如饱和磁矩、粒径分散度等也获得了比较大的改进,MPI图像的灵敏度和空间分辨率均因此得到进一步提升。与此同时,MPI也逐渐走向生物医学领域的实际应用,包括干细胞示踪、免疫细胞示踪、肿瘤热疗、棕色脂肪示踪和生物分子检测等。另外,功能化成像的相关研究使得MPI在临床前阶段取得了一系列的进展。在多参数MPI技术上,基于纳米磁学的物体特性,研究人员已经在黏度、温度和生物分子含量等多参数成像领域获得了一些初步的研究结果。这些研究正在有力地推动着MPI在生物医学领域更深与更广的应用。
然而,尽管前景光明,MPI技术下一个20年的发展方向依然不是十分清晰。目前,MPI的理论LOD和空间分辨率以及现有MPI仪器架构是否可最终实现人体成像并没有十分清楚的结论。要进一步提升MPI的LOD和空间分辨率,必须要从物理层面的纳米磁性机制出发,进一步诠释MNPs在交变磁场和梯度磁场下的磁化特性,以及如何将MNPs及周边微环境的信息高性能地传输到体外检测装置,均有待有物理学背景的研究人员参与。在此基础上,工程领域相关研究人员可参与研究全新的空间编码优化算法,改进现有MPI仪器研发中存在的交变磁场失真等问题。而在生物医学应用领域,必须要结合MNPs在生物体内的弛豫特性,将彩色MPI技术应用到活体成像研究中,从而能够实现真正意义上的定量成像。MNPs的化学合成和生物功能化技术也会影响MPI的性能。可以明确的是,MPI向生物医学各领域推广应用将会成为相关领域下一个20年全新的研究热点。
