自组装结构药物的跨膜转运策略
2021-07-03王裕袁巍丹李开菊张健夫耿佳
王裕,袁巍丹,李开菊,张健夫,耿佳
(四川大学华西医院实验医学科 生物治疗国家重点实验室,四川 成都 610041)
药物在机体内需通过细胞膜才能发挥作用,其跨膜转运受多种因素影响,如药物亲水/脂性等自身理化性质,靶标部位的生理特征等。药物的跨膜转运方式可分为主动运输和被动运输。主动运输是指药物逆电化学梯度的跨膜转运,特异性蛋白选择性识别药物并允许药物通过,且需要消耗能量。主动运输可分原发性和继发性2种。原发性主动运输直接将能量用于物质的跨膜运输,一般ATP结合盒转运体介导的外排转运属于原发性主动运输,如普伐他汀(pravastatin)[1]。继发性主动运输并不直接消耗能量,而是通过由原发性主动运输产生的化学梯度来达到转移物质的目的,一般溶质转运体介导的摄入转运属于继发性主动运输,如二甲双胍(metformin)[2]。被动运输是基于细胞膜的半透性而不消耗能量的一种顺浓度梯度转运。被动运输又分为水溶性扩散、简单扩散和易化扩散。水溶性扩散是药物分子借助于流体静压或渗透压随体液通过细胞膜的水性通道而进行的跨膜转运,如维生素C钠[3];简单扩散是指脂溶性药物溶解于细胞膜的脂质层,顺浓度差通过细胞膜,如脂肪酸(fatty acid)[4];易化扩散不需要能量,不能逆电化学差转运,但其需要载体,如硫胺素(thiamine)通过细菌吡啶核苷酸摄取(pyridine nucleotide uptake,Pnu)家族的PnuT转运蛋白而吸收[5]。除了被动运输和主动运输,还存在膜动转运,某些液态蛋白质或大分子物质,可通过生物膜的内陷形成小胞吞噬进入胞内,如脑垂体后叶粉(powdered posterior pituitary)。
药物在生物体内运输过程中,不可避免地会涉及诸如稳定性差、半衰期短和难溶于水或难溶于脂质等问题[6]。药物载体作为能将药物装载后作用于靶细胞/组织的工具,能够解决上述部分问题。理想的药物载体应具有以下特点:1)没有毒性,对人体无副作用;2)能降解、排泄,不会残留于人体中;3)对靶细胞/组织具有高亲和性和特异性;4)在转运过程中不致药物失活,能将药物转运到作用部位以产生药理作用。但传统药物载体都是药物分子被动地装载在载体中,因此大部分药物载体存在药物包裹率低、易渗漏的问题[7]。自组装结构作为一种简单、自发、可扩展和多功能的纳米材料,具有弥补传统药物载体缺点的潜力。自组装是指分子的无序实体自发地排列成有序结构[8],能否实现自组装一方面取决于基本结构单元的特性,另一方面取决于非共价键的弱相互作用力的协同作用[9]。自组装药物跨膜转运的设计策略有2种方式,其一是自组装的材料在水性环境下,自组装成囊泡、纳米颗粒、胶束和纳米海绵等,并负载药物通过胞吞或转运蛋白协助转运等方式进入细胞,然后释放药物发挥作用;其二是自组装材料在细胞膜上自组装成一个纳米管道,用于药物的输送(见图1)。自组装药物载体除了理论上的低渗漏和高载药率的优点,也能保护药物避开恶劣的人体内环境和免疫系统的攻击,并在适当条件下,将药物释放于靶组织或器官中。
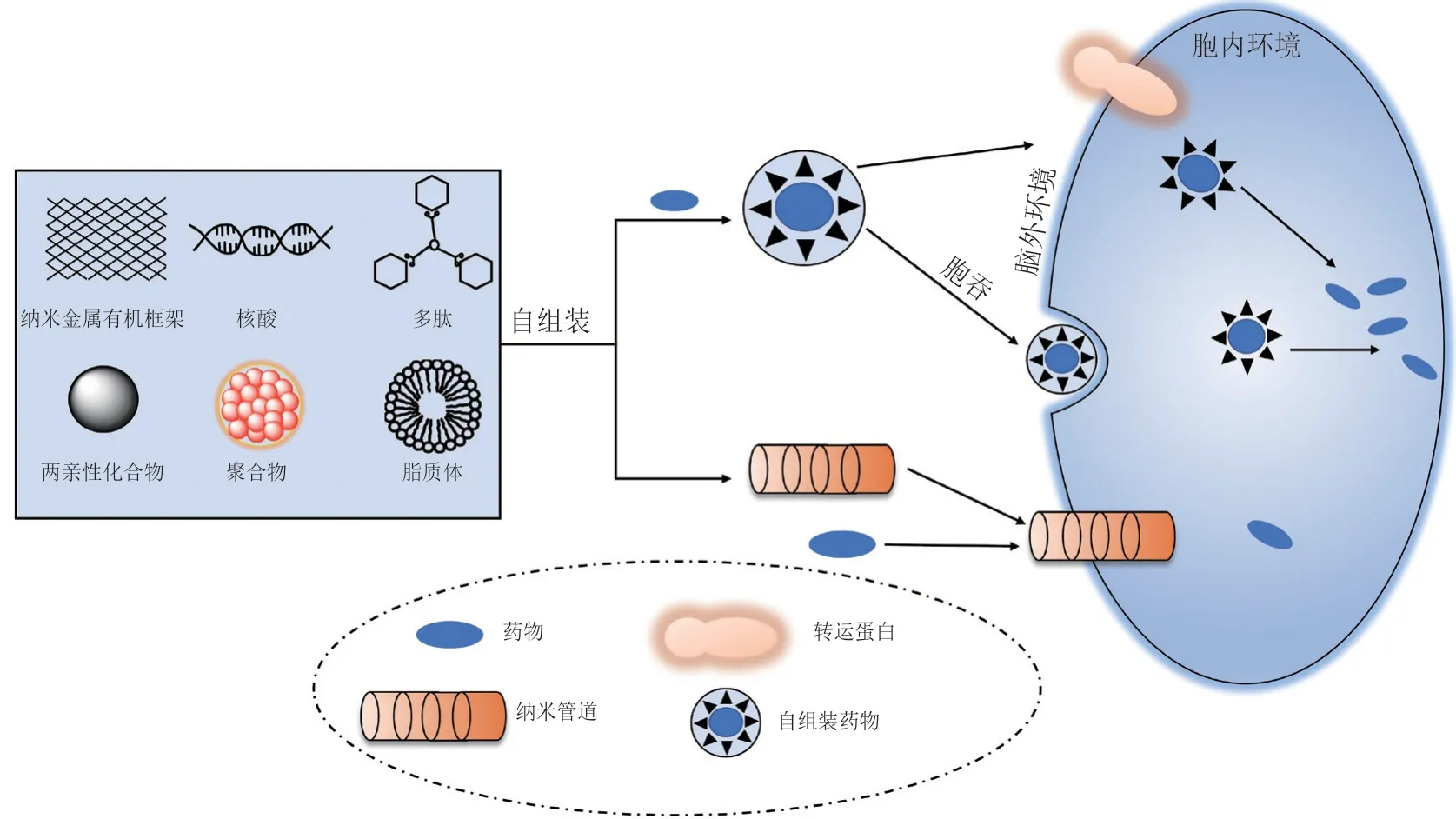
图 1 自组装结构协助药物进入靶细胞的2种途径Figure 1 Two pathways of self-assembly structure assisting drugs to transfer into target cells
1 自组装材料在药物跨膜转运领域的应用
1.1 金属有机框架自组装材料
金属有机框架(metal-organic frameworks,MOFs)自组装材料是由含金属的节点(如金属离子或簇合物)和有机配体(如羧酸配体或其他带负电配体)在温和条件下自组装形成的一类新型多孔晶体材料,已广泛用作递送载体[10]。与传统的多孔纳米材料相比,MOFs具有以下优异的特性:1)凭借其亲和性改善药物代谢性质,利用细胞的主动摄取,提高药物的生物利用率;2)通过包埋疏水药物,提高药物的溶解性及稳定性;3)可有效透过机体屏障,提高药效并实现靶向递送。
Horcajada等[11-12]将MOFs用作布洛芬(ibuprofen,IBU)药物载体并控制释放,随后又研究了几种羧酸铁(Ⅲ)MOFs中的药物释放。MOFs材料近年来也成功应用于胰岛素的跨膜运输,Duan等[13]开发了基于葡萄糖反应的MOFs胰岛素输送纳米系统,该系统依赖于MOFs对葡萄糖的刺激反应,可促进胰岛素的输送。MOFs应用最广泛的是癌症治疗。癌症治疗往往需要面对复杂的肿瘤微环境,与正常组织相比癌症组织呈酸性,因此构建pH响应性的载体可实现肿瘤部位的定点药物释放,从而提高药物有效浓度。对此Abazari等[14]合成了涂有壳聚糖(chitosan,CS)单分散层的生物金属有机框架(CS/Bio-MOF),并将其用作pH响应和靶标选择性系统以输送阿霉素(doxorubicin,DOX)治疗乳腺癌。CS是一种多功能的天然多糖,由β-(1,4)-连接的葡糖胺和N-乙酰基葡糖胺单元组成。该聚合物具有高度的生物降解性、生物利用性且无毒性。但在药物递送应用中,其存在不可控的药物释放曲线以及药物在其基质中分散不均匀的缺陷。该研究合成的CS/Bio-MOF可充当pH响应的可生物降解且无毒的载体,其提供了大表面积和许多表面官能团,从而使得载药量大大提高。作者在不同的pH条件下评估了CS/Bio-MOF负载和释放DOX的效率。实验表明,该释药系统在pH 6.8时几乎完全释放,而在pH 7.4时无响应。
1.2 DNA自组装材料
DNA的碱基互补配对特性使之形成双螺旋结构,具有可预测、可编程和结构稳定的优势,并且与其他生物分子相容,自组装特性强,可用于构建功能复杂的生物材料。裸露的DNA分子几乎只有在转染试剂的帮助下才能穿透细胞膜,而最近的研究表明,许多DNA纳米结构可以很容易地进入细胞,且具有很高的细胞吸收效率[15]。因此开发自组装DNA纳米结构用于智能和靶向药物的递送具有光明的应用前景。Arnott等[16]利用DNA可预测的自组装特性开发了一个可以感知温度,用于控制通道开启和可调传输的纳米阀来控制小分子转运。Li等[17]开发了一种自组装的多价DNA纳米结构作为药物载体,其结构类似蜈蚣,躯干是通过杂交链式反应的自组装DNA支架,该支架由2个生物素化的发卡单体在目标物诱导下形成,长躯干上装载DOX;腿为生物素化的适配体通过链霉亲和素-生物素亲和相互作用与躯干结合,腿为细胞结合适配体,充当靶向部分,牢固并选择性地抓住靶细胞,可通过内吞作用进入细胞,实现高效、靶向给药(见图2)。DNA纳米结构作为载体将药物携带进入细胞的跨膜动力学的研究也非常重要,Chen等[18]采用原子力显微镜技术,实时监测了单个四面体DNA纳米结构(tetrahedral DNA nanostructures,TDNs)的动态迁移过程,结果表明动态参数与TDNs的大小无关,而较大的TDNs在传输过程中略有旋转,不同大小的TDNs跨膜传输依赖于小泡蛋白介导的内吞作用。
1.3 两亲化合物自组装材料
两亲化合物是通过共价键作用将亲水端与疏水端连接起来的一类分子,自组装两亲化合物(selfassembled amphiphiles,SAAs)可由小分子或聚合物等类型的构件通过超分子作用力(如主体-客体相互作用)、氢键、静电相互作用、电荷转移相互作用和π-π相互作用,在水溶液中自组装形成囊泡、纳米颗粒、胶束和纳米海绵等[19]。SAAs凭借着更便捷的合成过程以及更复杂的结构和性质克服了传统两亲化合物制备耗时耗力、难以降解且利用率低的缺点。因此在药物递送领域中,SAAs逐渐取代了传统两亲化合物。Salih等[20]以β-环糊精和末端带有氨基的长碳链合成了一种新型糖基阳离子两亲性衍生物,并将其应用于抗生素缓释制剂。Wu等[21]通过自组装两亲化合物的改造将吉西他滨(gemcitabine,GEM)更好地递送于胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)细胞中,具体方法是将亚油酸(linoleic acid,LA)通过酰胺键共价连接到GEM的氨基上,该GEM前药能够在溶液中自发地形成纳米颗粒,纳米颗粒被PDAC靶向肽配体进一步修饰,构建成靶向性超分子纳米粒子,适合于静脉注射。该方法解决了GEM血液循环半衰期短、传送效率低、产生抗药性以及潜在严重副作用等问题。
1.4 肽自组装材料
肽自组装是肽自发形成有序聚集体的过程[22]。自组装肽包含组装形成纳米结构的短氨基酸序列或重复氨基酸序列的单体,其是具有独特结构的生物医学材料,可响应各种环境条件而形成。通过调控其理化特性,这些肽可以形成反应性高于常规非生物材料的各种结构。组装后,可用作药物输送的载体。肽自组装纳米结构展现出了巨大的优势,如良好的生物相容性、低成本、可调节的生物活性、高载药量、化学多样性等[23]。
肽的自组装形式有多种。2006年,Jayawarna等[24]将N-芴基甲氧羰基二苯丙氨酸(Fmoc-FF)确定为能够在生理条件下形成具有纤维纳米结构水凝胶的首批二肽之一。肽的纳米颗粒和囊泡,在药物输送领域也有着广泛的应用[25],如Fan等[26]将His-Ala-Val(HAV)与经典的靶向肿瘤的Arg-Gly-Asp(RGD)基序和Asn-Gly-Arg(NGR)基序融合到凋亡诱导肽序列AVPIAQK中,并进一步加工成纳米级载体,多西他赛以包裹疏水性药物紫杉萜(docetaxel)。此外,肽自组装体也可构建成纳米管用于药物递送[27]。例如,Chen等[28]通过在脂质双层中自组装环肽([Gln-(D-Leu-Trp)4-D-Leu],CP)纳米管(CPNTs)形成人工跨膜纳米通道,实现了尺寸小于1.0 nm的抗癌药物的跨膜递送,如5-氟尿嘧啶(5-fluorouracil,5-FU)、阿糖胞苷(cytarabine)等。其中基本的CP单元由偶数个交替的D-和L-氨基酸残基组成,并采用低能量的扁平环状构象。CP的所有主链酰胺部分几乎垂直于环结构的平面,从而允许CP环通过分子间氢键广泛堆叠以形成管状结构(见图3)。该通道的隧道效应破坏了生物膜离子势能,造成正常细胞生理平衡的“短路”,从而提供了外源物质进入的通道。

图 2 自组装多价DNA纳米结构装载药物原理图[17]Figure 2 Schematic diagram of self-assembly multivalent DNA nanostructures loaded with drugs[17]

图 3 自组装环肽纳米管的构建及其促进跨膜给药的示意图[28]Figure 3 Schematic representation of the construction of self-assembly CPNTs and their facilitation oftransmembrane drug delivery[28]
1.5 聚合物自组装材料
天然或合成聚合物在药物递送领域也有大量应用。天然聚合物具有大量可通过化学或生化途径修饰的官能团,研究者利用这一特点合成了许多基于生物聚合物的材料[29-30]。
在生物医学领域,多糖是天然聚合物的重要组成部分,其具有高稳定性、高安全性、可降解性和生物相容性的优点。应用最广泛的自组装聚合物多糖包括藻酸盐、壳聚糖和葡聚糖等。Li等[31]于2012年证明自组装的藻酸盐聚合物衍生物是增强阳离子肽和蛋白质药物口服吸收的潜在工具。除了作为DOX的递送载体,海藻酸钠自组装纳米颗粒也被用于抗原的递送[32]以及递送紫杉醇(paclitaxel,PTX)用于结肠癌的治疗[33]。壳聚糖对于亲水或亲脂性药物都具有良好的封装效果[34],Chen等[35]基于壳聚糖涂层的纳米粒子和藻酸盐涂层的纳米粒子自组装开发了一种用于胰岛素口服的pH敏感型聚电解质复合物。Mu等[36]也相继开发了一种基于壳聚糖的新型pH响应纳米胶束用于封装DOX靶向肿瘤细胞。葡聚糖是以葡萄糖为单糖组成的聚合物,Wang等[37]通过自组装辅助方法将聚丙烯酸与葡聚糖耦合自组装成具有pH和氧化还原反应双重响应的纳米水凝胶用于装载DOX。Zhang等[38]进一步利用多糖(葡聚糖、藻酸和透明质酸)与DOX共价耦合成pH敏感的前药纳米颗粒治疗肿瘤。
合成聚合物在自组装药物递送领域中也扮演着重要的角色,树枝状聚合物是其中较大一类,其每个重复单元上带有树枝化基元的线状聚合物,将疏水单元掺入树枝状聚合物中即可用作自组装药物载体[39]。Dong等[40]通过在聚乙二醇(polyethylene glycol,PEG)和PTX之间引入苄基硼酸酯连接物,开发了一种新型的可自组装成胶束的活性氧响应型前药PEG-B-PTX,在活性氧氧化后,胶束在肿瘤部位迅速释放PTX,这一策略也可用于输送其他化疗药物、生物活性肽和蛋白质。
1.6 脂质体自组装材料
脂质体最初称为小球,是具有由磷脂组成的双层结构的球形脂质囊泡[41]。脂质体在药物递送方面表现颇佳。各种研究已经证实,脂质体与特定药物制剂联合使用可治疗多种疾病。Rajora等[42]将过表达的低密度脂蛋白受体(low density lipoprotein receptor,LDLR)与 载 脂 蛋 白E3(apolipoprotein E3,ApoE3)结合用于开发胶质母细胞瘤靶向的卟啉-脂质ApoE3脂质纳米颗粒(porphyrin-lipid apoE3 lipid nanoparticles,PyE-LNs);通过优化,PyE-LNs组合物可同时赋予纳米颗粒胶质母细胞瘤靶向性和可激活的近红外荧光成像功能,这些颗粒经历了LDLR介导的内吞作用,以选择性地将卟啉从体外递送至过表达LDLR的胶质瘤细胞;同时可以对PyE-LNs组合物进行定制,以生成尺寸控制的盘状和球形/椭圆形胆固醇油酸酯(cholesteryl oleate,CO)负载颗粒,并稳定负载卟啉-脂质。目前缺乏可用于胶质母细胞瘤的治疗性干预措施,因此需要开发可以穿越血脑屏障并特异性靶向恶性细胞的递送系统。PyE-LNs代表了新型的治疗诊断工具,具有满足这些需求的潜力。
2 自组装药物的临床应用
自组装技术在临床医学中有着广阔的应用前景,其主要将临床相关成分的非共价结合诱导成有序的超分子。生物技术产业使自组装技术在构建新型多功能生物制品方面的应用日趋成熟,临床应用越来越多,并具有潜在的治疗效益,如延长半衰期、靶向给药等[43]。
在自组装药物领域,白蛋白PTX自组装药物是一个经典的例子。紫杉类药物难溶于水,因此需使用特殊的溶剂,溶解PTX常用的是聚氧乙烯蓖麻油(CrEL),该溶剂本身在体内会引起严重的过敏反应,临床应用受限。研究发现使用白蛋白装载PTX进入体内,不但能解决过敏问题,而且PTX的疗效也得到提高。白蛋白是体内疏水分子的天然载体,也是脂肪酸、激素和脂溶性维生素的运输载体。内皮细胞上糖蛋白受体gp60与白蛋白的结合刺激了小窝蛋白1(caveolin 1)的活化以及完整的纳米颗粒跨细胞膜的胞吞作用。利用白蛋白的天然特性,与PTX可逆地结合,可使PTX转运通过肿瘤血管内皮细胞,并集中在肿瘤区域(见图4)[44]。2005年,基于纳米颗粒结合白蛋白的PTX制剂(Abraxane®)正式被美国FDA批准用于转移性乳腺癌的治疗。

图 4 白蛋白负载紫杉醇转运进入肿瘤细胞的作用机制[44]Figure 4 The mechanism of albumin-loaded paclitaxel transportation into tumor cells[44]
长春新碱(vincristine,VCR)是一种从长春花植物中提取的生物碱,也是血液肿瘤中使用最广泛的细胞毒性化合物之一。VCR的作用机制与抑制有丝分裂纺锤体中的微管形成有关,导致分裂细胞停滞在中期,同时其诱导的异常微管形成会抑制细胞复制,最终导致细胞死亡[45]。然而,次优的药动学特性和剂量相关的神经毒性阻碍了该化合物全部潜力的实现。硫酸长春新碱脂质体注射液(vincristine sulfate liposomes injection,VSLI)是VCR的一种新型制剂,其将药物包裹在鞘磷脂和胆固醇纳米颗粒中,旨在克服标准VCR的剂量和药动学限制,即增加循环时间,优化向靶组织的输送,从而在促进靶组织剂量增加的同时不增加药物毒性。临床前研究表明,VSLI制剂可通过增强药物输送和组织靶向作用来改善抗肿瘤药物的暴露。药动学研究数据表明,脂质体包裹的VCR的清除速度比游离VCR的清除速度慢,并在更长时间内观察到脂质体VCR的较高血浆浓度。2012年8月,美国FDA批准VSLI用于治疗2次及2次以上复发的成人费城染色体阴性-急性淋巴细胞白血病[46]。更多已上市及临床试验阶段的自组装药物见表1。

表 1 FDA批准上市及进入临床试验的自组装药物[47-50]Table 1 FDA approved self-assembly drugs and those already in clinical trials[47-50]
3 结语
细胞膜作为细胞的天然屏障是阻碍药物进入细胞的主要因素,而膜转运蛋白的外排作用使药物进入细胞变得更加困难。在过去20年中,包括金属有机框架自组装材料、DNA自组装纳米材料、两亲化合物自组装材料、肽自组装材料、聚合物自组装材料和脂质体自组装材料在内的药物载体在药剂领域表现出优良的特性,这也主要表现在抗癌药物的递送方面,其作为治疗性给药系统在药物跨膜转运方面具有以下优势:1)自组装结构的粒径和表面特性可被操纵,以实现药物的靶向性;2)自组装结构具有较大的表面质量比,从而可以结合、吸收和携带大量的药物分子;3)纳米粒子可以很容易地控制药物在吸收和内化过程中以及在预定部位的释放,从而有助于减少药物的副作用及毒性;4)药物的释放速率以及载体的降解可以通过选择适当的基质成分来控制。
自组装结构可以通过不同的途径,如肠外、眼内、静脉、口服、鼻腔等途径输送,但受制于化学结构不确定、配方复杂、代谢相对困难、生产质控成本高和毒理、药代难以定量测定等缺点,较难实现临床转化。因此,设计出同时具备明确化学结构、增强渗透滞留效应、长血浆半衰期和智能响应等特点的新型自组装结构显得尤为重要。具备小分子及纳米材料特性的智能自组装材料具有分子结构确定、代谢研究相对容易和生产质量控制简单的优点,研究和制备该类药物载体为纳米药物的临床传化提供了一种工具。
