基于纳米发电机的自驱动技术控制药物释放的研究进展
2021-07-03杨安平曹雨刘莹赵超超李舟
杨安平,曹雨 ,刘莹,赵超超, *,李舟**
(1.佛山科学技术学院医学院,广东 佛山 528000;2.中国科学院北京纳米能源与系统研究所,北京 101400;3.广西大学物理科学与工程技术学院, 广西 南宁 530004)
药物应用于疾病预防、诊断和治疗时,均需制备成合适的剂型,以制剂的形式发挥效用[1]。药物剂型的发展共经历了5代,包括第1代的膏丹丸散,第2代的气雾剂、胶囊剂、片剂和注射剂,第3代缓释、控释给药系统[2-3],第4代靶向给药系统[4-5]和第5代脉冲式给药系统[6-7]。药物释放系统的改进推动了现代医疗的进一步发展,但也存在药物控释能力较弱、生产成本较高、药物材料具有毒性、植入式药物释放系统[8]能源供给短缺等问题。基于纳米发电机的自驱动技术为上述问题提供了切实可行的解决方案。纳米发电机不仅可以收集生物机械能,还可以很好地与现代生物、化学、医学等技术结合,集成到新型的智能药物释放系统中。本文介绍了纳米发电机的类型、原理和工作模式,重点阐述自驱动技术与微针经皮释药技术、膜控释药技术、电穿孔技术、微流控技术和电化学技术等相结合的药物释放相关研究进展,以期为纳米发电机的自驱动系统应用于临床治疗提供参考。
1 纳米发电机的工作原理
2006年,王中林院士首次提出并研制了纳米发电机,实现了将机械能向电能的转换[9]。过去十几年,包括压电纳米发电机(piezoelectric nanogenerator,PENG)[10]、摩 擦 纳 米 发 电 机(triboelectric nanogenerator,TENG)[11]和热释电纳米发电机(pyroelectric nanogenerator,PYENG)[12]在内的一系列纳米发电机技术推动自驱动系统取得了巨大的进展。人体蕴涵着丰富多样的机械能、化学能和热能等能量,其中机械能是最为普遍和丰富的能源,如人体走路、跑步,心肺、肌肉等器官组织的收缩舒张以及血液循环等生理运动均会产生机械能,这些能源均可以被自驱动系统收集转换为电能并加以利用[13]。纳米发电机的理论源头是麦克斯韦位移电流[14]。以TENG为例,其通常由2个摩擦层和2个电极层构成,2个摩擦层垂直/水平方向相对运动会在表面产生相反的摩擦电荷,在周期性外力作用下,这些电荷会产生随时间变化的电场,由此产生电位移通量的变化,导致2个电极间产生位移电流[15]。
1.1 压电纳米发电机
2006年,PENG的工作原理被首次阐述[9],其由压电材料以及压电材料两端的电极层组成。压电材料在外力作用下由于内部晶格中正负电荷的中心出现分离产生偶极矩,从而产生压电电势,此时如果压电材料外部电极通过导线构成回路,电子就会在外电路间发生流动来平衡该电势差。PENG有自由电子浓度高的电子型(n型)和空穴浓度高的空穴型(P型)之分。以纤锌矿结构的n型氧化锌为例,在正常情况下,Zn2+和O2-沿C轴方向呈四面体堆叠排布,其中心相互重合,当施加压应力作用时,电荷中心发生位错,从而产生偶极矩,诱导生成压电电势[16]。氧化锌纳米线与金属电极尖端的肖特基势垒可以暂时性存储电能,此时发生形变的氧化锌如果连接外部电路,就会出现电荷流动屏蔽该电势(见图1a)。
1.2 摩擦纳米发电机
TENG的原理是基于摩擦起电效应和静电感应效应的耦合:在2种摩擦层材料垂直接触或水平摩擦过程中会产生摩擦起电效应,在摩擦过程中,由于2种材料对电子的束缚能力不同,电子会从一种材料表面转移到另一材料表面,同时在2种材料背部电极上静电感应出相反的电荷,当2种材料分离后,异种电荷产生的电势差会驱动电子流动而产生电流[17]。基于此原理,TENG共发展出4种基本工作模式(见图1b)。
1.2.1 水平滑动模式 水平滑动模式纳米发电机包括2个摩擦层、2个电极层以及相应的连接导线。当2种电负性不同的材料在水平方向摩擦时,由于摩擦起电效应会在2种材料表面形成等量异种电荷。当摩擦层滑动分离时,分离部分的电荷不能得到完全匹配,通过静电感应导致2个摩擦层背部电极之间产生电势差。在机械力作用下摩擦层做往返运动,电势差会驱动电子在电极之间周期性流动产生电流。水平滑动模式可以实现更高效的电荷转移,滚筒、转盘和圆柱[18]等结构的TENG设计更容易实现较大电压和电流的输出。
1.2.2 垂直接触分离模式 垂直接触分离模式是2012年被发明的TENG的工作模式[11]。其特点是2种具有不同介电常数的高分子膜面对面堆叠,并在背部设置有金属电极层。由于电子亲和势的不同,在机械力的作用下,摩擦层表面会在接触时产生异种电荷,随后在外力作用下摩擦层分离,异种电荷产生的电势差会驱动电子通过外部电路流动。当2个摩擦层重新闭合,电子开始反向流动。这种工作模式的TENG具有制备工艺简单、易于封装及摩擦层材料损耗较小的优点。
1.2.3 单电极模式 单电极模式的TENG可自由移动,独立工作,它可以从自由移动物体上收集能量,很好地弥补了水平滑动模式和垂直接触分离模式的不足。该模式的TENG包括1个接地电极和1个自由移动物体,当上层自由移动物体接近或远离底部电极时,会改变局部电场,产生电势差,驱动电荷在电极和大地之间流动产生电流。水平滑动模式和垂直接触分离模式均可通过更改电路的连接方式设计成单电极模式[19]。
1.2.4 独立层模式 独立层模式TENG由1个可自由运动的摩擦层和2个背部含有电极的摩擦层组成,其中底部摩擦层与自由运动摩擦层之间并不完全接触。通过摩擦预处理使自由运动摩擦层产生电荷,当其向底部摩擦层接近或远离时,会改变原有摩擦层电荷的对称分布,从而产生电势差,进而驱动电荷在2个电极间流动产生电流。这种不完全接触的工作模式可以显著延长器件的使用寿命[20]。
1.3 热释电纳米发电机
PYENG是利用热释电效应将环境中的热能转化为电能的器件。热释电效应是指当某些晶体被加热时其极性随温度的变化而变化,导致晶体表面的束缚电荷发生变化的现象[21]。当温度保持恒定时,晶格极性不发生变化,没有电流产生。然而一旦材料的温度随时间而增加,内部自发性极化强度也会随之增加,当材料连接外部电路时,就会产生电子流动;当温度上升到最高点后,温度和材料极化不再发生改变,电流随之消失(见图1c)。此时降低晶体温度,晶体极化增加会使电流再次产生,如此往复,PYENG可以实现持续的电流输出。PYENG具有温度敏感性的特点,在温控型闭环药物释放系统中具有巨大的应用潜力。

图 1 3种纳米发电机的工作原理Figure 1 Working mechanism of 3 types of nanogenerators
2 纳米发电机的材料和结构研究
目前,PENG的材料和结构得到不断改进,由最初的单根氧化锌纳米线[9],发展到纳米复合物ZnSnO3和BaTiO3[22],再到无机薄膜材料NaKNO3、(1-x)Pb(Mg1/3Nb2/3)O3-xPbTiO3(PMN-PT)、聚偏氟乙烯(polyvinylidene fluoride,PVDF)、Pb(ZrxTi1-x)O3(PZT)[23]等,这些改进使PENG在输出性能、稳定性和生物安全性等方面有了很大程度的提升,为自驱动医疗系统在生物医学领域的应用提供了新的解决思路。TENG具有取材广泛、制备简单、价格低廉、质量轻、电压高等优点,在生产成本、灵敏度、输出性能、生物安全性上更具有优势[24];另外,压电、摩擦耦合结构发电机的提出进一步促进了自驱动技术的发展[25]。与PENG结构类似,PYENG通常固定在支撑薄膜材料上,如聚酰亚胺(polymide,PI)、聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)等,并且需要聚二甲基硅氧烷(polydimethysiloxane,PDMS)等生物相容性好的材料作为封装层来保证器件的柔性和生物安全性,PYENG特有的对温度敏感的性质为温控型智能药物释放系统提供了新的思路。在实际应用研究中,由于纳米发电机在收集体内生物能量方面具有巨大的潜力,部分研究已经取得了重大的突破。笔者课题组[26]于2010年首次成功地将单根氧化锌纳米线植入到大鼠中用于收集心跳和呼吸能量。2014年,笔者课题组[27]发明了植入式TENG用于收集正常呼吸的能量,并且实现了利用收集到的能量驱动心脏起搏器工作。之后笔者课题组[28]率先实现了TENG在大型动物荷兰猪的体内植入。2019年,笔者课题组[29]又成功地实现通过收集心脏跳动产生的能量来驱动心脏起搏器工作,研发出“一次心跳,一次起搏”的共生型心脏起搏器。另有研究发明了生物可降解的TENG及复合型TENG用于机械能及热能的收集[30]。相信随着研究的不断深入,TENG、PENG、PYENG作为自驱动能源,将为药物释放系统提供更多的新选择。
3 自驱动技术在药物释放中的应用
3.1 自驱动微针经皮给药技术
微针阵列是通过微电子机械工艺技术(MEMS)制作加工而成的精细复杂的微米级针状结构,可根据实际病灶位置和治疗需求来个性化定制微针形状、大小和针尖长度,其采用的材料多为金属、硅基及高分子聚合物,属于通过物理方法促进药物释放和渗透的方法之一。微针经皮给药的机制为:微米级针尖可以穿透表皮的角质层,到达一定深度的皮下部位,穿刺过程会产生微小的透皮通道,一些大分子的药物如抗原等可以借此通道在皮下指定位置释放并进入体内循环,因而大大提高药物的生物利用度。研究显示,微针技术可以穿透皮肤角质层,到达真皮层的毛细血管,防止皮肤角质层阻碍药物的吸收和利用[31]。胃肠道首过效应严重影响药物的治疗效果,微针经皮给药系统可以有效避免这一负面效应,同时改善患者的顺应性问题[32]。此外,与传统的透皮释药方式比较,微针继承了中医针灸学、经皮给药和穴位疗法的优势,将透皮给药和注射给药有效地结合,具有治疗效果稳定的优点,由于未触及神经组织,疼痛感弱,患者更易接受,可自主实施给药,因此微针是传统透皮给药的有效替代方式。目前,根据微针种类的不同可分为装载药物的多孔微针、空心微针,以及表面有药物涂层的不可溶微针和内部含有药物的可溶性微针。微针给药系统易于自主实施,减轻疼痛,但需要精确控制给药剂量,目前的普通微针难以实现该目的。
2015年,Wang等[33]提出了一种由可弯曲微针阵列、接触分离模式TENG、胰岛素药物储存池及微泵装置和干胶集成的可拉伸柔性微针贴片,该贴片可粘附在平坦的皮肤表面和关节部位以实现药物的递送(见图2a);单个可弯曲微针由PDMS构成的四梁柱底座和SU-8光刻胶形成的刚性尖头组成,在保证较高皮肤穿透率的同时又具有一定的体积变形性,能够有效避免皮肤穿刺后针头断裂的问题;通过按压或者弯曲贴片部位可产生电压输出,前者为26 V,后者为28 V;大鼠体内实验证实了该微针贴片可以有效地降低血糖水平。2016年,该课题组[34]又开发了一种精确控制胰岛素输送量的装置,通过手指拍打聚合物微泵实现药物的输送释放(见图2b):单电极工作模式的TENG被集成到SU-8型光刻胶制备的微针阵列上形成皮肤贴片,整个贴片通过摩擦纳米发电机制成的液体体积传感器来监测药物输送量;该贴片通过手指拍打可产生约30 V电压输出,具有精准控制药物释放量的优势。
2018年,Bok等[35]将基于鲑鱼脱氧核糖核酸(salmon deoxyribonucleic acid,SDNA)的可溶性微针与TENG组合开发的新装置可促进药物的透皮释放(见图2c):将该装置植入到离体猪肉的皮肤组织中后TENG的输出电压可达约95 V;在体外罗丹明B药物释放模型实验中,均采用2 Hz和0.2 MPa的外部机械力,60 s内有摩擦发电机装置和无此摩擦发电机装置药物释放量分别约为225和50 ng,证实了TENG可加速药物的释放。
3.2 自驱动膜控释药技术
膜控缓释制剂是将药物颗粒、片剂或粉末包被于具有良好机械性能和成膜性能的高分子聚合物薄膜结构内部,以膜两侧的浓度差作为释药的扩散推动力,通过薄膜结构的性质控制药物的释放行为和释放速率[36]。传统的膜控经皮给药系统实现了一定程度上的定时、定位药物释放,然而同微针经皮技术一样,其药物释放速度同样不能实现精确控制。
2019年,Ouyang等[37]提出了一个由TENG驱动的可控经皮给药系统,可精确按需控制药物释放剂量,该系统由经皮贴片(药物贴片和离子导入贴片电极)、TENG和电源管理电路组成(见图3a):TENG采用独立层工作模式中的转盘结构,摩擦层材料为聚四氟乙烯(polytetrafluoroethylene,PTFE)和铜(Cu);该给药系统可通过离子导入作用控制地塞米松磷酸钠或6-羟基荧光素的透皮给药;体外实验证实,与传统的经皮给药相比,这种基于TENG的药物传递系统的性能提高了50%。
2019年,Wu等[38]提出了一种由可穿戴TENG和离子导电水凝胶基贴片组成的基于自驱动离子电渗疗法的膜控经皮给药系统,可用于闭环的运动和疾病监测治疗(见图3b):可穿戴TENG采用接触分离模式,摩擦层材料为PTFE和铝(Al)片,可产生1 200 V的高压输出;TENG可以根据实际情况设计成各种形状,安装在身体的不同部位,并通过离子导入作用加速贴片上罗丹明6G(rhodamine,R6G)的经皮给药速率。
2020年,Liu等[39]开发了一种由TENG驱动的柔性药物释放系统,用于精确控制小分子药物的释放(见图3c):整个系统包括接触分离模式TENG、能量管理模块和药物释放装置,TENG摩擦层材料为氟化乙烯丙烯(fluorinated ethylene propylene,FEP)和Cu,亚格力板为背部支撑层,该TENG可以产生600 V的电压输出,聚3-己基噻吩[poly(3-hexylthiophene),P3HT]薄膜在Na2SO4水溶液中可切换润湿性的特性,该装置可通过调节这一特性间接控制药物释放装置中小分子的释放行为,具有结构灵活、自驱动的优点,可以实现小分子亚甲蓝、荧光素钠、R6G和水杨酸的精确可控释放。
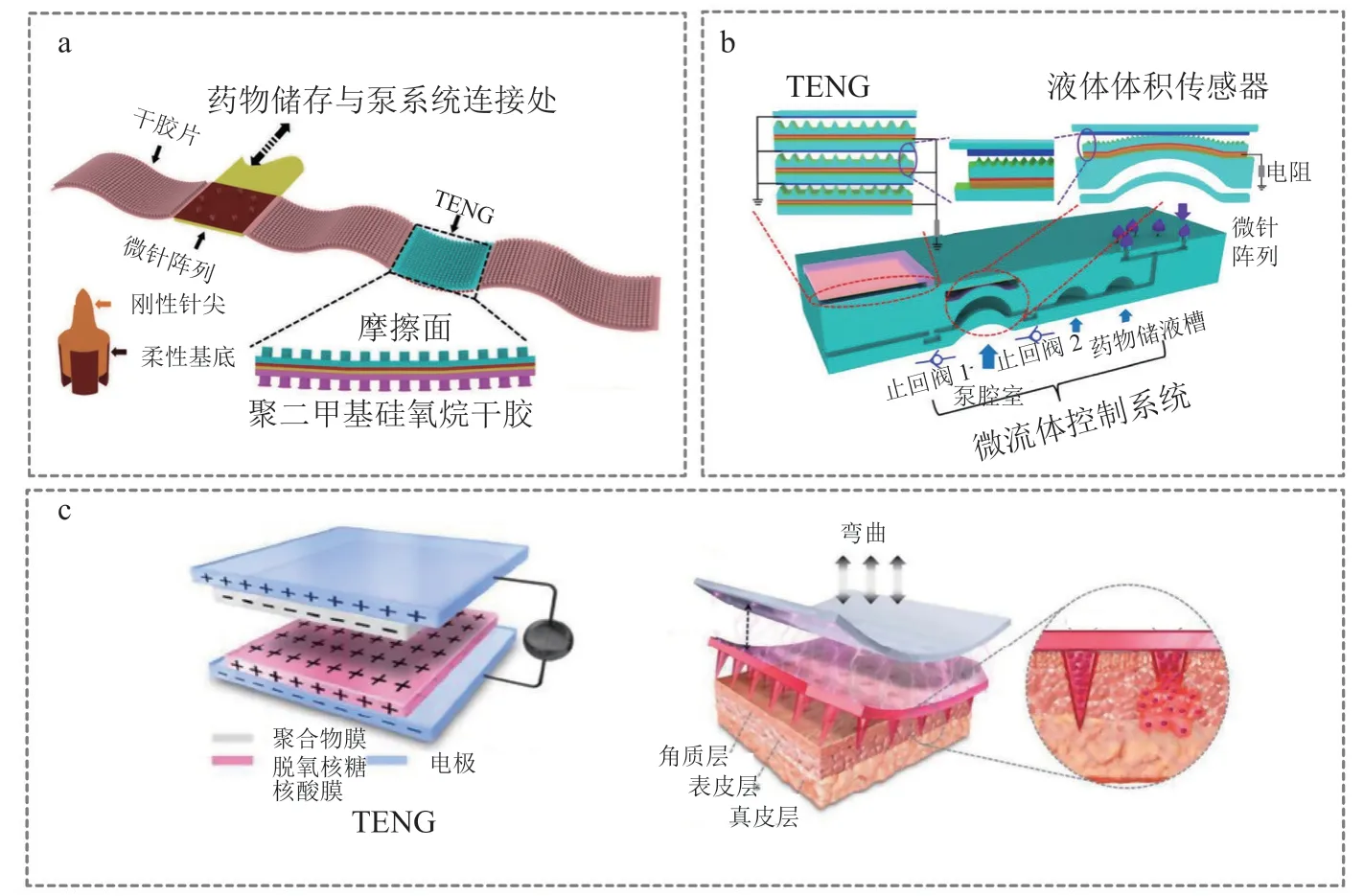
图 2 纳米发电机应用于微针经皮给药系统[33-35]Figure 2 Nanogenerators applied in drug release system integrated with microneedles[33-35]

图 3 纳米发电机应用于自驱动膜控药物释放系统[37-39]Figure 3 Nanogenerators applied in self-powered membrane controlled drug release system[37-39]
3.3 自驱动电穿孔技术
脉冲电场可以对细胞膜形成电穿孔效应,其作用机制是当外加电脉冲宽度为微秒至毫秒量级,电场强度达到105V · m-1的量级时,细胞膜出现大量微孔,产生结构变化,从而增加细胞膜的通透性,增加对各种药物、脂质体、蛋白质、基因物质等大分子的吸收。由电穿孔效应发展出的电穿孔技术,通过产生特定脉冲宽度、频率、电压值的高压设备与平板或者针状电极相结合,将高压脉冲输送到细胞悬液或机体组织中,通过一定数量的电脉冲击穿细胞膜,增加细胞膜对药物的吸收或对药物分子的释放。目前,临床和科学研究中的电穿孔仪往往质量或体积庞大,通常由高压脉冲发生器、电极及相应的导线构成,高压脉冲发生器可以输出几百到几千伏特的直流电压,并且可以通过高频开关控制脉冲的频率;储能电容器和输出回路中阻抗值的大小决定了脉冲的宽度,高压脉冲发生器输出的脉冲通过正负间距为几厘米或几毫米的铂电极施加到作用对象上,但庞大的体积严重限制了其在植入式脉冲药物释放装置中的应用[40]。同时,电极的设计和布置也是电穿孔技术研究的热点之一。
2019年,笔者课题组[41]设计了一种可用于控制载药红细胞膜在肿瘤部位定点释放的磁性互斥结构摩擦纳米发电机(magnet triboelectric nanogenerator,MTENG)(见图4a):MTENG采用接触分离模式,摩擦层材料为钛(Ti)片和PTFE,可产生70 V的电压输出,磁铁同极斥力结构的优点在于可使MTENG在封装和植入后仍然能够保持长久稳定的电能输出;MTENG产生的电场对装载阿霉素的红细胞膜具有精准的释放控制作用,将MTENG与叉指电极或微针电极结合,其在二维肿瘤细胞、三维肿瘤球以及小鼠体内的实体肿瘤3个层面均实现了低浓度给药下的优异肿瘤治疗效果。
2019年,Liu等[42]开发了一种将TENG与硅纳米针阵列电极相结合的电穿孔系统,并制备了适合于体外水平滑动转盘模式和体内接触分离模式的TENG,摩擦层材料为PTFE和Cu,电压输出为20 V,在体内外实验中其均能够在细胞损伤较小的情况下实现高效的细胞内药物释放(见图4b);该集成系统可最大限度地减少电穿孔过程中对细胞的损伤,降低质膜流动性并促进分子的内流,可将外源物质碘化丙啶、葡聚糖和小分子干扰核糖核酸(small interfering RNA,siRNA)有效地递送到人乳腺癌细胞、人宫颈癌细胞和鼠骨髓间充质干细胞等不同类型的细胞中。

图 4 纳米发电机应用于自驱动电穿孔药物释放系统[41-42]Figure 4 Nanogenerators applied in self-powered electroporation-based drug release system[41-42]
3.4 自驱动微流控技术
微流控技术涵盖了化学、流体物理、微电子、新材料、生物学和生物医学工程等多种交叉学科,是20世纪80年代兴起的一种精确操控微尺度液体的技术,在药物递送、化学分析、打印技术等方面有着广泛的应用[43]。为了精确有效地控制微流道中液体的位置与移动速度,开发有效的液体操作方法尤为重要,其中电润湿技术尤为行之有效。电润湿技术是通过改变液滴与绝缘基板之间的电压来改变液滴在基板上的接触角,从而使微流体发生形变和位移。该技术具有能耗低、影响时间短、稳定性好等优势,有利于对微米级别的系统进行操控。然而,在实际的电润湿技术应用中,通常采用绝缘介电薄膜分离电极和流体,因此需要很高的电压来完成对液体的操控。在大多数研究中,它需要至少200 V的高压来获得接触角的显著变化。这种应用于微流体的高强电压通常需要通过高压电源来提供,而且需要复杂的控制电路来调节电压输出强度,从而实现对微流体运动距离和速度的控制。高压电源和控制电路会增加系统的复杂性,而且安全性能较差,同时庞大的电源电路严重阻碍了该技术在生物医学系统中的进一步推广应用。自驱动微流控系统的成功研制可以省去电源和控制电路,增强了系统在临床用药物释放系统中运用的可行性。
2018年,Nie等[44]利用TENG结合电润湿技术开发出了微流控药物输送释放系统(见图5a)。在这个系统中,TENG采用独立层模式,摩擦层采用顶部自由移动的PI薄膜和底部的Al膜,可产生高达±3 000 V的脉冲电压输出。在TENG的驱动下,可实现将含有银纳米颗粒等纳米药物的液滴送到指定位置,10 g · L-1的液滴最远输送距离可达16 mm,同时还可以实现液滴在水平和垂直平面上的移动。此外,用最小体积70 ~ 80 nL的4个液滴上运载一个6 mm×8 mm的托盘,可以在TENG驱动下运输一部分微小的物体。独立层模式TENG展现了卓越的微观流体操纵能力,可以同时提供托盘运动的电源和控制信号,其中托盘运载的最大负载可达500 mg,最高控制速度可达1 m · s-1。自驱动微流控技术不仅可以在药物释放系统有极大的应用潜力,在微固体/液体机械手、微机器人和人机交互等领域同样具有广阔的应用前景。
2019年,Nie等[45]利用TENG和光可控黏附性质的材料研制了智能微流体系统,可以实现长距离微米/纳米液滴的输运(见图5b)。TENG同样采用独立层模式,摩擦层分别为Al和PI膜,电压输出大小约为±3 000 V,该输出可以驱动微滴移动距离最大至640 mm(最大距离/直径比为300),并且TENG还可以在2 mm厚度以内的介电层下操纵微滴移动,因此基于TENG的智能微流控系统在药物释放等领域表现出很好的适用性。

图 5 纳米发电机应用于自驱动微流控药物释放系统[44-45]Figure 5 Nanogenerators applied in self-powered microfluidics-based drug release system[44-45]
3.5 自驱动电化学技术
电化学是研究带电界面上所发生现象的科学,电化学反应过程中常伴随着电极表面析氢、析氧和析氯等电极反应,这些析出的气体会以气泡形式吸附于电极表面,从而造成电极活性面积减少、电极表面电位和电流密度的微观分布不均,产生电极极化。这种电化学反应中气体的产生会使密闭反应器中反应物体积发生改变,进而可以用来推动和调控药物的释放。
2017年,Song等[46]首先提出了基于TENG的植入式给药系统,该系统由TENG和药物输送系统组成(见图6):转盘结构的TENG由2层带有栅格结构的Cu层和中间的PTFE层组成,连接变压器和整流桥后可以输出12 ~ 16 V的电压;药物输送系统包括药物储存器、微管和硅衬底上的一对Au电极;当TENG发生旋转时,旋转体上的Cu栅沿PTFE薄膜进行滑动摩擦,产生自由移动的电子,进而通过电化学反应产生气体,从而对药物存储装置进行加压,使得药物通过微管被挤出,实现给药,药物的释放速度由TENG的旋转速度决定,在不同转速下实现了5.3 ~ 40 μL · min-1的包括荧光素分子在内的药物释放流量;离体猪眼实验结果显示,基于TENG的自驱动植入式给药系统成功实现了巩膜给药。

图6 纳米发电机应用于自驱动电化学药物释放系统[46]Figure 6 Nanogenerators applied in self-powered drug release system using electrochemical reaction[46]
4 结语
人体及其他动物身上蕴藏着化学能、热能及机械能等很多种能量。研究者提出了多种策略对不同形式的能量进行收集,进而构建自驱动药物释放系统,这些研究对可穿戴、可植入医疗器件的发展具有重要意义。包括PENG、TENG、PYENG在内的一系列基于纳米发电机的自驱动系统可以有效地收集以上能量,并在药物释放系统、生物传感、语音识别、生物监测等领域有了重要应用。本文主要聚焦通过纳米发电机从人体及动物体运动中收集机械能,用于药物释放系统的研究,包括微针经皮药物释放、膜控型药物释放、电穿孔药物释放、微流控药物释放及电化学药物释放等方向。但是,这些应用只是自驱动药物释放系统这一新兴研究领域的开端,为了充分合理利用自驱动技术并向实现最终的临床应用目标发展,还需要更多更深入的研究。首先,对于可植入场景,纳米发电机应更加小型化和柔性化,并且具有自适应性以减少其在身体的特定腔室中,由于生命活动及运动带来的形变导致的异物感和不良影响。由于植入式器件需二次手术取出,因此材料的生物降解性和可吸收性以及耐用性也需要着重研究;对于可穿戴纳米发电机,小型化、耐用性、封装及电学输出的问题也是今后的研究重点。其次,发电机输出性能的优化及电源管理模块的设计及电极等配套设施的研究需要进一步优化以符合实际临床要求。最后,考虑到未来智慧型药物输送释放体系,温度、湿度、血氧饱和度、血药浓度等的传感
