奶牛乳腺源大肠杆菌NJ17 crp基因缺失株的构建及其生物被膜形成能力分析
2021-07-02吕俊凡吴自豪
王 冉,吕俊凡,吴自豪,陈 伟
(塔里木大学动物科学学院,新疆阿拉尔843300)
肠道致病性大肠杆菌是引起奶牛乳腺炎的重要致病菌,不同地区大肠杆菌分离情况存在地区差异[1-3]。大肠杆菌内毒素(lipopolysaccharide,LPS)具有热稳定性,其在原料乳中的残留可对动物性食品安全造成潜在风险,限制中国奶业的健康发展[4]。目前,大肠杆菌所引起的动物和人肠道腹泻的致病机制已经较为清晰,但作为奶牛乳腺致病菌的感染机制尚不清楚。
Crp(cAMP receptor protein)是 cAMP 的受体蛋白,由基因crp编码。cAMP作为细菌中普遍存在的第一信使,可以调控毒力基因表达,调控细菌胞外多糖合成,从而影响细菌生物被膜形成[5]。Crp 与cAMP 结合后形成cAMPCrp 复合体,可促进TCA 循环,调控代谢途径的多个基因[6]。因此,Crp蛋白在病原菌致病性、毒力因子产生等方面发挥重要作用。
本研究组于2017 年从患牛乳样中分离获得1 株大肠杆菌,命名为NJ17,是一种肠致病型大肠杆菌(EPEC)。为探究crp基因对奶牛乳腺源大肠杆菌NJ17 生物被膜形成能力的影响,本研究采用λ-Red同源重组技术,构建crp基因缺失株,并对其生长速率和生物被膜形成能力进行分析,为后续进一步研究crp基因功能提供参考。
1 材料与方法
1.1 菌株和质粒
奶牛乳腺源大肠杆菌NJ17(EPEC)由乳腺炎患牛体内分离获得。大肠杆菌DH5α 购自大连宝生物工程有限公司。pKD3(氯霉素抗性)、pKD46(卡那霉素抗性)由上海兽医研究所馈赠。
1.2 培养基及培养条件
LB培养基用于细菌的常规培养,SOC培养基用于电转化后的菌株复苏。λ-Red 重组酶诱导表达,需添加10 mmol/L阿拉伯糖。除含有质粒pKD46的菌株培养温度为30 ℃外,其余培养条件及质粒pKD46的消除均在37 ℃条件下进行。
1.3 PCR扩增
试验用于PCR扩增的引物见表1,引物由上海悉尼生物科技有限公司合成。参考文献[7-9],以pKD3为模板,用引物NJ17Crp-CF/CR扩增氯霉素抗性片段;以大肠杆菌NJ17基因组为模板,用引物NJ17Crp-UF/UR、NJ17Crp-DF/DR扩增crp基因上下游同源臂;片段均切胶回收,按一定比例混合后作模板,用NJ17Crp-UF/DR扩增打靶片段。

表1 大肠杆菌NJ17缺失株构建及鉴定引物Tab.1 Primers of E.coli NJ17 crp-mutant construction and identification
1.4 电转化与突变株鉴定
按常规方法制备感受态细胞[8]。电转产物分别为含有重组酶系统的pKD46 和打靶片段。电转条件为1.8 kV、1~6 ms、SOC 培养基 30 ℃(电转产物为 pKD46)或 37 ℃(电转产物为打靶片段)、复苏1 h,涂布于适宜筛选平板。使用外侧鉴定引物NJ17 Crp-UF/DR 和内侧鉴定引物NJ17 Crp-UF/CR对缺失株进行鉴定。
1.5 生长曲线及生物被膜测定
参考文献[8,10]将大肠杆菌NJ17 野生株和crp缺失株在LB液体培养基中培养至对数生长中期(OD600nm约2.0),以1∶100 接种至含有100 mL LB 液体培养基的锥形瓶中,37 ℃、200 r/min 培养,每 1 h 取样测量 1 次,绘制菌株生长曲线,试验重复3次。
生物被膜的测定方法参照文献[8,11],将大肠杆菌NJ17 野生株和crp缺失株在LB 培养基中静置培养过夜后,离心收集菌体,LB 培养液稀释调整至OD600nm为0.1,将每种菌株悬液 200 μL 加至 96 孔板,37 ℃孵育36 h 后,PBS 洗涤3 次,用0.1%结晶紫室温染色30 min。PBS 冲洗 3 次后,加入 100 μL 95%乙醇溶解结晶紫,使用酶标仪测定595 nm 处的结晶紫溶液光密度(OD595nm),每组样品重复6 次。
1.6 数据统计与分析
使用SPSS 17.0的t检验对数据进行差异性分析,结果以“平均值±标准差”表示。
2 结果与分析
2.1 奶牛乳腺源大肠杆菌NJ17 crp 基因缺失株的鉴定(见图1)
由图1可知,内侧鉴定引物NJ17Crp-UF/CR可从缺失株中扩增出1 891 bp的片段,而野生株无法扩增到条带;外侧鉴定引物NJ17Crp-UF/DR 可从野生株扩增到1 857 bp片段,从缺失株扩增到2 143 bp 的片段。两对鉴定引物PCR扩增结果与预期大小一致,表明大肠杆菌NJ17crp缺失株NJ17-Δcrp构建成功。
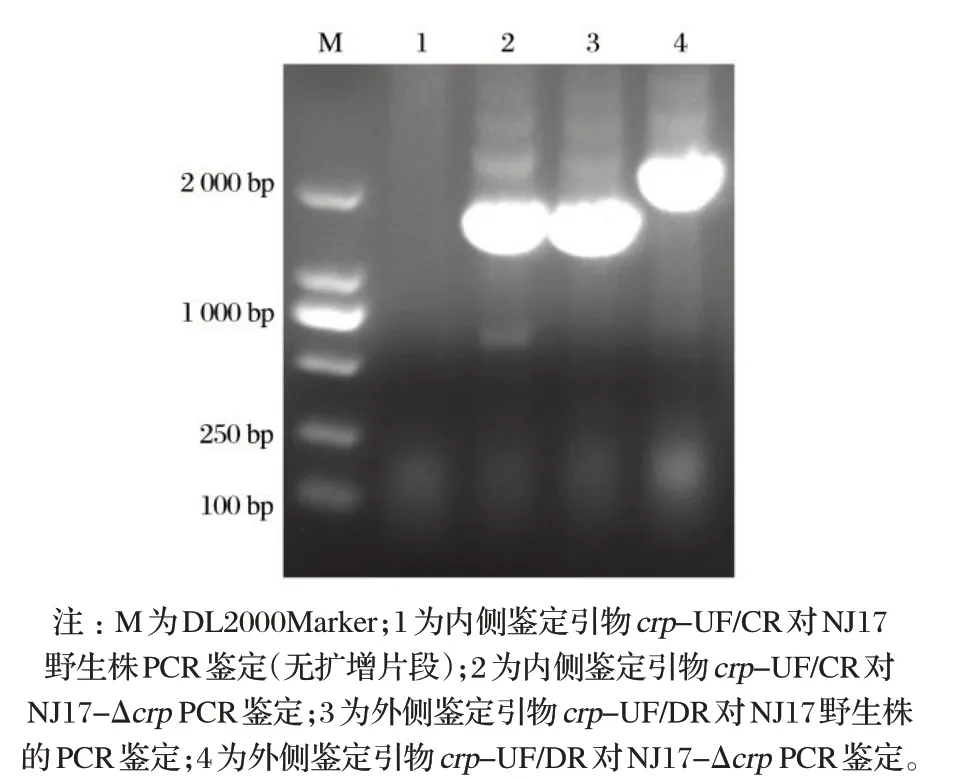
图1 奶牛乳腺源大肠杆菌NJ17 crp基因缺失株PCR鉴定Fig.1 PCR identification of E.coli NJ17 crp-mutant
2.2 野生株和缺失株生长速率检测结果(见图2)
由图2 可知,突变株生长速率极显著低于野生株(P<0.01)。野生株在2 h左右进入对数生长期,静止期OD600nm可达6。而突变株对数生长期较平缓,最高OD600nm约3,明显低于野生株,说明crp基因影响大肠杆菌NJ17的生长。
2.3 野生株和缺失株生物被膜形成能力检测结果(见图3)
由图3可知,与野生株NJ17菌株相比,crp基因缺失株生物被膜形成能力显著降低(P<0.05)。
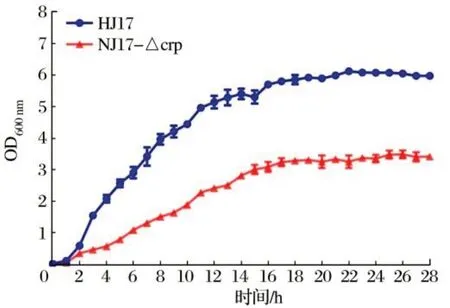
图2 野生株和缺失株的生长曲线Fig.2 Growth curve of E.coli NJ17 wildtype and crp-mutant type
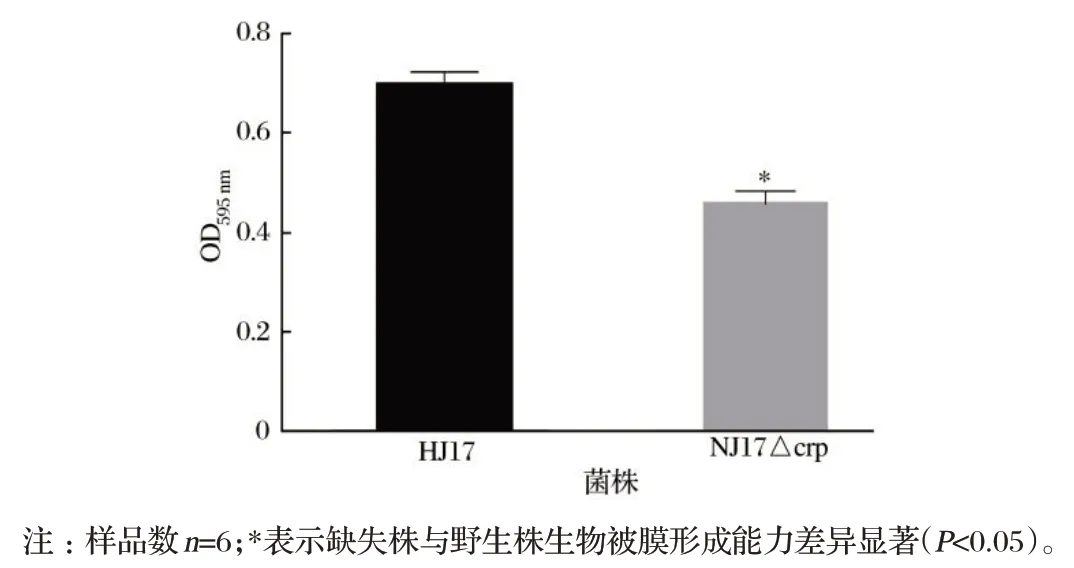
图3 野生株和缺失株生物被膜形成能力Fig.3 Biofilm formation of E.coli NJ17 wildtype and crp-mutant type
3 讨论
生物被膜形成能力检测已成为奶牛乳腺源大肠杆菌临床分离株生物学背景研究的重要内容。本试验结果表明,crp基因缺失株生长速率明显低于野生株,而细菌生长特性是影响大肠杆菌早期感染乳腺能力的一个重要因素。因此,crp基因在大肠杆菌早期感染乳腺组织可能发挥重要作用。研究表明,第二信使c-di-GMP 代谢相关基因缺失对奶牛乳腺源性大肠杆菌NJ17 的生长特性无显著影响,说明第二信使的信号传递可能与大肠杆菌中、晚期感染乳腺组织有关[12]。
研究表明,同一种细菌,其生物被膜状态下比浮游状态下对同一种抗生素的抵抗力要高10~1 000 倍[13]。大肠杆菌生物被膜的形成会增强其对抗生素的抵抗力,导致宿主抗生素治疗失败,从而引起宿主的持续性感染[14]。而cAMP-Crp途径调控细菌抗生素耐药基因的表达[15]。本研究结果表明,crp基因缺失降低了奶牛源性大肠杆菌NJ17的生物被膜形成能力,说明CRP-cAMP代谢参与调控大肠杆菌生物被膜形成,所调控的代谢途径可作为抗生物被膜制剂研发的靶标。
综上所述,crp基因缺失影响奶牛乳腺源大肠杆菌NJ17 的生长特性和生物被膜形成。因此,crp基因对大肠杆菌的特性具有重要调控作用,推测其可能在大肠杆菌早期感染宿主细胞中发挥重要作用。
4 结论
通过构建奶牛乳腺源大肠杆菌NJ17的crp突变株,crp基因缺失影响大肠杆菌NJ17 的生长,同时生物被膜形成能力明显降低。
