HPLC法测定并分析多种观赏花卉花青素的成分及含量
2021-07-02刘雨婷张祥李平平谢志和邓明华
刘雨婷,张祥,李平平,谢志和,邓明华,2*
(1.云南农业大学 园林园艺学院,云南 昆明 650201;2.云南省通海县经济作物工作站,玉溪市邓明华专家基层科研工作站,云南 玉溪 652700)
花青素作为植物自身两大次生代谢产物,在植物生理功能和观赏价值上具有重要作用。花青素为重要的水溶性植物色素,属于酚类化合物中的类黄酮,广泛存在于植物的根、茎、叶、花和果实中[1],其生物合成途径已被阐明[2]。花青素属于多酚的一个大的亚组,被称为类黄酮。在化学上,花青素是糖苷,其苷元是2-苯基苯并吡喃盐的多羟基或聚甲氧基衍生物。在过去的几年中,这些天然化合物由于其潜在的健康益处而引起了越来越多的关注。有人提出,食用富含花青素的蔬菜或水果,可对人或动物的大脑、肝脏和肾脏产生有效的保护作用,而且,对预防心血管疾病、控制肥胖或癌症治疗也有价值。除此之外,花青素对植物的色素沉着、抗氧化氧化以及防止紫外线和病原的损害也具有生理调节功能[3-4]。目前,自然界中已分离和鉴定的花青素多达600种,而它们主要从6 种花青素衍生而来,即天竺葵色素、矢车菊素、芍药色素、飞燕草色素、矮牵牛色素和锦葵色素[5]。
花青素的生物合成主要进行场所是植物的液泡,同时花青素也是植物能够显现出不同颜色的主要因素。花青素在植物细胞中以苯丙氨酸为底物,逐步经过酰基化、甲基化、羧基化、糖基化修饰后,在被转运、富集至液泡中[6]。花色与花瓣中的色素组成、液泡内pH 值、金属离子以及生长环境等多种因素有关,但其中最重要的影响因素是色素组成[7]。主要的花青素含量及组成不同导致花色的差异,在已查阅的文献中,飞燕草色素主要在蓝色系植物中含量较多,而在自然界中除蓝色系以外的植物及花卉并不含此类色素。矢车菊色素在蓝色、紫色、红色、白色植物中存在,在6 种常见的花色素中,其抗氧化作用最强。矮牵牛色素在酸性条件中呈红色和蓝紫色,在碱性环境中呈黄绿色。锦葵色素在紫色系植物中存在较多,而天竺葵色素和芍药色素在自然界中主要存在于红色系的植物中。
在不同观赏花卉中,对花色素的研究各不相同。酢浆草又名酸浆草、酸味草、斑鸠草、三叶草,为酢浆草科植物,酢浆草Oxalis-corniculate的全草[8],其在色素提取和测定的相关报道较少。瓜叶菊Senecio cruentus DC属于菊科千里光属,原产西班牙,性喜冷凉,不耐高温和霜冻,由于品种繁多,花色丰富常用于环境美化。紫薇Lagerstroemia indica,为千屈菜科,紫薇属,观赏价值很高,Egolf等人[9]的研究中发现在紫薇的花瓣中只含有飞燕草素、矮牵牛素和锦葵素,而李文芳等人[10]研究表明紫薇花色素属于花色苷类化合物,且存在6 种花色苷成分。目前对观赏花卉色素研究方面已有相关研究,但总体来看,这方面的研究主要以单种观赏花卉作为对象,整体研究较为分散,有些花卉在此方面的研究几乎为空白,如紫娇花等。另外局限于技术等原因,在同种花卉色素的研究上存在差异。
在植物花色素的检测方面,常用的有高效液相色谱法、分光光度法(包括pH 示差分光光度计法)等,由于高效液相色谱法成本较高,许多研究常用分光光度计法来测定植物花青素[11]。分光光度计法虽然具有方便、成本低的优点,但其在检测的稳定性和准确性上比高效液相色谱法差。同时由于花青素性质不稳定的原因,利用不同的方法测定的结果也不尽相同,所以完善的测定方法可在一定程度上提高花青素测定的准确性。
校园观赏花卉在绿化、美化等日趋发挥着重要作用,通常用于装饰花丛、花坛、花台等。在自然界中,蓝色系是较少的花卉色系,对于蓝色系花卉品种的培育是世界上许多园艺育种专家的研究重点,此次利用校园中蓝色系的观赏花卉进行了分析及研究。但在经笔者查阅相关资料发现对校园观赏植物花青素相关研究较少,且花青素液相测定条件较为严苛。因而,从此角度出发,本研究随机选择云南农业大学整个校园中观赏花卉:采集酢浆草、紫娇花、瓜叶菊、紫薇、沿阶草和长春花测定了其花青素含量及组分。研究花青素含量及组分对观赏花卉花色的影响。
1 试验材料与方法
1.1 试验材料
于2020年7月至8月,在云南农业大学校园中随机采集观赏花卉:酢浆草(Oxalis corniculata)、紫娇花(Tulbaghia violacea)、瓜叶菊(Pericallis hybrida)、紫薇(Lagerstroemia indica)、沿阶草(Ophiopogon bodinieri)和长春花(Catharanthus roseus)用于测定花青素含量及组分。
1.2 主要仪器和试剂
1.2.1 仪器
UV-1601 型紫外可见分光光度计(北京瑞利分析仪器有限公司);1260 高效液相色谱仪(美国Agilent公司,配有自动进样器、UVW 检测器和Chemstation工作站);Zorbax SB-C18(4.6 mm×250 mm,5 μm)色谱柱(美国Agilent 公司);HC-3018 型离心机(安徽中科中佳仪器有限公司);FA224 型电子天平(上海舜宇恒平科学仪器有限公司);HH-6 型数显恒温水浴锅(金坛市杰瑞尔电器有限公司);SB-5200 DTDN型超声波清洗机(宁波新芝生物科技股份有限公司);纯水机(ELGA,英国)。
1.2.2 试剂
矢车菊素(Cyanidin , ≥98%) 、飞燕草素( Delphinidin,≥97%)、锦葵色素(Malvidin,≥97%)、芍药色素(Peonidin,≥97%)、天竺葵色素(Pelargonidin,≥97%)、矮牵牛色素(Petunidin , ≥95%)均购于EXTRASYNTHESE(法国,热奈);浓盐酸(优级纯)、甲醇(色谱纯,天津市进丰化工有限公司);甲酸(色谱纯,山东西亚化学股份有限公司)。实验用水为超纯水。其他试剂均为国产分析纯。
1.3 花青素的检测
1.3.1 样品制备和提取
花青素提取和检测参考Gordon J等人[8]的方法,具体方法如下:取0.5 g 样品用液氮预冷后,放入研钵中加液氮后研磨,研磨成粉后按料液比1∶30(g/mL)加15 ml 的95%乙醇∶1.5 mol/L 盐酸(85∶15,V/V)提取液,倒入50 ml离心管中,用提取液洗研钵,超声处理30 min,在5 000 r/min离心5 min,吸取上清液;利用滤渣重复提取1 次,将2 次的提取液合并,定容至45 ml。
将上述提取液与浓盐酸(3∶1,V/V)混合,在90 ℃水浴40 min 后,放置于冰盒冷却,使花色苷在强酸环境中充分水解成花青素。水解后的溶液用提取液定容到4 ml,经0.45 μm 滤膜过滤后用于HPLC 分析。
1.3.2 标准曲线配制
分别精确称取花青素标准品1 mg溶解于10 ml 溶剂(提取液:浓盐酸,3∶1,V/V)中,配制成100μg/mL的储备液,再分别稀释成1、5、10、15、20、25 μg/mL的工作液。
1.3.3 总花青素测定
总花青素测定[12]具体实验过程如下:
(1)打开分光光度计。在测量前,允许仪器预热至少30 min。
(2)通过用氯化钾缓冲液稀释来确定样品的适当稀释系数,pH 1.0,直到样品在NVIS-max 时的吸光度在分光光度计的线性范围内(对于大多数分光光度计,吸光度应小于1.2)。将样品的最终体积除以初始体积以获得稀释因子(DF:参见步骤7)。
(3)用蒸馏水调零分光光度计的所用波长(510、520 、530 和700 nm)。
(4)制备样品的两种稀释液,一种用pH 1.0 的氯化钾缓冲液稀释,另一种用pH 4.5 的乙酸钠缓冲液稀释,分别用先前的稀释度稀释。确定稀释因子(步骤2)。让这些稀释液平衡15 min。
(5)在充满蒸馏水的空白对照玻璃比色皿中测量每种稀释液在Amax和700 nm 处的吸光度(以校正雾度)
(6)计算稀释样品(A)的吸光度,如下所示:
A=(Amax-A700)pH1.0- (Amax-A700)pH4.5
(7)使用以下公式计算原始样品总花青素含量中:

其中MW 是分子量,DF 是稀释倍数,ε为摩尔吸光系数(MW = 449.2 ,ε= 26 900)。
1.4 HPLC分析
花青素HPLC分析条件:色谱柱:Zorbax SB-C18 4.6 mm×250 mm 5μm;流动相:A:10%甲酸水溶液,B:10%甲酸甲醇溶液;梯度洗脱程序:0~5 min 90%A;15 min从90%A 到70%A;20 min 从70%A 到40%A;10 min 从40%A 到90%A;流速为:0.8 ml/min;检测波长:520 nm;柱温:30 ℃;进样量:5 μl。
1.5 数据统计与分析
用Excel 2007 和SPSS 23 进行数据统计分析,多重比较采用LSD 法。每个指标3 个重复,平均值±标准差。
2 结果与分析
2.1 HPLC花青素混标
以矢车菊色素(Cyanidin ,≥98%) 、飞燕草色素(Delphinidin,≥97%)、 锦葵色素(Malvidin,≥97%)、芍药色素(Peonidin, ≥97%)、天竺葵色素(Pelargonidin,≥97%)、矮牵牛色素(Petunidin ,≥95%)为标准品,建立花青素混合标准色谱图(图1),其中,最先在20.912 0 min 出峰的色素为飞燕草色素,随后在25.296 0 min、 26.991 0 min、 29.127 0 min、30.523 0 min、31.263 0 min 处出峰的分别为矢车菊色素、矮牵牛色素、天竺葵色素、芍药色素、锦葵色素。以各梯度质量浓度为横坐标,峰面积为纵坐标,得到单体化合物的回归方程如下:飞燕草色素,峰面积=40.19*C-24.09,相关系数:0.996 1;锦葵色素,峰面积=39.35*C-25.03,相关系数:0.995 9;矮牵牛色素,峰面积=37.02*C-23.47,相关系数:0.995 7;芍药色素,峰面积=44.32*C-24.46,相关系数:0.997 7;矢车菊色素,峰面积=38.17*C -23.98,相关系数:0.996 9;天竺葵色素,峰面积=38.57*C-19.38,相关系数:0.995 9,线性范围为1.00~25.00 μg/mL。

图1 花青素混标标准色谱图Fig.1 Standard chromatogram of anthocyanin mixed standard
2.2 HPLC所测花卉中花青素单体
以图1中的标准色谱图为参照,在所测六种观赏花卉中(图2),酢浆草在31.287 0 min 出峰,其所含花青素单体主要为锦葵色素,峰面积为17.142 8 mAU*s;紫娇花在25.254 0 min 出峰,所含花青素单体主要为矢车菊色素,峰面积为6.320 4 mAU*s;瓜叶菊在21.048 0 min 和25.368 0 min 都有出峰,分别为飞燕草色素和矢车菊色素,峰面积分别为57.694 8 mAU*s和9.512 4 mAU*s;紫薇花在21.046 0 min,27.050 0 min和31.303 0 min 出峰,所测出物质分别为飞燕草色素、矮牵牛色素和锦葵色素,其峰面积分别为24.368 9 mAU*s、10.665 1 mAU*s和14.032 2 mAU*s;沿阶草只在31.300 0 min 处出峰,为锦葵色素,峰面积为19.278 8 mAU*s,而长春花在34.344 0 min 处检测出未知组分。

图2 HPLC 所检测不同种类校园常见花卉花青素单体色谱图Fig.2 Chromatograms of anthocyanin monomers of different kinds of campus flowers detected by HPLC
2.3 几种校园常见观赏花卉花青素含量分析
由表1可知,除紫娇花未检测出总花青素外,其余五种都检测出总花青素;瓜叶菊、紫薇和沿阶草总花青素含量显著(P<0.05)高于酢浆草和长春花,长春花和酢浆草中总花青素含量之间没有显著性差异(P>0.05),瓜叶菊、紫薇和沿阶草中总花青素含量之间也有显著性差异(P<0.05),其中含量最高为瓜叶菊,为0.287 70±0.028 820 mg/g。利用HPLC 测定花青素单体(图3),基于回归方程计算可知,在所测定的六种校园观赏花卉中,瓜叶菊中含有飞燕草色素和矢车菊色素且其含量均为所测六种花中最高,分别为732.599 9 μg/g 和310.306 7 μg/g;紫薇花检测出飞燕草色素、矮牵牛色素和锦葵色素,含量分别为434.097 3 μg/g、331.930 9 μg/g、338.283 6 μg/g;沿阶草检测出锦葵色素为六种花中含量最高的,含量为399.483 3 μg/g;酢浆草检测出锦葵色素,为394.339 5 μg/g;紫娇花中为矢车菊色素,含量为297.323 2 μg/g;在长春花中未检测出六种常见的花青素。在所测的六种花中均未检测出天竺葵色素,芍药色素。
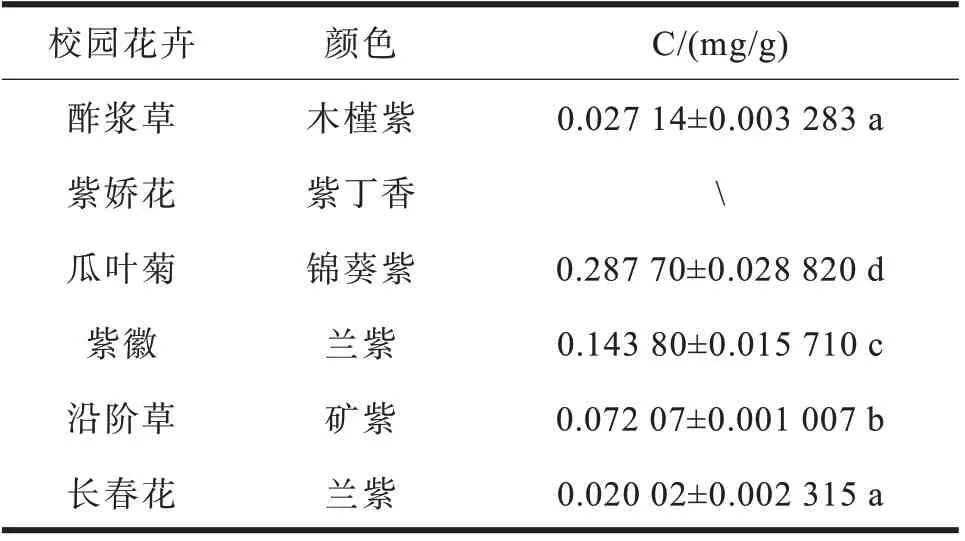
表1 不同种类校园常见花卉总花青素颜色与浓度Table 1 The color and concentration of total anthocyanins of different types of common campus flowers

图3 HPLC 测得不同种类观赏花卉的花青素组分及含量Fig.3 The anthocyanin components and contents of different kinds of ornamental flowers measured by HPLC
3 讨论与结论
花色是被子植物花器官非常重要的表型性状,是观赏花卉植物极其重要的观赏性状之一,在新品种选育、鉴定和保护过程中具有重要意义,而花青素、类胡萝卜素等色素及其他相关物理化学因素决定花色的形成[13-14]。花青素的分类主要根据羟基和甲氧基取代基的数目和位置,目前被报道的天然花青素已经有20 多种,其中最常见的有6 种:飞燕草色素(delphinidin)显蓝紫色、矢车菊色素(cyanidin)显艳红色、天竺葵色素(pelargonidin)显深红色、矮牵牛素(petunidin)显紫色、芍药色素(peonidin)显橘红色和锦葵素(malvidin)显淡紫色[15-18]。结合本研究选取材料来看所检测出单体物质与报道的花青素单体常见颜色来看,基本符合实际花色,即都为紫色花;而对于只检测出矢车菊素的紫娇花来说,本应表现为鲜艳红色,但可能由于其内含有辅助色素,如:黄酮、糖、有机酸等一系列次生代谢物导致花色苷吸收波长较长进而导致其颜色呈现出淡紫色[19]。
紫叶酢浆草色素属花青素类色素,pH 值对色素影响明显,在酸性条件下色泽稳定且具有热稳定性;光照能加快色素降解;金属离子Na+、Ca2+、A13+、Cu2+、Zn2+对色素色泽无影响,而Fe3+、Pb2+有不良影响[20]。pH 对红花酢浆草色素的稳定性影响较大,在pH2~3 时呈稳定的红色,pH 增大时颜色变紫变黑。红花酢浆草色素在暗处稳定性最高,自然光下次之,日光灯下低。红花酢浆草色素在50 ℃以下热稳定性较好,50 ℃以上热稳定性降低[21]。蔗糖、氯化钠、苹果酸、柠檬酸和乳酸对红花酢浆草色素均有明显的增色、护色作用,可明显改善或提高其稳定性。
本研究发现,在花青素测定分析过程中,总花青素含量除紫娇花以外其余都检测到,但利用HPLC检测时,发现紫娇花却出现矢车菊素吸收峰,表明紫娇花含有该物质,该特殊现象的出现,推测可能由于测定总花青素采用pH 示差法,即利用1.3.2 描述方法计算出花青素总量,由于花青素的结构存在不完全转化造成实际测得的浓度要低于花青素的理论浓度,且不能测定单体造成的[22]。而对于总花青素含量最低的长春花来说,HPLC 并未检测出六种常见花青素单体,但检测出一个未知组分对于此结果,可能存在两种原因。第一,本次测定的六种单体的含量在长春花中未到达高效液相色谱的检出限,即可能由于浓度太低未检出。另外可能是因为其含有除测定六种以外花青素单体,具体原因有待后续研究。
对于分光光度计法测定总花青素的含量与HPLC测定单体含量在数据上存在冲突的问题而言,在使用分光光度和高相液相色谱法测定花青素的相关研究中也存在同样的问题。纪鹏飞等人[11]利用分光光度计法测定葡萄酒中花青素,尽管其在分光光度计法上做了相关优化,但总体来看分光光度计所测得的花青素含量要低于高效液相色谱法。所以本研究认为,由于分光光度计法的局限性,其在一定程度上测定的总花青素含量仅仅只能作为所测植株是否具有该类物质的一个粗略判断依据,其测定的值并不能真实反应该类物质的真实含量。本文采集了云南农业大学校园中酢浆草、紫娇花、瓜叶菊、紫薇、沿阶草和长春花,测定并分析了相应花青素含量及组分。由于分光光度计法在测定花青素组份及含量上的局限性,研究在分光光度计法的基础上,采用高效液相色谱法与其相互印证,提高了花青素检测的稳定性和准确性。在对不同观赏花卉花青素组分及含量进行测定分析后发现,不同观赏花卉的花青素种类与该物种观赏花卉的花色相符,表明在观赏花卉中其花青素的种类与含量对该种植物的花色具有重要影响。旨在为以后校园观赏植物花色研究,及相关色素的研究提供相应参考。
