金钗石斛与绿茶复方对小鼠免疫力的影响
2021-07-02周霞张尧张焕新孙燕胡锦鸿
周霞,张尧,张焕新,孙燕,胡锦鸿
(江苏农牧科技职业学院 园林园艺学院,江苏 泰州 225300)
免疫力是指人体免疫系统抵御病原体感染的能力。正常人体的免疫力大小保持一定的平衡,太强或太弱都会危害人体的健康。目前,据世界卫生组织公布的调查结果显示:世界亚健康人口的比例已达到75%,亚健康的人表现为失眠、多梦、不易入睡或白天打瞌睡等症状,而亚健康与人体的免疫力低下有关。因此,增强免疫力对维持人体健康具有重要意义。近来研究表明天然植物多糖、多酚和皂苷等都较理想的免疫增强剂[1-3]。
金钗石斛(Dendrobium nobileLindl)又称金钗石、扁金钗、扁黄草、扁草,为兰科(Orchidaceae)石斛属(DendrobiumSw.)多年生附生草本植物,为名贵的中药材,享有“仙草之美誉”[4]。多糖和生物碱是金钗石斛中主要的化学活性物质[5,6]。研究表明金钗石斛多糖具有较强的免疫增强活性[7]。茶(Camellia sinensis)为山茶科山茶属植物(Camellia sinensis(L.) O.Kuntze)的叶芽。其主要化学成分是儿茶素类(属于多酚),现代药理研究表明茶多酚具有免疫调节功能[8,9]。由于金钗石斛具有滋阴降火、提高免疫力、补益脾胃、降低血糖等功效,适用于免疫力低下人群的配方原料[10];而绿茶中的茶多酚能够促白细胞介素的合成,激活巨噬细胞(mφ)和T、B 淋巴细胞,提高机体免疫球蛋白的水平,茶多酚可以通过多作用位点来调节机体免疫力[11-13]。我们前期研究发现金钗石斛与绿茶组合物能够提高免疫力,但其作用机理尚不清楚[14]。因此本研究以小鼠为实验动物,将二者提取物联合使用,研究对机体免疫力相关指标的影响。
1 材料与方法
1.1 材料
金钗石斛提取物(规格3∶1,石斛碱>1.0%)由赣州华汉生物科技有限公司提供;绿茶提取物(茶多酚>30%)由遵义陆圣康源有限公司提供;琼脂糖、KH2PO4、Na2HPO4·12H2O、2-巯基乙醇、硫化钡等购于百灵威科技有限公司;刀豆蛋白A(ConA)购于西格玛奥德里奇(上海)贸易有限公司;绵羊红细胞(SRBC)、Hank’s 液、牛血清、牛血清白蛋白(BSA)和MTT 等购于上海源叶生物科技有限公司;青霉素-链霉素混合溶液购于上海远慕生物科技有限公司;RPMI1640 培养基购于青岛捷世康生物科技有限公司;XTT试剂盒购于武汉艾美捷科技有限公司;LDH试剂盒购于武汉默沙克生物科技有限公司;YAC-1细胞购于中科院上海细胞库;HCl、NaOH、异丙醇和甲醇等均为分析纯,由国药集团上海化学试剂公司提供。
1.2 方法
1.2.1 实验动物
雄性SPF级C57BL/6J小鼠,8周龄,由上海斯莱克实验动物有限公司提供,生产许可证号为SCXK(沪)2013-0018,体重为18~22 g。饲养环境条件为室温20~26 ℃、相对湿度40~70%、光照-黑暗周期12 h。
1.2.2 淋巴细胞体外增殖实验(XTT 法)
取脾脏组织前配置好完全培养基:RPMI1640 培养液中添加10%小牛血清、1%谷氨酰胺(200 mmol/L)、1%的青霉素(100 U/mL) -链霉素(100 μ/L) 及5×10-5mol/L 的2-巯基乙醇,调pH 至7.0-7.2。
脱颈椎处死小鼠,无菌取脾脏,将脾磨碎后,用全自动细胞计数仪计数活细胞,调整浓度为2×107个/mL,取100 μL 加入96 孔板;用完全培养基分别配制不同浓度的金钗石斛提取物和绿茶提取物复方样液,过无菌滤膜,每孔加入100 μL,对照组加100 μL 完全培养基,每个样做6 个平行,其中3 个加入7.5 μL ConA 液,最后加入完全培养基使体积至200 μL,使样品质量浓度分别为2 mg/mL、4 mg/mL和8 mg/mL。在CO2培养箱中培养72 h,结束前4 h加入XTT,用酶标仪测定450 nm 处的光密度。计算不加ConA 的孔和加入ConA 的孔的差值,以差值大小表征淋巴细胞的体外增殖能力。
1.2.3 实验动物处理
设低(0.16 g/kg BW)、中(0.32 g/kg BW)、高(1.0g/kgBW)三个剂量金钗石斛与绿茶复方实验组。其中金钗石斛提取物的量分别为0.12、0.24、0.75 g/kg BW,绿茶提取物的量分别为0.04、0.08、0.25 g/kg BW,取30 g金钗石斛提取物和10 g绿茶提取物混合均匀,分别取混合物2.4,4.8和15.0 g加去离子水200 mL,小鼠灌胃体积为10 mL/kg BW。通过灌胃对实验组动物进行给药,体积为0.1 mL/10 g BW,对照组给予等体积的溶剂(生理盐水),每日一次,持续30 d。
1.2.4 ConA 诱导小鼠淋巴细胞转化实验(MTT 法)
实验动物处理结束后,在无菌条件下取出脾脏置于无菌Hank’s液的培养皿中,用镊子轻轻将脾脏撕碎,制成单细胞悬液,过200目滤网,洗涤,计数后,用RPMI 1640培养液将细胞密度调整至3×106个/mL。分两孔将细胞悬液加入到24孔培养板中,每孔1 mL,其中一孔加入75 μL ConA 液(即7.5 μg/mL),另一孔设为对照,置于37 ℃、5%CO2培养箱中培养72 h,培养结束前,轻轻吸去每孔中的0.7 mL 上清液,再向其中加入不含小牛血清的RPMI 1640 培养液和50 μL MTT(5 mg/mL),继续培养4 h。培养结束后,再向每孔中加入1 mL 酸性异丙醇,用移液枪吹打均匀,使其中的紫色结晶物质完全溶解。在570 nm 波长处测定吸光度值(OD)。最后用加ConA 孔的吸光度值减去不加ConA 孔的吸光度值表示淋巴细胞的增殖能力。
1.2.5 抗体生成细胞检测
在处理结束前第5 天,给小鼠腹腔注射0.2 mL 2%(v/v)的压积羊红细胞(SRBC)悬液,刺激免疫,5 天后,在无菌条件下取出脾脏,制成单细胞悬液,用RPMI 1640培养液将细胞浓度调整为5×106个/mL,将表层培养基(1 g 琼脂糖和100 mL 双蒸水)加热溶解后,置于45℃水浴锅中保温,加入2 倍浓度的等量Hank’s 液混合,分装于小试管中,每管0.5 mL,再向管内加入50 μL10% SRBC(v/v,SA 液配制)和20 μL 脾细胞悬液(5×106个/mL),迅速混匀,立即倒于含有薄层琼脂糖的玻片上,待琼脂糖凝固之后,将玻片平放在玻片架上,在CO2培养箱中保温培育1.5 h,然后将用生理盐水稀释的补体(1∶8)加入到玻片的凹槽内,继续保温培育1.5 h,对玻片溶血空斑数进行计数。
1.2.6 小鼠腹腔巨噬细胞吞噬鸡红细胞实验
在处理结束前第4 天,对每只小鼠腹腔注射0.2 mL 2%(v/v)的压积绵羊红细胞(SRBC)悬液,4 天后,对每只小鼠腹腔注射3 mL 含有小牛血清的Hank’s 液。颈椎脱臼法处死小鼠后,轻揉小鼠腹部20 次,以充分揉出小鼠腹腔中的巨噬细胞,然后在小鼠腹壁处剪开一个小口,用胶头滴管吸取2 mL 腹腔悬液于试管内。吸取0.5 mL 腹腔悬液,加入至含有0.5 mL 1%的鸡血红细胞悬液试管内,充分混匀。吸取0.5 mL 混合液,加入到玻片中的琼脂圈内。放置于培养箱内37 ℃培养15 min。培养结束后迅速用生理盐水将未贴壁细胞洗掉,将贴壁细胞置于甲醇中固定1 min,再用Giemsa 液染色15 min。蒸馏水洗净晾干后,显微镜检测,计数100 个巨噬细胞,计算鸡红细胞吞噬指数。
1.2.7 自然杀伤细胞(NK)细胞活性测定
处理结束后,取脾脏制成单细胞悬液,用RPMI 1640 培养液将细胞调整浓度为2×107个/mL,此为效应细胞。实验前24 h 传代培养YAC-1 细胞,使用前用Hank's 液洗涤3 次,用RPMI 1640 完全培养液将细胞浓度调整为4×105个/mL,此为靶细胞。取效应细胞和靶细胞各100 μL (效比1∶50),加入至U 型96孔培养板中;靶细胞自然释放孔中加靶细胞和培养液各100 μL,靶细胞最大释放孔中加细胞和1%NP40各100 μL;上述各项均设定三个平行对照,在37 ℃,5%CO2培养箱培养4 h 后将96 孔培养板于1 500 r/min下离心5 min,每孔吸取100 μL 上清液置平底96 孔培养板中,并加入100 μL LDH 基质液,反应8 min后,每孔加入30 μL 1 mol/L 的HCl,于490 nm 处测定吸光度值(OD),计算NK 细胞活性。
1.2.8 脏器指数
各组实验动物处理结束后,颈脱臼法处死小鼠,取其胸腺及脾脏称重,计算胸腺和脾脏的脏器指数,即胸腺/体重和脾脏/体重的比值。
1.3 数据处理
采用SPSS 22.0 统计软件分析实验数据采用方差分析,P<0.05 代表组间差异具有显著性,P<0.01代表组间差异具有极显著性;实验重复三次。
2 结果与分析
2.1 金钗石斛与绿茶复方对体外小鼠淋巴细胞增殖能力的影响
金钗石斛与绿茶复方对体外小鼠淋巴细胞增殖能力的影响见表1。结果显示:在低浓度(2 mg/mL)时金钗石斛与绿茶复方对淋巴细胞的增殖能力无显著增强;金钗石斛与绿茶复方(3∶1),中浓度(4 mg/mL)和高浓度(8 mg/mL)时均能显著增强淋巴细胞增殖能力。因此,后续选择比例为3∶1 的复合物进行后续实验。
表1 金钗石斛与绿茶复方对体外小鼠淋巴细胞增殖的影响(±s)Table 1 The effect of complexes of Dendrobium nobile and green tea on proliferation of mouse lymphocyte in vitro
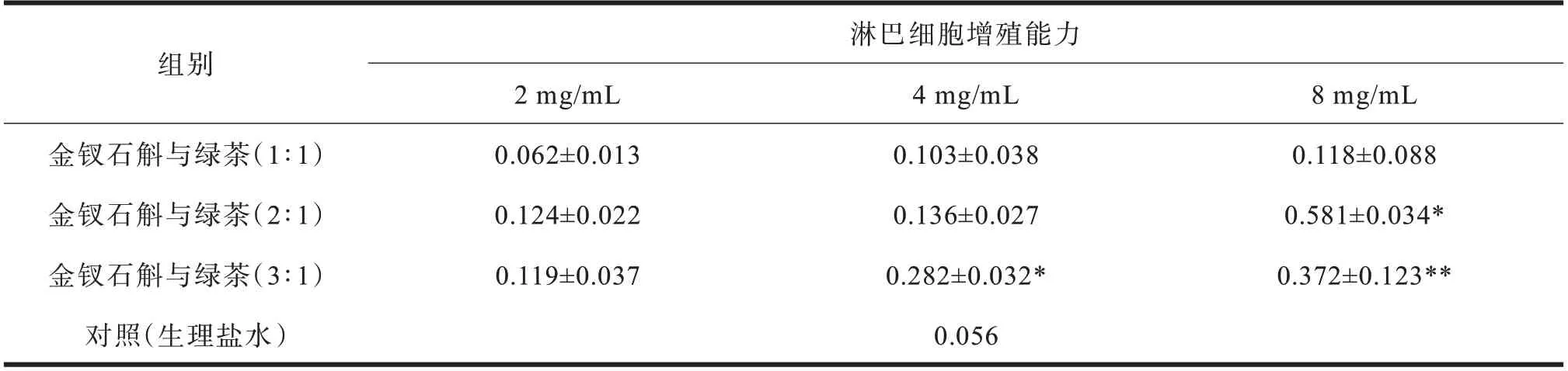
表1 金钗石斛与绿茶复方对体外小鼠淋巴细胞增殖的影响(±s)Table 1 The effect of complexes of Dendrobium nobile and green tea on proliferation of mouse lymphocyte in vitro
注:括号中的比例为两种提取物的比值;与对照组比较,*P<0.05,**P<0.01(下同)。
组别金钗石斛与绿茶(1∶1)金钗石斛与绿茶(2∶1)金钗石斛与绿茶(3∶1)对照(生理盐水)淋巴细胞增殖能力2 mg/mL 0.062±0.013 0.124±0.022 0.119±0.037 0.056 4 mg/mL 0.103±0.038 0.136±0.027 0.282±0.032*8 mg/mL 0.118±0.088 0.581±0.034*0.372±0.123**
2.2 金钗石斛与绿茶复方对小鼠T 淋巴细胞增殖能力的影响
T 细胞为重要的免疫细胞,主要介导细胞免疫。T 细胞受ConA 刺激后母细胞会发生增殖反应[15,16]。金钗石斛与绿茶复方对小鼠T 淋巴细胞增殖能力的影响见表2,在ConA 的诱导下,小鼠T 淋巴细胞增殖能力随复方剂量的增加而增大,与阴性对照组相比,低剂量组无显著性增加(P>0.05),而中、高剂量组其显著性增加(P<0.01)。结果说明金钗石斛与绿茶复方可显著增强小鼠的细胞免疫功能,这与Wong 等的研究一致[17];且本复方中、高剂量对淋巴细胞的增殖率要高于金钗石斛单独使用(低剂量28.57%,高剂量80.00%)的效果[18],说明茶叶提取物的加入可以协同增强金钗石斛对小鼠T 淋巴细胞免疫力。
表2 金钗石斛与绿茶复方对小鼠淋巴细胞增殖能力的影响(±s)Table 2 The effect of complexes of Dendrobium nobile and green tea on proliferation of ConA-induced lymphocyte in mice

表2 金钗石斛与绿茶复方对小鼠淋巴细胞增殖能力的影响(±s)Table 2 The effect of complexes of Dendrobium nobile and green tea on proliferation of ConA-induced lymphocyte in mice
组别阴性对照低剂量中剂量高剂量动物数/n 10 10 10 10光密度差值0.142 0.153 0.269**0.476**增值率/%-5.63 89.43 235.21
2.3 金钗石斛与绿茶复方对小鼠抗体生成细胞的影响
抗体生成细胞由B淋巴细胞分化产生,能产生各种免疫球蛋白,介导体液免疫[19]。金钗石斛与绿茶复方对小鼠抗体生成细胞的影响见表3。与阴性对照组相比,低剂量组溶血空斑的增加不显著(P>0.05),而中、高剂量组溶血空斑数显著增加(P<0.01)。结果说明金钗石斛与绿茶复方能显著增强小鼠的体液免疫功能,体液免疫功能的增强与免疫球蛋白水平的增加密切相关[20]。茶多酚可以提高人体血清免疫球蛋白IgG、IgM、IgA含量而增进人体的免疫力[13],提示绿茶提取物可能具有重要作用。
表3 金钗石斛与绿茶复方对小鼠抗体生成细胞的影响(±s)Table 3 The effect of complexes of Dendrobium nobile and green tea on antibody producing cells in mice
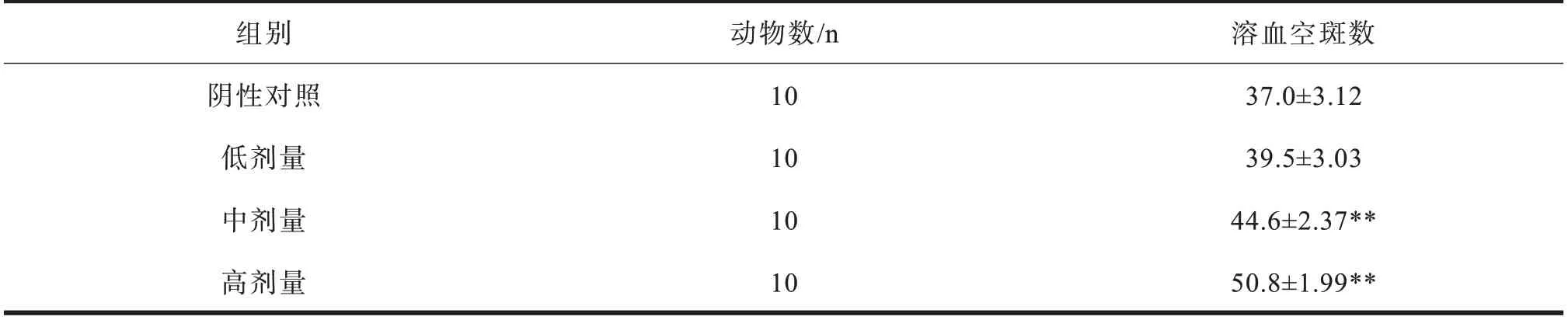
表3 金钗石斛与绿茶复方对小鼠抗体生成细胞的影响(±s)Table 3 The effect of complexes of Dendrobium nobile and green tea on antibody producing cells in mice
组别阴性对照低剂量中剂量高剂量动物数/n 10 10 10 10溶血空斑数37.0±3.12 39.5±3.03 44.6±2.37**50.8±1.99**
2.4 金钗石斛与绿茶复方对小鼠腹腔单核/巨噬细胞吞噬能力的影响
金钗石斛与绿茶复方对小鼠腹腔巨噬胞吞噬鸡红细胞的影响见表4。与阴性对照组比较,中、高剂量组小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬指数分别为(P<0.05<0.01)和吞噬指率(P<0.01)均显著升高。单核/巨噬细胞是机体固有免疫系统中重要的细胞组分,包括血液中的单核细胞和组织中固定或游走的巨噬细胞,巨噬细胞由单核细胞发育而成,通过病原体分子模式行使吞噬功能和开启炎症反应[21]。吞噬指数/吞噬率升高表示巨噬细胞对异己成分吞噬能力增强,这说明金钗石斛与绿茶复方可以增强小鼠的巨噬细胞吞噬功能,这与Monobe 等人的研究结果一致[22]。文献报道金钗石斛对小鼠巨噬细胞吞噬能力影响较小[15],这意味着复方茶多酚对巨噬细胞吞噬能力起主要作用。
表4 金钗石斛与绿茶复方对小鼠巨细胞吞噬鸡红细的影响(±s)Table 4 The effect of complexes of Dendrobium nobile and green tea on macrophage phagocytizing chicken red blood cell in mice

表4 金钗石斛与绿茶复方对小鼠巨细胞吞噬鸡红细的影响(±s)Table 4 The effect of complexes of Dendrobium nobile and green tea on macrophage phagocytizing chicken red blood cell in mice
与阴性对照组比较,*表示P<0.05,**表示P<0.01。
组别阴性对照低剂量中剂量高剂量动物数/n 10 10 10 10吞噬指数24.1±0.65 25.2±2.10 28.7±0.89**31.1±0.97**吞噬率0.32±0.042 0.30±0.028 0.38±0.063*0.44±0.059**
2.5 金钗石斛与绿茶复方对小鼠K 细胞活性的影响
NK 细胞即天然杀伤细胞,因其无需抗原预先致敏就能破坏靶细胞(如病毒感染的细胞、某些肿瘤细胞核和受损伤的细胞)而得名。NK 细胞是参与固有免疫的重要成员,特别是参与早期防御[23]。金钗石斛与绿茶复方对小鼠K 细胞活性的影响见表5。各剂量组小鼠NK 细胞活性与阴性对照组比较,差异均无显著性意义(P>0.05)。说明金钗石斛与绿茶复方不能增强小鼠的NK 细胞活性。然而,有研究报道发现绿茶提取物可增强NK 细胞功能[24],本研究中金钗石斛与绿茶复方中的不同成分可能存在相互作用,需进一步研究。
表5 金钗石斛与绿茶复方对小鼠NK 细胞活性的影响(±s)Table 5 The effect of complexes of Dendrobium nobile and green tea on NK cell activity in mice

表5 金钗石斛与绿茶复方对小鼠NK 细胞活性的影响(±s)Table 5 The effect of complexes of Dendrobium nobile and green tea on NK cell activity in mice
组别阴性对照低剂量中剂量高剂量动物数/n 10 10 10 10吞噬指数46.6±2.1 48.2±2.1 47.6±1.8 49.7±5.7
2.6 金钗石斛与绿茶复方对小鼠体重及脏器的影响
金钗石斛与绿茶复方对小鼠体重以及脾脏和胸腺指数影响的实验结果见表6。A 组为ConA 诱导的小鼠牌淋巴细胞转化实验小鼠体重增长率,B 组为抗体生成细胞数实验小鼠体重增长率,C 组为小鼠腹腔巨细胞吞噬能力实验小鼠体重增长率,D 组为NK 活性测定实验小鼠体重增长率。三个剂量组小鼠体重以及脾脏和胸腺指数在实验期间分别与阴性对照组比较,差异均无显著性意义(P>0.05)。说明受试物不会影响正常小鼠的体重及脏器。
表6 金钗石斛与绿茶复方对小鼠体重增长率及脾脏、胸腺指数的影响(±s)Table 6 The effect of complexes of Dendrobium nobile and green tea on the body weight of mice
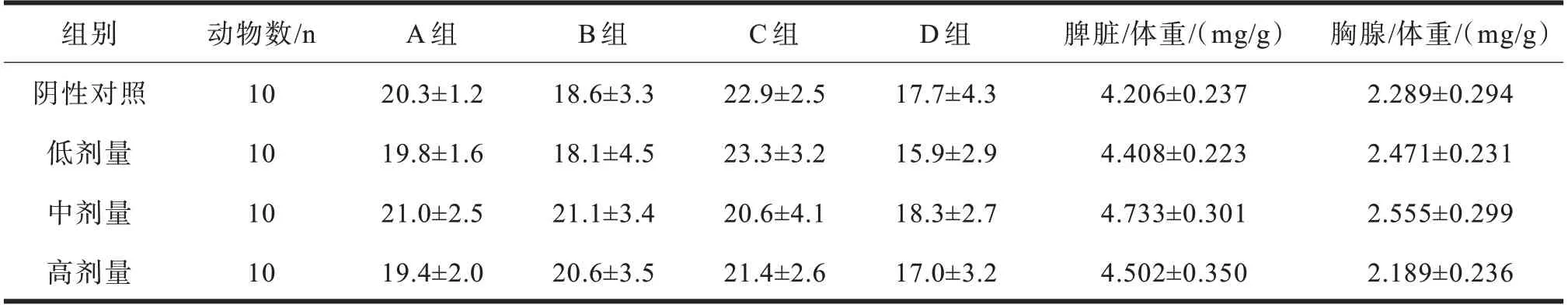
表6 金钗石斛与绿茶复方对小鼠体重增长率及脾脏、胸腺指数的影响(±s)Table 6 The effect of complexes of Dendrobium nobile and green tea on the body weight of mice
组别阴性对照低剂量中剂量高剂量动物数/n 10 10 10 10 A 组20.3±1.2 19.8±1.6 21.0±2.5 19.4±2.0 B 组18.6±3.3 18.1±4.5 21.1±3.4 20.6±3.5 C 组22.9±2.5 23.3±3.2 20.6±4.1 21.4±2.6 D 组17.7±4.3 15.9±2.9 18.3±2.7 17.0±3.2脾脏/体重/(mg/g)4.206±0.237 4.408±0.223 4.733±0.301 4.502±0.350胸腺/体重/(mg/g)2.289±0.294 2.471±0.231 2.555±0.299 2.189±0.236
3 讨论
免疫是机体对抗原性异物的识别和清除。巨噬细胞(mφ)吞噬作用、淋巴细胞的增值是机体免疫力高低的重要指标[26]。mφ表达多种模式识别受体(PRR)与病原体有关的分子模式(PAMP)(高度保守的分子结构包括脂多糖(LPS)、脂磷壁酸(LTA)、肽聚糖(PGN)、甘露糖、葡聚糖、细菌DNA、双链RNA等)相结合,病原体被摄入细胞内形成吞噬体,随机在多种溶酶体酶的作用下,实施对病原体的杀伤和分解。同时,mφ借助PRR 识别病原体后,同时被激活,进一步产生和分泌多种趋化因子、细胞因子和化学介质,包括MIP-1α/β、MCP-1 和IL-8 等。此外,mφ是机体内重要的专职抗原提呈细胞,因着对胞外病原体的吞噬和加工,相应蛋白质抗原与MHC II类分子形成抗原肽-MHC 复合物(pMHC),并被提呈细胞表面为CD4T 细胞活化提供第一信号。同时,mφ还表达共刺激分子,与T细胞上的配体结合,提供活化第二信号,启动T 细胞介导的适应性免疫应答[26]。
许多天然产物具有免疫调节的功能,因其在体内代谢快,高效低毒,兼有药物与营养双重功能越来越引起研究者的关注。本实验以金钗石斛提取物和绿茶提取物组成的复方,研究了其对小鼠免疫功能的影响。结果显示该复方可以协同刺激T、B 淋巴细胞产生免疫应答,同时,对腹腔巨噬细胞的吞噬能力也有明显提高;这种免疫作用随剂量的增加而增强,表明该复方具有增强免疫力功能。
