铁 酸 钠 的 制 备 及 应 用
2021-07-02王亚磊李来时吴玉胜吴修世
王亚磊,李来时,吴玉胜,吴修世
(1.沈阳工业大学 材料科学与工程学院,辽宁 沈阳 110870;2.国网营口供电公司, 辽宁 营口 115000)
赤泥是氧化铝生产过程中产生的强碱性废弃物,氧化铝产业作为我国的重要发展产业,赤泥也就成为了我国排放量最大的工业固体废弃物中的之一[1-3]。
据统计,2020年我国氧化铝的产量高达7313万吨,赤泥的排放量大约为1.2亿吨,累计赤泥堆积量已达几亿吨,带来严重的安全隐患[4-5]。
全世界95%以上的氧化铝都是通过拜耳法从铝土矿中提取出来的,其余的氧化铝是通过烧结法、联合法或酸法生产的[6-7]。拜耳法赤泥的主要成分是氧化铝、氧化钠和氧化铁,回收赤泥中的铝和碱是赤泥无害化利用的一个重要研究方向[8-9]。从赤泥中回收氧化铝和碱主要是破坏水化铝硅酸钠或霞石的结构,生成新的物相[10]。
李新华[11]和J.Zoldi[12]研究了铝土矿溶出过程中硅酸盐水石榴石的生成。由于在铝土矿溶出过程中加入了预先制备的铁酸钙或水化铁酸钙,铝土矿中的一些硅矿物可以转变为铁水化石榴石(3CaO·Fe2O3·nSiO2·(6-2n)H2O),成为赤泥的主要成分,从而降低铝土矿的A/S和N/S。由于铁酸钙的制备和应用非常复杂,铁酸钙的制备需要较高的温度,因此本文使用铁酸钠做添加剂提取赤泥中的铝和碱。
本文对“高压水化学法回收赤泥中氧化铝和碱”[13]工艺中添加剂-铁酸钠的最佳烧结条件进行了研究,旨在制备纯度较高的铁酸钠用于处理拜耳法赤泥。
1 实 验
1.1 实验材料
实验所用原料为山东某公司的拜耳法赤泥,物料粉碎和充分混匀,经烘干箱烘干后,取样用于原料的化学成分分析,剩余原料密封后放入干燥瓶中保存。实验所用氧化铁、无水碳酸钠及分析药品均为分析纯,所用实验用水为去离子水。原料的主要化学组成如表1所示。

表1 赤泥主要化学成分(wt.%)
该赤泥中主要物相分析结果如图 1 所示。
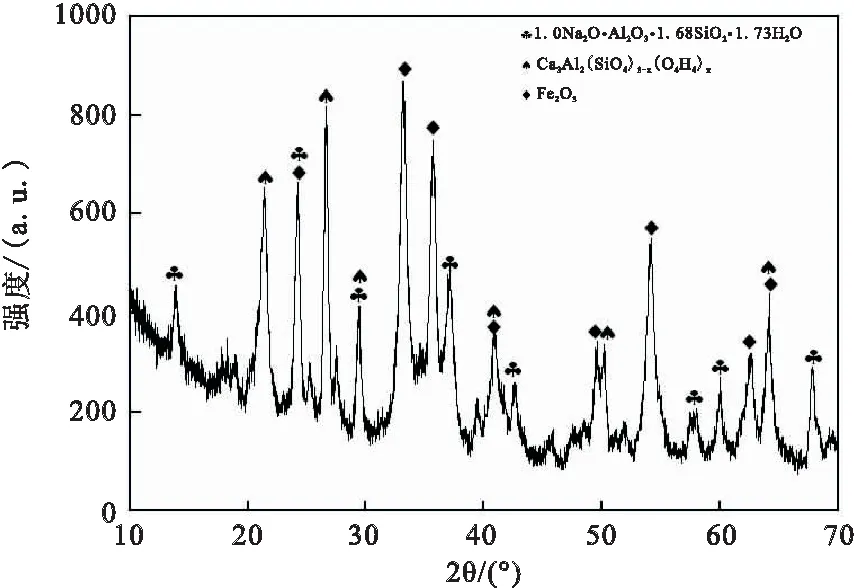
图1 赤泥的XRD分析
从图中可以看到,该赤泥主要物相是方钠石、水化石榴石及赤铁矿。
1.2 主要实验及分析设备
铁酸钠制备采用高温箱式电阻炉(KSL-1400L-A2 合肥科晶材料技术有限公司),溶出及高压水化实验采用盐浴溶出炉(YYL-150X6 威海鼎达化工机械有限公司),物相分析采用X射线衍射仪(XRD-7000日本岛津公司),微观形貌分析采用场发射扫描电子显微镜(GeminiSEM300德国蔡司公司)。
1.3 实验方法
铁酸钠制备:称取不同物料比的碳酸钠和三氧化二铁置球磨机中均匀混合1 h,然后利用空气压缩机制成小圆饼在不同烧结温度和烧结时间下烧结,所得样品经研磨后,密封保存。利用K值定量法测量其他条件制得的铁酸钠相对百分含量。
铁酸钠应用:采用高压水化法回收赤泥中的氧化铝和碱,将赤泥与高分子比循环碱液混合,加入石灰和铁酸钠放在盐浴炉中在280 ℃下溶出,而后经过洗涤、过滤,液相进行滴定分析,浸出渣进行固相分析。
2 结果与讨论
2.1 铁酸钠相对百分含量测定
实验采用K值法定量,样品经研磨后,测量其XRD,并以烧结温度1000 ℃,物料比为1.2,烧结时间120 min的铁酸钠为基准,假定其纯度为100%,以α-Al2O3为内标相,称量1 g 铁酸钠(烧结温度1000 ℃,物料比为1.2,烧结时间120 min)和1 g α-Al2O3粉末,放进研钵里均匀混合,测量混合物中铁酸钠和α-Al2O3最强峰的强度,如图2所示。

图2 NaFeO2∶α-Al2O3=1∶1的XRD分析
由图可得到K=INaFeO2/Iα-Al2O3=1.93。
再称量2 g 其他条件下的铁酸钠和1 g α-Al2O3粉末经研钵均匀混合后,α-Al2O3质量分数为wt%=1/(1+2)=33.33% 测得新混合物中铁酸钠和α-Al2O3最强峰的强度分别为IN和IA。根据IN/IA=K·ωN/ωA,可以解出铁酸钠在混合物中的含量,进而折算出铁酸钠在原混合物中的含量。
2.2 烧结温度对铁酸钠相对百分含量的影响
称取碳酸钠和三氧化二铁物料比为1.2的样品,在混料机中均匀混合1 h,制成圆饼装入刚玉坩埚里,将其放置于马弗炉中,在温度为800 ℃,850 ℃,900 ℃,950 ℃,1000 ℃下烧结120 min,通过K值法计算铁酸钠相对百分含量,结果如图3所示。

图3 不同烧结温度下铁酸钠的相对百分含量
由图3可知,随着烧结温度的提高,铁酸钠相对百分含量逐渐上升,在1000 ℃时达到最大。由于在烧结温度为1050 ℃时,烧成了玻璃相,此条件不作为实验数据,最终选择烧结温度为1000 ℃。
2.3 烧结时间对铁酸钠相对百分含量的影响
在温度为1000 ℃,碳酸钠和三氧化二铁物料比为1.2的条件下,分别选取6个保温时间:10 min,20 min,40 min,60 min,90 min,120 min,结果如图4所示。

图4 不同烧结时间下铁酸钠的相对百分含量
由图4可知,随着保温时间的增大,铁酸钠相对百分含量逐渐上升,直至60 min时达到最大,最终选择烧结时间为60 min。
2.4 物料配比对铁酸钠相对百分含量的影响
在烧结温度为1000 ℃,烧结时间为60 min时,又选取了5个物料配比,[Na2CO3∶Fe2O3] (碳酸钠和氧化铁的摩尔比)=1.0,1.1,1.2,1.3,1.4,结果如图5所示。
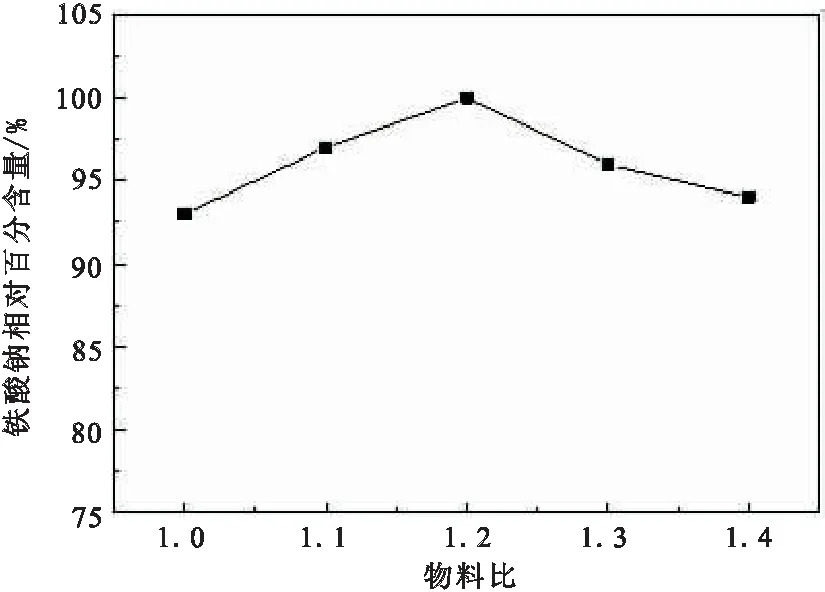
图5 不同物料比下铁酸钠的相对百分含量
由图5可知,随着物料比的增大,碳酸钠含量逐渐增多,未反应完全的碳酸钠在高温下生成氧化钠,所以铁酸钠相对百分含量先上升后下降,直至物料比为1.2时达到最大。实验最终选择烧结温度1000 ℃,烧结时间为60 min,物料配比为1.2作为铁酸钠生成最优条件。
2.5 铁酸钠在提取赤泥中氧化铝和碱中的应用
在温度为280 ℃,保温时间3 h,αK(氧化钠和氧化铝的分子比)=12,氧化钠浓度为220 g/L,C/S(氧化钙和二氧化硅的摩尔比)=2,铁酸钠添加量为总质量20%的条件下,对赤泥进行浸出并对浸出渣进行XRD,XRF及电镜物相分析。
由表2可知,浸出渣的A/S和N/S由0.82和0.32分别下降到0.21和0.03,铝和碱的提取率达到了74%和91%。

表2 浸出渣主要化学成分(wt.%)
图6显示了浸出渣的XRD图谱。由图可知反应生成了水石榴石相Ca3(Fe0.87Al0.13)2(SiO4)1.65(OH)5.4和Ca3AlFe(SiO4)(OH)8。这是由于在高分子比碱液中,钙元素进入方钠石中,取代钠元素形成钙铝榴石,铝被铁取代,最终形成铁水化石榴石,从而使赤泥中的A/S和N/S降低[14-15]。

图6 浸出渣的XRD分析
图7为浸出渣的扫描电镜图谱。由图7(a,b)可知,赤泥经过水热反应后,宏观为球状颗粒,粒径为300~500 nm,,颗粒表面致密光滑,分布均匀,结合图6可知颗粒为水化形成的铁水化石榴石。
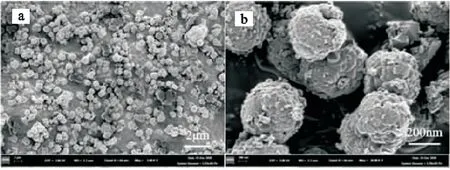
图7 浸出渣的扫描电镜分析
3 结 论
(1)铁酸钠制备最佳条件为[Na2CO3∶Fe2O3] 1.2,烧结温度1000 ℃,保温时间60 min,此条件下制备的铁酸钠的相对百分含量为100%。
(2)添加铁酸钠进行回收赤泥中氧化铝和碱实验,在温度为280 ℃,保温时间3 h,α=12,氧化钠浓度为220 g/L,C/S=2,铁酸钠添加量为总质量20%的条件下,赤泥中氧化铝和碱回收率分别为74%和91%,处理后的赤泥A/S为0.21、N/S为0.03。
(3)赤泥中的方钠石通过水化反应转变成铁水化石榴石。
