基于网络药理学的雷公藤治疗干燥综合征作用机制研究
2021-07-01杨少宁孙倩李姗姗于小勇
杨少宁 孙倩 李姗姗 于小勇

摘要 目的:基于网络药理学探讨雷公藤与干燥综合征的关联关系及潜在作用机制。方法:通过检索TCMSP数据库,结合口服生物利用度和类药性分析,筛选出雷公藤中的主要活性成分及作用靶点;检索GEO数据库筛选干燥综合征的预测靶点,并将有效化合物和疾病靶点进行映射;采用Cytoscape软件构建雷公藤化合物-干燥综合征靶点相互作用网络;通过Bisogenet包进行蛋白质-蛋白质相互作用(PPI)网络的构建;再使用Bioconductor平台和R软件进行GO功能富集分析和KEGG通路富集分析。结果:筛选得到雷公藤有效成分共22个,作用靶点413个,从GEO数据库确定干燥综合征差异基因466个;有效化合物-干燥综合征网络总共包括28个节点和41条相互作用关系,关键活性化合物有山柰酚、川陈皮素、β-谷甾醇、雷公藤内酯醇、浙贝素等;通过蛋白质-蛋白质相互作用(PPI)网络得到11个核心蛋白;GO富集分析主要涉及共获得生物过程(BP)295个,细胞组成(CC)3个,分子功能(MF)46个;相关条目主要涉及花生四烯酸代谢、类二十烷酸、脂肪酸、前列腺素等生物的合成与代谢过程、氧化应激以及多种酶的活性等;KEGG通路富集筛选得到19条信号通路,主要包括为花生四烯酸代谢、血清素能突触、TNF信号通路、多种细胞凋亡、VEGF信号通路、IL-17信号通路、核因子-κB信号通路等。结论:本研究应用网络药理学方法,对雷公藤治疗干燥综合征的活性成分、作用靶点和信号通路进行了探索性研究,发现雷公藤中的山柰酚、川陈皮素、β-谷甾醇等活性成分可参与调节花生四烯酸、类二十烷酸、脂肪酸、前列腺素等生物的合成与代谢过程、氧化应激以及多种酶的活性,并通过血清素能突触、TNF信号通路、多种细胞凋亡通路、VEGF信号通路、IL-17信号通路、核因子-κB信号通路等信号通路进行综合靶向調控,从而发挥治疗作用。
关键词 雷公藤;干燥综合征;作用机制;靶点;网络药理学;有效成分;富集分析;信号通路
Mechanism Study of Tripterygium Wilfordii on Sjogren′s Syndrome Based on Network Pharmacology
YANG Shaoning1,SUN Qian1,LI Shanshan1,YU Xiaoyong2
(1 Shaanxi University of Traditional Chinese Medicine,Xianyang 712046,China; 2 Shaanxi Provincial Hospital of Traditional Chinese Medicine,Xi′an 710003,China)
Abstract Objective:To explore the association and potential mechanism of Tripterygium wilfordii and Sjogren′s syndrome based on network pharmacology.Methods:By searching the TCMSP database,combined with oral bioavailability and drug-like analysis,the main active ingredients and action targets in Tripterygium wilfordii were screened; the GEO database was searched to screen for predicted targets for Sjogren′s syndrome,and effective compounds were mapped to disease targets; Cytoscape software was used to construct the target interaction network of Tripterygium compound-Sjogren′s syndrome; PPI protein interaction network was constructed through Bisogenet package; Bioconductor platform and R software were used to perform GO function enrichment analysis and KEGG pathway enrichment analysis.Results:A total of 22 active ingredients of Tripterygium wilfordii were screened and 413 targets were identified.466 differential genes for Sjogren′s syndrome were identified from the GEO database; the effective compound-Sjogren′s syndrome network includes a total of 28 nodes and 41 interactions.The key active compounds are kaempferol,ligandrin,β-sitosterol,triptolide,and zhebein; 11 core proteins were obtained through the PPI network; GO enrichment analysis mainly involved a total of 295 biological processes (BP),3 cell compositions (CC),and 46 molecular functions (MF); relevant entries mainly involve arachidonic acid metabolism,eicosanoid acid,fatty acids,prostaglandins and other organisms,oxidative stress,and the activities of various enzymes,etc; KEGG pathway was enriched and screened to obtain 19 signaling pathways,including arachidonic acid metabolism,serotonergic synapses,TNF signaling pathway,a variety of apoptosis,VEGF signaling pathway,IL-17 signaling pathway,NF-κB signaling Pathways,etc.Conclusion:This study used the network pharmacology method to preliminarily analyze the multi-component,multi-target,and multi-path characteristics of Tripterygium wilfordii in treating Sjogren′s syndrome,providing a reference for the implementation of subsequent clinical and scientific research-related work.
Keywords Tripterygium wilfordii; Sjogren′s syndrome; Mechanism of action; Target; Network pharmacology; Effective constituents; Enrichment analysis; Signaling pathway
中图分类号:R285;R284文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.01.010
干燥综合征(Sjogren′s Syndrome,SS)是一种与外分泌腺有关的自身免疫性疾病,多见于绝经后的女性,其主要特点是唾液腺和(或)泪腺功能的缺失,导致口干和眼干的症状[1]。本病可单独发病,也可继发于类风湿性关节炎、系统性红斑狼疮等其他自身免疫性疾病,全身受累会导致包括肾脏和周围神经系统在内的多个器官和组织的病理变化[2-3]。西医治疗主要包括局部用药以保湿和减少炎性反应,系统治疗包括使用类固醇激素、免疫抑制剂和细胞毒药物等维持治疗[4]。长期使用此类药物不仅不良反应大,而且费用昂贵,因此,探索新的治疗方式具有实际意义。干燥综合征在中医上属于“燥证”范畴[5],阴虚致燥为其根本原因。雷公藤因其具有免疫调节等多种功效而被临床应用于干燥综合征的治疗,并取得了良好的效果[6-7],但其具体作用机制尚不清楚。
本研究通过TCMSP数据库、GEO数据库,挖掘雷公藤和SS相关基因,采用Cytoscape构建雷公藤治疗SS的特异性靶点网络,借助R语言分析相关基因,构建两者蛋白质-蛋白质相互作用(PPI)网络图,并进行GO功能富集分析和KEGG通路富集分析,旨在探讨雷公藤治疗SS的关键靶点及作用机制,为深入开展雷公藤的基础实验研究及临床合理应用提供参考。
1 材料与方法
1.1 雷公藤成分及作用靶点
使用中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com
/tcmsp.php)筛选雷公藤化学成分和相关靶点[8],该数据库中包含约500种《中华人民共和国药典》中收载的药物,提供了多种与ADME相关的重要特性,即吸收(Absorption)、分布(Distribution)、代谢(Metabolism)及排泄(Excretion)。本研究根据口服生物利用度(Oral Bioavailability,OB)>30%和类药性(Drug Likeness,DL)>0.18筛选出主要有效活性成分,并在该数据库中查询主要有效活性成分的相关靶点。
1.2 方法
1.2.1 SS疾病靶點预测
在GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中搜索“Sjogren′s Syndrome”,得到与SS相关的差异基因,作为疾病的候选靶点基因。获得芯片基因注释文件:GPL570,芯片数据原始文件:GSM2252121-GSM2252180。该数据的原始文件共60个样本,包含SS患者30例,健康志愿者30例,包括全血转录、血清蛋白质和外周免疫表型等多种生物信息。使用R语言对芯片原始数据进行分析,利用limma包分析芯片数据的差异基因[9],以P<0.05和差异倍数|logFC|>1的基因被认为具有显著差异表达的相关基因;运用plot包绘制芯片原始的差异基因火山图。
1.2.2 构建雷公藤化合物与SS靶点相互作用网络
将筛选得到的雷公藤化合物与SS靶点基因相映射,获得二者交集靶点基因,然后使用Cytoscape3.7.2软件进行“中药化合物-作用靶点”网络构建。其中用“节点”(Node)表示分子、靶蛋白,用“边”(Edge)表示成分与靶点之间的关系;然后采用network analyzer插件进行网络特征分析[10],根据等级值(Degree)较大的节点进行筛选,节点的度数与节点相连边的数量、度数越大,说明网络中该节点直接相关的节点数越多,表明该节点在网络中越重要,从而得到雷公藤中关键的成分和靶点。
1.2.3 蛋白质-蛋白质相互作用(PPI)网络的构建
使用Cytoscape3.7.2软件中Bisogenet包进行PPI(Protein-protein Interaction)蛋白互作网络的构建,选择数据库来源为DIP、BIOGRID、HPRD、INTACT、MINT、BIND,使用CytoNCA包进行网络拓扑分析[11],对网络中所有点的度中心性(Degree Centrality,DC)进行分析进行分析,根据Degree(度)的大小,选择具有数据支持的靶点为SS的关键靶标蛋白。
1.2.4 GO功能富集分析
采用R软件对雷公藤的成分作用靶点进行基因本体(Gene Ontology,GO)功能富集分析,获得分析中生物过程(Biological Process,BP)、细胞组成(Cellular Component,CC)、分子功能(Molecular Function,MF)富集分析结果,并将其结果绘制成柱状图进行可视化。
1.2.5 KEGG通路富集分析
使用R软件ggplot2包对PPI网络中的蛋白进行京都基因与基因组百科全书(KEGG)的通路富集分析,并绘制气泡图,信号通路的显著性用气泡的大小和颜色表示,气泡越大代表信号通路的基因数目越高,说明该通路的重要性越高。
2 结果
2.1 雷公藤有效成分和相关作用靶点筛选
通过TCMSP数据库,按照OB>30%和DL>0.18的筛选条件,检索到雷公藤有效成分共51个,相关作用靶点共1 055个。其中,有29个有效成分未找到与干燥综合征相关的对应靶点,其余22种有效成分共获得CKD潜在靶点413个。见表1。
2.2 SS靶点预测
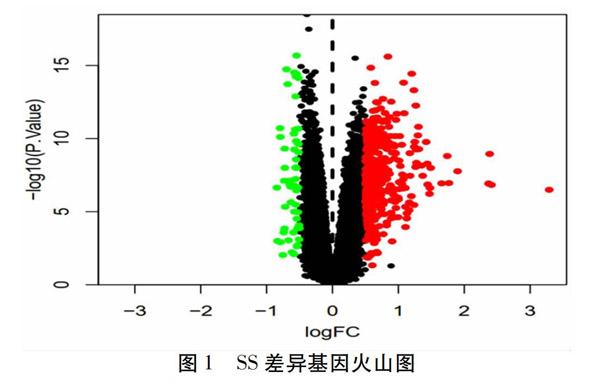
从GEO数据库中得到干燥综合征差异基因466个,其中56个下调基因和410个上调基因。通过R语言创建火山图来显示差异表达基因的分布,黑色代表没有差异表达的基因,绿色、红色代表差异基因。见图1。
2.3 雷公藤化合物与SS靶点相互作用网络
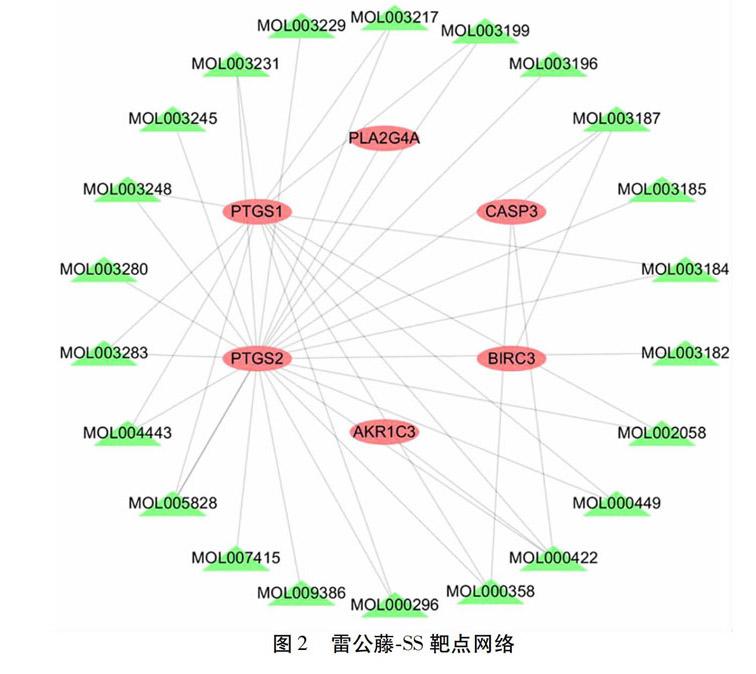
化合物与靶点网络总共包括28个节点(22種化合物节点、6个靶点节点)和41条边,平均节点2.929。见图2所示,通过分析这个网络图的拓扑性质及对中心度值、亲中心度值、等级值3个值进行分析,得到排名前5位的化合物分别是山柰酚(Kaempferol)、川陈皮素(Nobiletin)、β-谷甾醇(Beta-sitosterol)、雷公藤内酯醇(Triptolide)、浙贝素(Zhebeiresinol);根据等级值(Degree)大小,得到排名靠前的靶点分别是PTGS2、PTGS1、CASP3、PLA2G4A、AKR1C3、BIRC3。因此,它们可能是雷公藤治疗SS的关键活性化合物和靶点。见图2。
2.4 PPI网络的构建与分析结果
使用Cytoscape3.7.2软件中Bisogenet包进行PPI网络的构建,该网络总共包含317个节点和3 116条相互作用关系,见图3A,然后利用CytoNCA包对网络中所有节点的度中心性(Degree Centrality,DC)进行分析,按照DC>61作为筛选条件进行过滤,得到含有11个节点,28条相互作用关系的网络图,见图3B;最终确定了11个靶基因。分别是CASP3、TP53、UBC、BIRC3、CASP8、TRAF6、BIRC2、EGFR、CASP7、VCP、EP300,雷公藤的活性成分作用于多个靶点基因,且各个靶点之间相互协同作用。
2.5 GO功能富集分析结果
使用R软件进行GO功能富集分析,根据矫正后的P值(P-adjust<0.05)为筛选条件,共获得:生物过程(BP)295个,主要涉及花生四烯酸代谢过程、类二十烷酸生物合成过程、脂肪酸衍生物的生物合成过程、长链脂肪酸代谢过程、不饱和脂肪酸代谢过程、类二十烷酸代谢过程、前列腺素的生物合成过程、脂肪酸衍生物代谢过程、前列腺素代谢过程、不饱和脂肪酸的生物合成过程、脂肪酸代谢过程、对氧化应激的反应、羧酸生物合成过程、有机酸生物合成过程、对皮质类固醇的反应等;细胞组成(CC)3个,主要涉及膜筏、膜微区、膜区等;分子功能(MF)46个,主要涉及氧化还原酶活性、抗氧化活性、双加氧酶活性、血红素结合、四吡咯结合、NADP-视黄醇脱氢酶活性、细胞周期蛋白依赖性蛋白丝氨酸/苏氨酸激酶抑制剂活性、磷脂酶激活剂活性等。并用柱状图分别列举了各类排名靠前的条目。见图4。
2.6 KEGG通路富集分析结果
使用R软件对雷公藤与干燥综合征的共同靶点进行KEGG通路富集分析,以矫正后的P值(P-adjust<0.05)为筛选条件,筛选出19条与SS关系密切的通路,主要涉及花生四烯酸代谢、血清素能突触、卵巢类固醇生成、小细胞肺癌、TNF信号通路、多种细胞凋亡、脂肪细胞中脂解的调节、VEGF信号通路、铂类药物赖药性、IL-17信号通路、核因子-κB信号通路、弓形虫病、血小板活化、细胞凋亡、催产素信号通路、卡波西肉瘤相关疱疹病毒感染、沙门菌感染、人巨细胞病毒感染等。见图5。
3 讨论
目前SS的发病机制仍不清楚,研究认为其发病过程是多因素的,与先天免疫系统、自身抗体、细胞因子、上皮细胞、内皮细胞、代谢紊乱和环境等因素相关[1,12]。雷公藤功效的最早记载见于明代兰茂所著的《滇南本草》,书中称其“味辛,性温,有毒。入肝脾十二经,行十二经络”,具有“治筋骨疼痛,风寒湿痹,麻木不仁,瘫痪痿软,湿气流痰”等功效。迄今为止,已从雷公藤中分离得到生物碱类、二萜类、三萜类及多糖等100多种成分[13]。近年来,研究证实了雷公藤的多种成分具有免疫抑制、抗炎、抗氧化、镇痛及神经保护等作用,但雷公藤活性成分改善SS理化指标的潜在机制研究较少,不足以系统阐述其生物过程及代谢通路[14-15]。
网络药理学从多靶点的研究出发,为我们提供了一种研究中药的新策略[16]。本研究通过采用该方法结果显示,雷公藤中共有22种有效成分和413个潜在靶点与SS相关,综合分析化合物与SS网络,发现雷公藤治疗SS的关键化合物有山柰酚、川陈皮素、β-谷甾醇、雷公藤内酯醇和浙贝素;根据等级值大小,得到排名靠前的靶点分别是PTGS2、PTGS1、CASP3、PLA2G4A、AKR1C3、BIRC3,表示它们可能是雷公藤治疗SS的关键靶点。通过分析PPI网络,按照DC值大小最终确定了11个相互作用的靶点基因,显示雷公藤的活性成分作用于多个靶点基因,且各个基因之间相互协同的作用。研究发现,山柰酚能够促进AMPK/Nrf2/HO-1信号通路的激活,缓解ox-LDL诱导的内皮损伤[17];β-谷甾醇具有广泛的药理活性,包括抗菌、抗炎、抗氧化和免疫调节等[18];雷公藤内酯醇可能通过抑制TLR4/核因子-κB信号通路的信号因子表达,从而降低炎性反应递质的产生,减少炎性反应[19];本研究发现大部分成分均能直接作用于PTGS2这个靶点上而发挥关键作用,同时也与其他靶点相互作用共同干预SS进展。PTGS2环氧合酶2(COX-2)已被证实,受多种炎性细胞调控而高表达[20]。基于上述结果可知,雷公藤的有效成分之间存在协同作用,并可能通过降低炎性反应递质水平、调节免疫等途径发挥治疗SS的作用。
GO功能富集分析结果显示,雷公藤治疗SS的生物学进程主要涵盖花生四烯酸、类二十烷酸、脂肪酸、前列腺素等生物的合成与代谢过程。花生四烯酸是一种人体必需的多元不饱和脂肪酸,作为多种生物活性物质的前体,可通过环氧合酶、脂质氧化物和细胞色素P450三大代谢途径生成多种代谢产物,在炎性反应、调控免疫、细胞增殖与凋亡等多方面发挥重要作用[21-22];细胞组成主要涉及膜筏、膜微区、膜区,这些细胞成分可能参与了炎性反应、氧化应激和免疫调节等过程;同时分子功能涉及氧化还原酶、抗氧化、双加氧酶等多种酶的活性,研究发现,多种活性酶可能在SS的进展中发挥作用,其中,组织蛋白酶S(CTSS)活性在SS患者中显著增加,而通过补充蛋白聚糖4可能对SS患者有益[23]。另一项研究发现,胱天蛋白酶3在SS患者的唾液功能障碍中扮演重要角色[24]。
KEGG通路富集分析结果显示,雷公藤治疗SS的信号通路主要为花生四烯酸代谢、血清素能受体、TNF信号通路、多种细胞凋亡、VEGF信号通路、IL-17信号通路、核因子-κB信号通路等。血清素又名5-羟色胺,是一种由色氨酸衍生而来的自体活性物质,作为一种神经递质,通过结合相应受体参与痛觉、体温等生理功能的调节。同时还可作为免疫调节因子在机体神经免疫调节网络中发挥作用。目前发现,有多种血清素受体表达于免疫细胞,血清素通过结合不同的受体,可发挥相应的免疫调节功能[25]。相关研究发现,肿瘤坏死因子-α(TNF-α)在SS患者外周血及唾液腺组织中表达显著增加[26],提示肿瘤坏死因子参与了SS的疾病活动。血管内皮生长因子(VEGF)信号通路是作用最强的正性调控通路之一[27],在诱导血管新生,促使血管内皮细胞的增殖和迁移,提高血管的通透性等方面,发挥了不可替代的作用。研究发现,SS发病之初可能涉及血管内皮细胞、腺上皮细胞或其潜在的基质细胞和树突状细胞功能的改变[1]。并且在干燥综合征动物模型中证实,即使在没有功能性淋巴细胞的情况下,上皮细胞和局部内皮小静脉也会发生变化。白细胞介素-17(IL-17)是自身免疫性疾病的一个有效治疗靶点[28],研究发现,在SS早期通过抑制IL-17能够减少淋巴细胞对唾液腺的浸润,维持正常的唾液量,阻止SS的进一步发展[29]。许多炎性反应递质均受核因子-κB调控,在炎性反应中,游离的核因子-κB被释放并转移到细胞核以转录炎性反应递质,核因子-κB的激活伴随着炎性反应递质的上调和抗氧化系统的下调[30]。此外,有报道称,SS也与感染有关[31]。
综上所述,本研究应用网络药理学方法,对雷公藤治疗干燥综合征的活性成分、作用靶点和信号通路进行了探索性研究,发现雷公藤中的多种活性成分可参与调节花生四烯酸、类二十烷酸、脂肪酸、前列腺素等生物的合成与代谢过程、氧化应激以及多种酶的活性,并通過血清素能突触、TNF信号通路、多种细胞凋亡通路、VEGF信号通路、IL-17信号通路、核因子-κB信号通路等信号通路进行综合靶向调控,从而发挥治疗作用。本研究初步探讨了雷公藤治疗干燥综合征的作用机制,也为雷公藤的深入研究提供了新的思路和参考。
参考文献
[1]Fox RI.Sjgren′s syndrome[J].Lancet,2005,366(9482):321-331.
[2]Witte T.Sjgren′s syndrome[J].Z Rheumatol,2019,78(6):511-517.
[3]Peck AB,Nguyen CQ.What can Sjgren′s syndrome-like disease in mice contribute to human Sjgren′s syndrome?[J].Clin Immunol,2017,182:14-23.
[4]Thorne I,Sutcliffe N.Sjogren′s syndrome[J].Br J Hosp Med(Lond),2017,78(8):438-442.
[5]吴侗,张晶,苏江,等.雷公藤多苷联合白芍总苷与单用雷公藤多苷在干燥综合症治疗疗效[J].中药药理与临床,2017,33(1):178-180.
[6]蒋毅,张唸.雷公藤多甙联合白芍总甙对干燥综合征患者血清Th17/Treg平衡及免疫功能的影响[J].贵州医药,2018,42(12):1446-1447.
[7]李金全,运乃茹,温学红.雷公藤多苷在常见自身免疫性疾病中的临床应用及安全性[J].医学综述,2016,22(19):3850-3853,3854.
[8]Ru J,Li P,Wang J,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].J Cheminform,2014,6:13.
[9]房伟.葛根药理作用研究进展[J].中国药物经济学,2017,12(11):159-160.
[10]李刚,许波,梁学振,等.基于网络药理学研究淫羊藿抗骨质疏松的分子机制[J].中国药理学通报,2018,34(2):267-273.
[11]Tang Y,Li M,Wang J,et al.CytoNCA:a cytoscape plugin for centrality analysis and evaluation of protein interaction networks[J].Biosystems,2015,127:67-72.
[12]Ambrus JL Jr.Sjogren′s syndrome:New paradigms and areas for future research[J].Clin Immunol,2017,182:1-3.
[13]农程,王欣之,江振洲,等.雷公藤对免疫系统作用及机制研究进展[J].中国中药杂志,2019,44(16):3374-3383.
[14]周俊,徐艳,臧银善.雷公藤的抗炎抗免疫作用研究进展[J].医学综述,2019,25(24):4855-4859.
[15]刘莉,闫君,舒积成,等.雷公藤生物碱类成分及其药理活性研究进展[J].天然产物研究与开发,2019,31(12):2170-2181.
[16]Luo TT,Lu Y,Yan SK,et al.net work Pharmacology in Research of Chinese Medicine Formula:Methodology,Application and Prospective[J].Chin J Integr Med,2020,26(1):72-80.
[17]康桂兰,景增秀.山奈酚通过调控AMPK/Nrf2/HO-1信号通路缓解ox-LDL介导的内皮细胞损伤[J].中国免疫学杂志,2018,34(4):525-530.
[18]肖志彬,贾韩学,刘小雷.β-谷甾醇药理活性的研究现状[J].世界最新医学信息文摘(连续型电子期刊),2015,15(8):66-67,68.
[19]陈颖婷,何柯新,王云秀,等.雷公藤内酯醇对类风湿关节炎大鼠TLR4/NF-κB信號通路的调控作用研究[J].国际检验医学杂志,2019,40(17):2053-2057.
[20]李杨,周岚,汪典,等.不同剂量活血、破血中药对动脉粥样硬化小鼠主动脉PTGS2、PADI4、ITGAM基因表达的影响[J].疑难病杂志,2016,15(11):1182-1186.
[21]宋一萌,李明真,马潞林.花生四烯酸代谢产物与肿瘤发生和发展的研究进展[J].临床泌尿外科杂志,2017,32(3):236-240.
[22]Meng H,Liu Y,Lai L.Diverse ways of perturbing the human arachidonic acid metabolic network to control inflammation[J].Acc Chem Res,2015,48(8):2242-2250.
[23]Regmi SC,Samsom ML,Heynen ML,et al.Degradation of proteoglycan 4/lubricin by cathepsin S:Potential mechanism for diminished ocular surface lubrication in Sjgren′s syndrome[J].Exp Eye Res,2017,161:1-9.
[24]Jimenez F,Aiba-Masago S,Al Hashimi I,et al.Activated caspase 3 and cleaved poly(ADP-ribose)polymerase in salivary epithelium suggest a pathogenetic mechanism for Sjgren′s syndrome[J].Rheumatology(Oxford),2002,41(3):338-342.
[25]魏伟,隋秉东,刘洁玮,等.5-羟色胺与免疫系统的关系及其在免疫相关疾病中的作用[J].细胞与分子免疫学杂志,2012,28(9):999-1001.
[26]陈家丽,金月波,李静,等.原发性干燥综合征患者临床和血清学性别差异分析及其发病机制研究[J].中华风湿病学杂志,2018,22(8):526-531.
[27]陈东,冯林森,王羽丰.VEGF/VEGFR2信号通路调控机制的研究进展[J].癌症进展,2019,17(7):748-751,775.
[28]Hu Y,Shen F,Crellin NK,et al.The IL-17 pathway as a major therapeutic target in autoimmune diseases[J].Ann N Y Acad Sci,2011,1217:60-76.
[29]Nguyen CQ,Yin H,Lee BH,et al.IL17:potential therapeutic target in Sjgren′s syndrome using adenovirus-mediated gene transfer[J].Lab Invest,2011,91(1):54-62.
[30]Kim HJ,Kang CH,Jayasooriya R,et al.Hydrangenol inhibits lipopolysaccharide-induced nitric oxide production in BV2 microglial cells by suppressing the NF-κB pathway and activating the Nrf2-mediated HO-1 pathway[J].Int Immunopharmacol,2016,35:61-69.
[31]Nakamura H,Kawakami A,Tominaga M,et al.Relationship between Sjgren′s syndrome and human T-lymphotropic virus type I infection:follow-up study of 83 patients[J].J Lab Clin Med,2000,135(2):139-144.
(2020-03-11收稿 责任编辑:杨觉雄)
基金项目:陕西省科学技术厅项目(2017SF-298);西安市科技计划项目[2019114613YX001SF044(9)]
作者简介:杨少宁(1992.12—),男,硕士研究生在读,住院医师,研究方向:肾脏病基础与临床研究,E-mail:218020621271@email.sntcm.edu.cn通信作者:于小勇(1969.10—),男,硕士,主任医师,硕士研究生导师,研究方向:中西医结合防治慢性肾脏病和血液透析,E-mail:gub70725@126.com
