盐胁迫对毛竹实生苗形态生理生化特征的影响
2021-07-01侯思璇李传哲刘国华杨蒙郑毅姚文静
侯思璇 李传哲 刘国华 杨蒙 郑毅 姚文静


摘要:为探究盐胁迫对毛竹生长发育的影响,分析了不同浓度NaCl溶液(0、12.5、25.0、50.0、100.0、200.0 mmol/L)胁迫条件下毛竹3个月生实生苗形态生理生化特征的变化。随着盐胁迫浓度的增高,毛竹实生苗的叶片卷曲程度增加,叶片黄化现象严重;叶片MDA含量呈上升趋势,抗氧化酶(SOD、POD、CAT)活性、可溶性蛋白含量、游离脯氨酸含量呈先升后降的趋势,在50.0 mmol/L NaCl胁迫6 h时达到最高;在≤50.0 mmol/L NaCl条件下,毛竹实生苗叶片氮蓝四唑(NBT)、二氨基联苯胺(DAB)、Evans blue染色程度与对照条件相似,在>50.0 mmol/L NaCl濃度下,毛竹实生苗叶片与对照条件相比染色程度加深、面积增大。以上结果揭示了毛竹实生苗具有一定的耐盐性(<50.0 mmol/L),为毛竹耐盐能力鉴定和盐碱地区毛竹的竹林培育提供了科学依据。
关键词:毛竹;盐胁迫;形态;生理生化特征;生化染色
中图分类号: Q945.78;S795.701 文献标志码: A 文章编号:1002-1302(2021)10-0136-05
竹子属于禾本科竹亚科,具有生长迅速、可再生性强、适应性强等特点[1]。竹子用途非常广泛,可作笋用、观赏用、生活用、工艺制品用、建材用等[2]。此外,竹资源在保持生态平衡和应对气候变化等方面也发挥着独特作用[3]。但竹林的分布具有明显的地带性和区域性,主要集中在气候温润的长江以南地区,在寒冷、干旱及盐碱地区几乎没有生长[4-5]。因此鉴定竹种的抗逆能力,筛选出一些耐寒、耐旱、耐盐碱的优良竹苗,有效地筛查、选择、拓宽竹子在我国的种植范围,可大大提高竹子产量。
目前已有不少学者对环境胁迫下竹子的生长发育、生理、生化等方面进行了研究,为竹子抗逆能力鉴定提供了科学的理论依据[6]。例如,胡俊靖等综述了水分胁迫对竹子膜脂过氧化、抗氧化酶活性、渗透调节物质、光合生理特性等的影响,分析了竹子在水分胁迫条件下的生理适应与响应规律[7];应叶青等的试验表明,干旱胁迫条件下毛竹幼苗的光合速率、蒸腾速率、叶绿素a和叶绿素b含量与对照条件相比均有所下降,超氧化物岐化酶(SOD)、过氧化氢酶(CAT)活性和丙二醛(MDA)含量等与对照相比则明显增加[8];易守理等研究表明,大叶慈竹主要依靠较高的SOD和CAT活性抵御低温伤害,慈竹则凭借较高的SOD 和过氧化物酶(POD)活性来抵御低温伤害[9]。
我国江苏沿海滩涂面积(68.7万hm2)较大,约占全国滩涂面积的25%,且以1 300 hm2/年的速度不断增长[10]。植树造林是沿海滩涂盐碱地改良的一个重要措施,然而沿海滩涂地区土壤含盐量较高,适生树种少。在高盐胁迫条件下苗木难以存活是制约沿海滩涂植树绿化的关键因素[11]。作为一种生长速度快、可再生性强、适应性强、用途广泛的非木质植物资源,竹子成为生长效益和经济效益较高的首选绿化栽培植物之一[1-3]。其中毛竹(Phyllostachys edulis)生长密度大,是我国分布最广、蓄积量最大、经济价值最高的重要经济竹种,我国90%的竹材都来源于毛竹[3],因此对其盐胁迫适应性的研究十分重要。但至今还未有盐胁迫对毛竹实生苗生长发育影响的系统研究。本研究分析不同浓度NaCl对毛竹3个月生实生苗形态生理生化方面的影响,探究毛竹实生幼苗在盐胁迫条件下的生长发育规律,以填补毛竹实生苗耐盐能力研究的空白。
1 材料与方法
1.1 试验时间与地点
试验时间为2019年10月至2020年6月,地点为南京林业大学(118°48′42″E,32°04′34″N)。
1.2 试验材料处理
毛竹种子采自广西壮族自治区桂林市灵川县。将种子播于泥炭土 ∶ 黄棕壤 ∶ 珍珠岩=12 ∶ 12 ∶ 1(体积比)的土壤中,置于20~24 ℃、光照/黑暗周期为12 h/12 h的植物光照培养箱中培养3个月。待毛竹幼苗长出4~6张叶片时,选择长势较好的健康幼苗连根带土整体挖出,用水洗净根部放入水中继续培养1周(图1)。
水培1周后,将毛竹幼苗分别放在0、12.5、25.0、50.0、100.0、200.0 mmol/L的NaCl溶液中进行处理,编号为0~5号,每个处理3次生物学重复,每次生物学重复10株幼苗。分别在3、6、24 h的时间点观察毛竹实生苗的形态变化,并进行破坏性取样用于各项生理指标测定和生化染色观察。
1.3 生理生化指标的测定
毛竹叶片SOD活性采用抑制氮蓝四唑(NBT)光还原法测定,POD活性采用愈创木酚法测定,CAT活性采用紫外吸收法测定,MDA含量采用硫代巴比妥酸法测定,可溶性蛋白质含量采用考马斯亮蓝 G-250 染色法测定,游离脯氨酸含量采用酸性茚三酮显色法测定[12-14]。毛竹叶片NBT、二氨基联苯胺(DAB)和Evans blue染色参考烟草叶片的染色方法[15]。
2 结果与分析
2.1 NaCl胁迫对毛竹实生苗形态的影响
毛竹实生苗的外部形态变化是植物受到盐胁迫时最直观的反应。如图2所示,处理3 h,200.0 mmol/L NaCl溶液下的小部分幼苗叶片稍有卷曲,其余浓度下的幼苗均无明显变化(图2-A);处理6 h,100.0、200.0 mmol/L NaCl溶液处理的毛竹幼苗叶片已经有明显卷曲,50.0 mmol/L NaCl溶液处理的幼苗也开始发生叶片卷曲的现象(图2-B);处理24 h,50.0、100.0、200.0 mmol/L NaCl溶液处理的毛竹幼苗均出现叶片卷曲的现象,并且随着浓度的升高,卷曲叶片的数量越多、程度越大(图2-C)。其中,100.0、200.0 mmol/L浓度下的毛竹叶片已经完全卷曲,叶片也有发黄的迹象。结果表明,低浓度的NaCl溶液(<50.0 mmol/L)对毛竹实生苗形态的影响不大,但长时间、高浓度的NaCl溶液(≥100.0 mmol/L)处理会使毛竹幼苗叶片发生明显的卷曲、黄化。随着时间的推移和盐浓度的增加,毛竹幼苗被胁迫的程度增加。
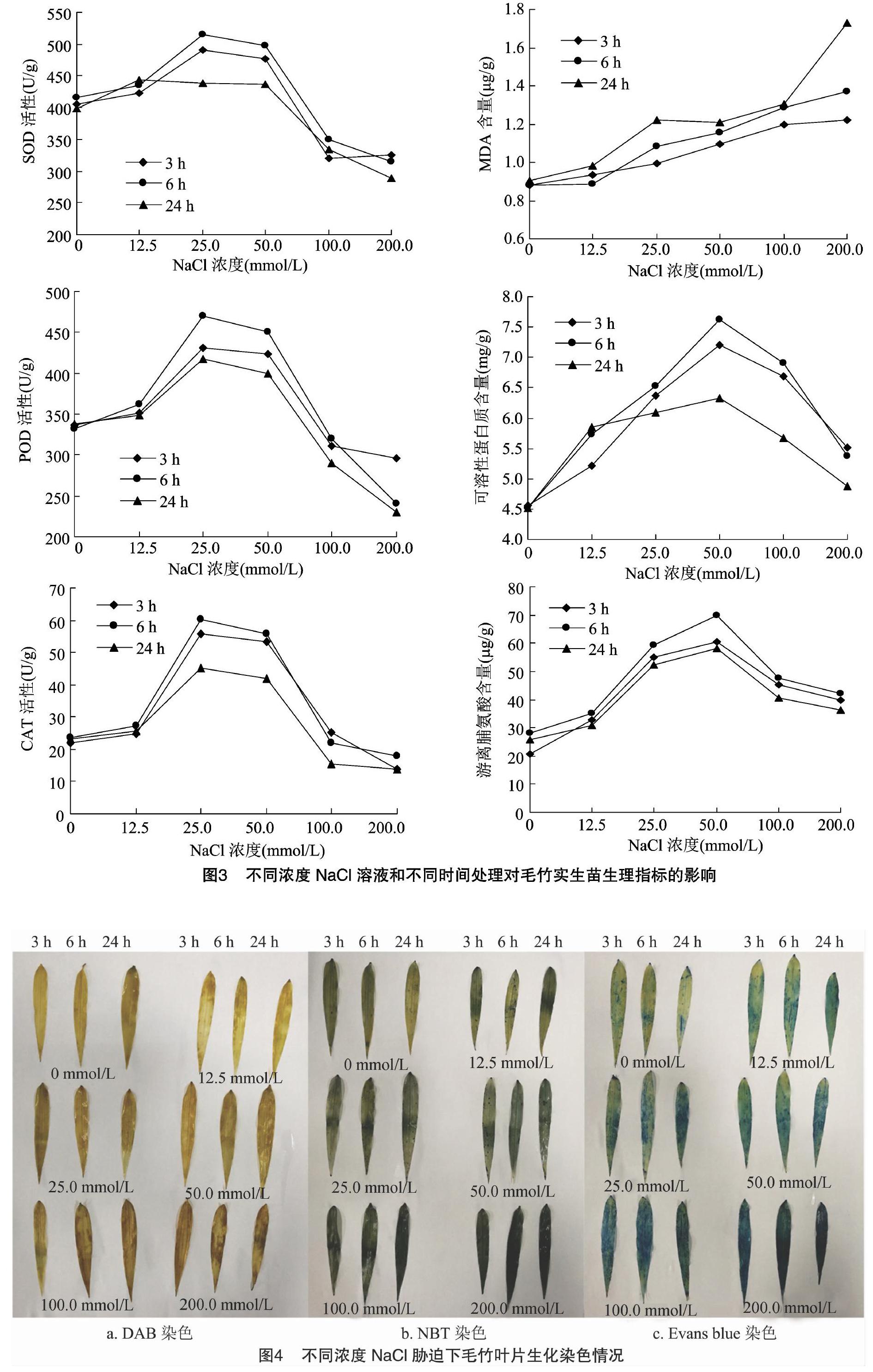
2.2 NaCl胁迫对毛竹实生苗生理指标的影响
如图3所示,毛竹叶片SOD、POD、CAT活性随着NaCl溶液浓度的增高呈现先升后降的趋势。在低浓度NaCl溶液(<50.0 mmol/L)胁迫下,随着NaCl浓度的增加SOD、POD、CAT活性明显增加,随着胁迫时间增加酶活性变化明显,胁迫处理6 h时酶活性最大。高浓度NaCl溶液胁迫下,SOD、POD、CAT活性明显下降,酶活性随胁迫时间延长变化不明显。以上结果表明,低浓度NaCl溶液(<50.0 mmol/L)胁迫下,毛竹叶片所受到的胁迫程度较低,产生的有害物质较少,植物体内抗氧化酶活性的提高足以清除植物体内产生的有害物质,毛竹叶片受到的损害较小;高浓度NaCl溶液(>100.0 mmol/L)胁迫下,植物体内的酶活性无法完全催化分解有害物质,导致植物膜和组织受到不可逆的严重损伤。毛竹叶片MDA含量随着NaCl溶液浓度的增高和胁迫时间的增长,呈明显上升趋势。
当NaCl溶液浓度≤100.0 mmol/L时,MDA含量变化随胁迫时间延长变化较小;当NaCl溶液浓度达到200.0 mmol/L时,MDA含量随胁迫时间延长变化明显,在胁迫24 h时达到最高。以上结果表明,NaCl溶液浓度越高胁迫时间越长,毛竹叶片中MDA积累越多,质膜受损害程度越大,低浓度的盐胁迫对毛竹幼苗影响较小,高浓度的盐胁迫会严重迫害毛竹质膜。毛竹叶片可溶性蛋白质含量随着NaCl溶液浓度的升高,呈现先上升后降低的趋势。低浓度NaCl溶液(<50.0 mmol/L)胁迫可刺激毛竹有机体合成可溶性蛋白质,提高自身的防御功能。高浓度NaCl溶液(≥100.0 mmol/L)脅迫破坏了毛竹叶片细胞生物膜及细胞内渗透系统,可溶性蛋白质合成受阻,含量下降。毛竹叶片游离脯氨酸含量随着NaCl溶液浓度升高也呈先升后降的趋势。低浓度NaCl溶液(<50.0 mmol/L)胁迫条件下,毛竹叶片脯氨酸含量增高趋势明显,胁迫处理6 h时达到最大值;高浓度NaCl溶液(≥100.0 mmol/L)胁迫时,毛竹叶片游离脯氨酸含量明显下降。高浓度盐胁迫导致植物体合成脯氨酸的能力降低。
2.3 NaCl胁迫下毛竹实生苗叶片生化染色
逆境胁迫条件下,植物体内的活性氧平衡遭到破坏,活性氧的积累导致植物膜结构损害和细胞死亡。生化染色可区分出植物活细胞,有活性的细胞有外排功能不被染色。如图4所示,当NaCl溶液浓度较低时(<50.0 mmol/L),毛竹叶片染色程度与对照条件下类似。随着NaCl溶液浓度的增高和胁迫时间的延长,毛竹叶片被染色的区域变大、颜色变深,表明毛竹叶片细胞死亡数量增多。在NaCl浓度为200.0 mmol/L时,毛竹叶片染色颜色最深。说明毛竹实生苗在高浓度NaCl溶液(≥100.0 mmol/L)处理下,体内活性氧的积累量自身不可消除,叶片细胞大量死亡,有机体受到不可逆的伤害。
3 讨论与结论
逆境胁迫会影响植物的正常生长发育,导致植物形态、生理、生化等多方面发生变化[15]。形态上主要表现为叶片萎蔫变黄、叶面积减少、叶片脱落等。生理水平上的变化可从一系列生理、生化指标中反映出来,如抗氧化酶活性、活性氧(H2O2、O-2·、·OH等)积累、死细胞数目等[15-19]。SOD是广泛分布于植物体内的一种抗氧化金属酶,在有机体内起氧化与抗氧化平衡的作用[16]。POD是普遍存在于植物体内的一种氧化还原酶,参与植物的光呼吸作用和乙醛酸循环,其活性与植物的代谢强度和抗逆能力存在一定关系[17]。MDA是生物体内自由基和脂质氧化生成的,其产生会加剧膜的损伤,影响线粒体部分关键酶活性和呼吸复合链[18]。CAT普遍存在于各种生物有机体细胞中,可催化细胞中的过氧化氢转化为无害或伤害较小的其他物质以降低对植物机体造成的损害[19]。植物为了抵抗逆境胁迫会启动防御系统,清除植物体内的活性氧等有害物质。当植物受到的伤害过大,植物体内有害物质的产生与清除失去平衡,可能会导致不可逆的细胞内稳态失衡如脂质过氧化、膜损伤、酶失活等,最终导致细胞死亡[17-19]。
本研究以毛竹3个月实生幼苗为研究对象,分析了不同浓度NaCl溶液对其形态生理生化方面的影响。低浓度盐胁迫条件下,毛竹幼苗形态上的变化较小。但在高浓度盐胁迫下,毛竹实生苗叶片就会发生明显卷曲、黄化。随着盐胁迫浓度的增高和胁迫时间的延长,毛竹实生苗叶片MDA含量呈上升趋势,与观音竹、绿竹MDA含量随盐分胁迫的加重而提高的试验结果[20-21]一致。毛竹实生苗叶片SOD、POD、CAT活性表现为先升高后降低的规律,与不同浓度盐胁迫下白竹及其他植物如柳树、素馨属植物、李属彩叶植物等的酶活性表现出先升后降的趋势[22-25]一致。毛竹实生苗叶片游离脯氨酸含量随着盐浓度的增高也出现先增后减的趋势,与绿竹、大头典、吊丝单随胁迫强度的增强和胁迫时间的延长而增加的结果[26]不同,但与其他植物在不同浓度盐胁迫后游离脯氨酸含量变化的研究结果[23-25]一致。生化染色结果表明,毛竹实生苗叶片染色程度随着盐浓度增加而加深,间接说明在高浓度盐胁迫下毛竹实生苗叶片会积累大量活性氧,造成细胞的大量死亡。综上,在一定盐浓度范围内,毛竹实生苗可通过调节自身内部物质和抗氧化酶活性降低外界胁迫对植物机体造成的伤害。毛竹实生苗所能承受的盐浓度为50 mmol/L(约0.3%),低于绿竹、大头典、吊丝单等所能忍受的盐分质量(0.4%)[26]和观音竹所能承受的盐分质量(0.5%)[20],可能原因是选取的竹子苗期不同,毛竹为3个月生实生苗,而其他研究中选取的竹子为成苗。
我国盐碱地面积大、分布范围广,长江以北地区和诸多沿海地区,特别是江苏沿海地区的土壤中往往盐含量过高,限制了竹子的生长范围。目前利用种子培育实生苗是筛选优良无性系和竹类植物种质创新的有效途径[27]。确定了毛竹实生苗的耐盐限度,能有效地筛查、选择和拓展毛竹实生苗造林的区域,或者通过土壤改良使其适宜毛竹实生苗的生长,为拓宽毛竹在江苏沿海滩涂盐碱地的种植范围、提高江苏省毛竹产量提供理论依据。
参考文献:
[1]凡美玲,方水元,冯俊娇,等. 4个竹种高生长模型的比较[J]. 竹子学报,2018,37(2):64-70.
[2] Liese W,Khl M. Bamboo:the plant and its uses [M]. Heidelberg:Springer,2015.
[3]姚文静,王 茹,王 星,等. 毛竹实生苗生长发育规律及其模型拟合研究[J]. 西部林业科学,2020,49(3):14-20,28.
[4]李正才,傅懋毅,姜景民,等. 毛竹天然林表型特征的地理变异研究[J]. 林业科学研究,2002,15(6):654-659.
[5]周本智,傅懋毅,杨校生,等. 我国能源竹类植物资源及其开发潜力[J]. 世界林业研究,2006,19(6):49-52.
[6]景 雄,蔡春菊,范少辉,等. 环境胁迫下竹类植物生态适应性研究进展[J]. 世界林业研究,2018,31(4):36-41.
[7]胡俊靖,陈卫军,郭子武,等. 水分胁迫对竹子生理特性影响的研究进展[J]. 西南林业大学学报,2015,35(1):91-95.
[8]应叶青,郭 璟,魏建芬,等. 干旱胁迫对毛竹幼苗生理特性的影响[J]. 生态学杂志,2011,30(2):262-266.
[9]易守理,雷 霆,高素萍. 低温胁迫对两种丛生竹抗氧化剂活性影响的研究[J]. 北方园艺,2010(19):153-156.
[10]郭文琦,張培通,李春宏,等. 沿海滩涂绿化树种选择和耐盐性评价[J]. 江苏农业科学,2014,42(10):175-177.
[11]张 健,李玉娟,李 敏,等. 江苏沿海滩涂盐碱地综合改良技术[J]. 安徽农学通报,2011,17(12):172.
[12]孔祥生,易现峰. 植物生理学实验技术[M]. 北京:中国农业出版社,2008:252-264.
[13]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:182-192.
[14]王晶英. 植物生理生化实验技术与原理[M]. 哈尔滨:东北林业大学出版社,2003:133-136.
[15]姚文静. 杨树转录因子ERF76基因耐盐功能研究[D]. 哈尔滨:东北林业大学,2016:62-64.
[16]Alscher R G,Erturk N,Heath L S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants[J]. Journal of Experimental Botany,2002,53(372):1331-1341.
[17]Xie Z X,Duan L S,Tian X L,et al. Coronatine alleviates salinity stress in cotton by improving the antioxidative defense system and radical-scavenging activity[J]. Journal of Plant Physiology,2008, 165(4):375-384.
[18]Gill S S,Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry,2010,48(12):909-930.
[19]Yao W J,Wang L,Zhou B R,et al. Over-expression of poplar transcription factor ERF76 gene confers salt tolerance in transgenic tobacco[J]. Journal of Plant Physiology,2016,198:23-31.
[20]吴幼容,郑郁善. 观音竹对盐胁迫的生长及生理生化响应[J]. 福建林学院学报,2012,32(1):23-27.
[21]郑郁善,郑容妹,姚庆端. 盐分胁迫对沿海沙地绿竹生理生化的效应[J]. 福建农林大学学报(自然科学版),2003,32(4):478-481.
[22]何开跃,郭春梅. 盐胁迫对3种竹子体内SOD、POD活性的影响[J]. 江苏林业科技,1995,22(4):11-14.
[23]季琳琳,吴中能,刘俊龙,等. NaCl胁迫对两种柳树幼苗生理特性的影响[J]. 东北农业大学学报,2014,45(1):77-82.
[24]程淑娟,唐东芹,刘群录,等. 盐胁迫下的2种素馨属植物生理特性[J]. 福建林学院学报,2012,32(1):33-38.
[25]胡晓立,李彦慧,陈东亮,等. 3种李属彩叶植物对NaCl胁迫的生理响应[J]. 西北植物学报,2010,30(2):370-376.
[26]郑容妹. 沿海沙地引种绿竹等竹子的抗盐抗旱机理研究[D]. 福州:福建农林大学,2003.
[27]姚文静,王 茹,王 星,等. 3个竹种实生竹苗质量评价研究[J]. 西北林学院学报,2020,35(5):116-121.
