低温胁迫下桑寄生种子各生理指标的变化
2021-07-01潘丽梅韦树根何丽丽万凌云付金娥
潘丽梅 韦树根 何丽丽 万凌云 付金娥


摘要:为研究低温胁迫下桑寄生顽拗性种子各生理生化指标的变化,以不同温度处理桑寄生种子,然后在不同时间段取样进行相关生理生化指标的测定。结果表明,桑寄生种子对低温敏感,低温胁迫下其电导率、可溶性糖含量、淀粉含量、可溶性蛋白含量、过氧化氢酶(CAT)活性、超氧化物歧化酶(SOD)活性和抗坏血酸过氧化物酶(APX)活性等均受到了不同程度的影响甚至破坏,其中0 ℃为桑寄生种子最敏感的低温界限,0 ℃下放置12 h和36 h时各项指标变化最明显,低于0 ℃的条件已不利于桑寄生种子的萌发和保存,研究结果将为桑寄生种子的萌发及保存提供理论依据。
关键词:桑寄生;顽拗性种子;低温胁迫;生理生化
中图分类号:S567.01 文献标志码: A 文章编号:1002-1302(2021)10-0109-04
桑寄生[Taxillus chinensis (DC.) Danser],植物學名广寄生,是我国传统的常用大宗中药材,具有祛除风湿、补肝肾、强筋骨、安胎元的功效[1],为历版《中国药典》收载品种,也是广西乃至我国极具特色的道地寄生类药材,早在明朝万历年间的《广西通志》就记载了桑寄生和桑寄生酒是广西的主要特产[2]。桑寄生种子是典型的顽拗性种子,具有顽拗性种子的典型特征,易失活,低温敏感性强,但是作为一种寄生类植物,只能通过其种子进行繁殖,因此种子的顽拗性严重制约其繁育与发展[3]。目前对顽拗性种子的低温保存技术研究较多[4-6],但能真正实行长期低温保存的实例较少,其根本原因是对低温敏感的响应机制了解不够,因此作为引起顽拗性种子死亡的主要原因之一,种子低温敏感性研究一直备受关注。当种子遭到低温胁迫时,一方面会引起生物膜的变化,从液晶态变成凝胶态;另一方面也会引起膜系统结构的变化,使膜上的各种酶活性受到损害,从而引起细胞生理生化发生异常变化,造成种子的劣变甚至死亡。另外,有研究表明,为减缓低温所带来的伤害,种子本身会通过形成一些小分子物质或者让原有物质进行分解,调节细胞内含物中渗透调节物质的含量,从而达到稳定细胞膜系统的作用,缓解低温胁迫造成的损害[7-8]。因此,本研究以桑寄生种子为材料,研究低温胁迫下其电导率及超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)活性等相关生理指标的变化,为系统研究桑寄生低温敏感和低温保存技术提供依据。
1 材料与方法
1.1 材料
2018年11月至2019年4月,采集广西壮族自治区药用植物园科研基地中寄生于桑树上的桑寄生种子作为试验材料,选取成熟度一致、饱满、无病虫害与机械损伤的桑寄生种子,经前期清洗、剥除果皮果胶后置于不同温度(-4、0、4、10 ℃)下处理12、24、36、48 h,以25 ℃培养(CK)处理同样时长为对照,了解低温敏感过程的生理生化变化,其中-4、0、4、10 ℃置于可设置不同温度冰箱中(相对湿度为70%~75%),其精确度为±0.1 ℃,25 ℃(CK)处理置于人工气候培养箱进行(相对湿度为70%~75%,为与冰箱光照度保持一致,培养箱的光照关闭),然后对桑寄生种子各处理进行相关生理指标测定及分析。
1.2 方法
参照李合生的方法[9],采用DDS-307型电导仪测定电导率;采用蒽酮比色法测定可溶性糖和淀粉的含量;采用考马斯亮蓝G-250法测定可溶性蛋白含量;采用高锰酸钾滴定法测定过氧化氢酶(CAT)活性;采用抑制光化还原法测定超氧化物歧化酶(SOD)活性;抗坏血酸过氧化物酶(APX)的活性采用抗坏血酸过氧化物酶试剂盒进行测定,具体操作按试剂盒方法进行。
1.3 数据处理
试验数据均做3次重复,用Microsoft Office Excel和SPSS 16.0对数据进行统计分析作图。
2 结果与分析
2.1 种子浸出液相对电导率的变化
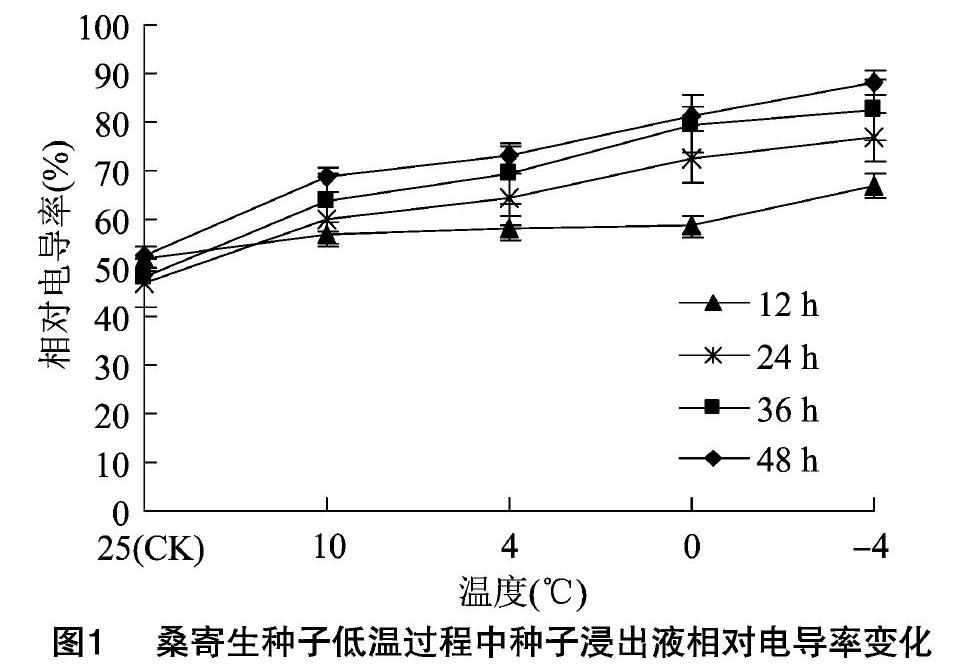
相对电导率在一定程度上可以反映植物细胞膜透性的变化趋势,反映细胞膜遭受逆境胁迫时所受到的影响。由图1可见,随着低温胁迫处理的进行以及处理时间的延长,桑寄生种子的相对电导率整体呈上升趋势,且均高于对照值,但不同的低温处理下,升高的幅度不同,在10 ℃和4 ℃处理下随着低温时间的延长电导率的增幅不大,但在0 ℃和-4 ℃处理下其电导率的增幅较大,特别是在低温处理的12 h后明显增加,说明桑寄生种子于0 ℃以下低温处理12 h以后,细胞膜透性产生了较大的变化,如相关的外渗物质增多,表明细胞膜遭受到了一定程度上的破坏,从而导致其相对电导率不断上升。
2.2 可溶性糖含量的变化
可溶性糖的种类主要包括蔗糖、葡萄糖等一系列糖类物质,其含量变化与抗冻能力密切相关,一定含量的糖类物质可明显提高植物细胞的渗透调节能力,并维持低温下细胞膜的正常功能。由图2可以看出,桑寄生种子在逐渐低温培养的过程中,可溶性糖含量整体上呈缓慢下降然后上升接着又下降的过程,10 ℃和4 ℃整体上影响不大,到0 ℃时突然升高然后下降,可能是因为当种子遭遇低温伤害时,种子通过增加相关的糖类物质含量来达到抗冻目的,0 ℃时的增加最为明显,均高于对照水平。此外,0 ℃放置不同时间的影响也不一样,总体上是随着放置时间的延长可溶性糖含量进一步降低,在0 ℃放置12 h时达到峰值,随后缓慢下降,可见0 ℃冰点前后是可溶性糖含量变化的最大时期,也是最关键的时期,表明处于低温结冰期的桑寄生种子所遭受的胁迫已达极限,对低温最敏感。
2.3 淀粉含量的变化
当种子处于低温环境从而遭受低温胁迫时,其内含物均会发生一系列的变化,其中淀粉含量的动态变化与碳水化合物积累的趋势息息相关。由图3可见,25 ℃(CK)和10 ℃处理条件下,各处理时间点的淀粉含量变化不大,但随着处理温度的降低,淀粉含量呈缓慢增加然后急剧下降的过程,具体表现为在低温处理前期,各处理时间点的淀粉含量均呈上升趋势,与4 ℃处理相比,到达0 ℃时,放置 12 h 时淀粉含量仍然呈上升趋势,但在放置36 h后开始下降,不过总体上仍高于对照水平。在4 ℃处理条件下,随着放置时间的延长,淀粉含量逐渐上升;但在0 ℃处理条件下,随着低温放置时间的延长,淀粉含量则逐渐降低;而在-4 ℃时各处理时间点的淀粉含量均呈急剧下降的趋势,且幅度下降较大,推测是由于低温诱导了水解酶的活性,使淀粉的分解加速。
2.4 可溶性蛋白含量的变化
可溶性蛋白是种子内重要的渗透调节物质和营养物质,与植物的抗冻性密切相关。遭遇低温胁迫时植物可溶性蛋白含量会有一定程度的增加,但低于界限温度则影响蛋白合成。由图4可知,桑寄生种子低温过程中其可溶性蛋白含量呈缓慢下降然后上升最后下降的趋势, 波动性较大。随着处理时间的延长,在0 ℃处理条件下,可溶性蛋白含量逐渐增加,在放置36 h时达到峰值,随后下降,这也可能是机体对低温环境逐步适应的表现,而在-4 ℃处理条件下,各时间点的可溶性蛋白含量直线下降,且都低于对照值,说明蛋白合成已严重受阻。
2.5 过氧化氢酶(CAT)活性的变化
过氧化氢酶(CAT)是一种酶类清除剂,可以控制植物体内的H2O2水平。图5显示,低温处理前期,桑寄生種子的CAT活性总体上呈缓慢上升的趋势,说明遭受低温胁迫后反而诱导了CAT活性增加。低温处理12、24、36 h,CAT活性在波动中上升,在0 ℃放置36 h时达到峰值,随后直线下降;而低温处理48 h,CAT活性前期平稳上升,但在4 ℃低温以后下降,除了-4 ℃低温处理下,其他低温处理后的CAT活性与对照相比,均高于对照;随着低温处理的进一步进行,CAT活性均受到明显抑制,迅速降低,表明低温处理过程桑寄生种子的CAT酶遭受了严重的破坏,其中0 ℃为最敏感的温度界限。
2.6 超氧化物歧化酶 (SOD) 活性的变化
SOD是清除氧自由基的关键酶之一,可以减缓氧自由基对细胞膜的伤害。图6显示,低温处理的12 h和36 h,桑寄生种子的SOD活性前期呈平缓上升后期则出现明显下降的趋势,于0 ℃处理36 h时达到最大值,然后开始下降并低于对照值,表明低温处理后期其SOD酶受到了不可逆转的破坏,从而导致膜系统进一步受到损害。
2.7 抗坏血酸过氧化物酶(APX)活性的变化
APX是植物清除活性氧的重要抗氧化酶之一,也是抗坏血酸代谢的关键酶之一,其活性的升高可使超氧阴离子自由基(O-2 ·)产生速率下降,膜质过氧化作用减弱[10]。由图7可知,在桑寄生种子低温胁迫过程中,APX的活性先上升然后在波动中下降,以4 ℃处理48 h 时活性最高,0 ℃处理时开始下降,其中12 h时下降最明显,表明桑寄生种子在低温处理前期APX活性增加,后期则下降,特别是 -4 ℃ 处理条件下其APX活性均低于对照。前期APX活性的升高,说明桑寄生种子抵御膜脂过氧化的能力提高,后期下降可能是因为低温已经严重伤害桑寄生种子,损害了APX酶本身。
3 结论与讨论
顽拗性种子由于不耐低温,因此常规的长期保存方法难以适用,如低温种子库等。玩拗性种子的保存一直以来都是顽拗性种子植物研究的重点和难点,因此了解顽拗性种子低温敏感机理尤为重要,但顽拗性种子的低温敏感性是一个复杂的进化过程。目前在顽拗性种子研究方面,大部分的研究主要在于脱水敏感性研究,而对其低温敏感研究较少。桑寄生种子对低温敏感,本试验的低温胁迫过程表明,0 ℃为桑寄生种子最敏感的温度界限,明显有别于其他正常性种子,如榔榆种子的低温耐受范围为≥-10 ℃[11]。植物低温胁迫下其生理生化指标会出现明显变化甚至是一些不可逆的影响,主要表现在叶绿素合成受阻、各种光合酶活性受到抑制、细胞膜系统受损、体内的各种代谢发生紊乱、植物体内的渗透物质和水含量的改变等方面[12-14]。本试验结果表明,随着胁迫温度的降低和胁迫时间的延长,桑寄生种子的电导率总体呈增加趋势,说明电导率与低温及低温胁迫的持续时间密切有关,处理温度越低,处理时间越长,细胞膜系统受的破坏越严重,电导率也越大,这与低温胁迫下玉米种子萌发过程的电导率变化情况相似[15]。
可溶性糖、可溶性蛋白、淀粉等作为植物渗透调节物质和内含物,通过积累或分解渗透调节物质,进而达到调节细胞渗透平衡的目的,从而缓解逆境条件下对植物所造成的伤害[16]。本试验中,随着处理温度的降低和处理时间的延长,桑寄生种子的可溶性糖、可溶性蛋白以及淀粉含量都有了明显的变化,可溶性糖和可溶性蛋白含量均呈现出“降—升—降”的变化趋势,而淀粉含量则呈现出“升—升—降”的变化趋势,有学者认为,较高含量的可溶性糖和可溶性蛋白是增强植物抗寒性的内在原因[17],说明桑寄生种子在遭遇低温过程中,合成了相关的糖和蛋白来对抗低温胁迫,但随着低温时间的延长合成明显受损。另外低温胁迫下,CAT、SOD和APX活性随胁迫温度的下降和胁迫时间的延长总体上呈先升高后下降的变化过程,这可能是保护酶应对逆境的一种响应。在本试验中,保护酶活性不断升高,可防御低温对种子造成的伤害,但达到一定温度或者一定时间时酶活性下降,说明某个温度下或者某个低温延续时间下可能已导致种子受到冻害,这与低温处理下的羯布罗香种子[18]、蓖麻种子[19]的响应相似。众所周知,CAT作为清除H2O2的重要酶类,主要通过Halliwell-Asada途径清除叶绿体中过多的H2O2,而APX恰好是这一途径的重要组分之一[20-21],因此两者的变化更能反映系统清除H2O2的能力,而SOD则是抵御氧化损伤的首道防线[22],SOD、CAT、APX被认为是H2O2清除系统中最重要的酶类。研究结果表明,桑寄生种子不耐低温,低于0 ℃时其活性氧和体内的保护系统动态平衡已被破坏,进一步加剧了自身的膜脂过氧化作用。
综上所述,桑寄生种子低温胁迫下电导率、渗透调节物质、内含物、抗氧化系统等均受到了不同程度的影响甚至破坏,0 ℃为桑寄生种子最敏感的低温界限,0 ℃下放置12 h和36 h时各项指标变化最明显,低于0 ℃的条件已不利于桑寄生种子的萌发和保存,本研究结果将为后续关于低温敏感对桑寄生种子生理生化影响的更全面地研究提供一定的参考,也将为进一步探讨其低温敏感机理提供基础数据。
参考文献:
[1]国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国中医药科技出版社,2015:299-300.
[2]朱论欢. 广西通志[M]. 南宁:广西人民出版社,2002:857.
[3]韦树根. 桑寄生顽拗性种子生物学特性及脱水敏感性机理研究[D]. 北京:北京协和医学院,2017.
[4]Berjak P,Pammenter N W. Implications of the lack of desiccation tolerance in recalcitrant seeds[J]. Frontiers in Plant Science,2013,4:478.
[5]穆红梅,夏 冰,汪 仁,等. 顽拗性种子——中国石蒜种子的贮藏特性研究[J]. 种子,2011,30(12):43-45.
[6]曾 琳,吴 怡,何明军,等. 超低温冷冻对益智种子生理生化特性的影响[J]. 广西植物,2018,38(4):529-535.
[7]Moothoo-Padayachie A,Macdonald A,Varghese B,et al. Uncovering the basis of viability loss in desiccation sensitive Trichilia dregeana seeds using differential quantitative protein expression profiling by iTRAQ[J]. Journal of Plant Physiology,2018,221(2):119-131.
[8]温日宇,刘建霞,李 顺,等. 低温胁迫对不同藜麦幼苗生理生化特性的影响[J]. 种子,2019,38(5):53-56.
[9]李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:167-169.
[10]李 娇. 链格孢菌侵染对芒果贮藏品质及生理的影响[D]. 福州:福建农林大学,2016.
[11]吴晓宇. 不同温度处理对榔榆种子萌发及幼苗生理生化指标的影响[D]. 泰安:山东农业大学,2018.
[12]郁万文. 银杏抗寒机理及种质资源抗寒性评定的初步研究[D]. 南京:南京林业大学,2008.
[13]毕庆文,汪 健,杨志晓,等. 成熟期大田渍水胁迫对烤烟叶片生理特性的影响[J]. 中国烟草学报,2009,15(2):46-49,54.
[14]李桂荣,连艳会,程珊珊, 等. 低温胁迫对山葡萄等6个葡萄品 种抗寒性的影响[J]. 江苏农业科学,2019,47(8):130-134.
[15]南 铭. 低温冻害对不同粒型玉米种子萌发及生理生化指标的影响[D]. 兰州:甘肃农业大学,2010.
[16]张 丽,贾志国.低温对不同萌发状态裸燕麦种子生长生理特性的影响[J]. 江苏农业科学,2016,44(6):161-164.
[17]赵 慧,赵一博,郭江波,等. 植物耐受低温胁迫研究进展[J]. 种子,2017,36(5):47-50.
[18]曾 琳,顾雅坤,吴 怡,等. 超低温冷冻对羯布罗香种子结构和生理生化特性的影响[J]. 热带亚热带植物学报,2018,26(3):249-254.
[19]白 雪,李 兴,刘 鹏,等. 低温胁迫对蓖麻种子萌发过程中生理生化影响[J]. 农学学报,2017,7(3):5-8.
[20]Gong M,Chen B O,Guo L. Heat-shock induced cross adaption to heat,chilling,drought and salt stress in maize seedlings and involvement of H2O2[J]. Journal of Plant Physiology,2001,158(9):1125-1130.
[21]Yousef S,Gholamreza H,Weria W,et al. Changes of antioxidative enzymeslipid peroxidation and chlorophyll content in chickpea types colonized by different Glomus species under drought stress[J]. Symbiosis,2012,56(1):5-18.
[22]李 昕,高洪儒,趙北平. 低温和盐复合胁迫对玉米种子生理生化指标的影响[J]. 黑龙江农业科学,2016(7):19-24.
