膳食脂质-过敏原互作的研究进展
2021-07-01曲也直高雅然武俊瑞
杨 慧,曲也直,高雅然,武俊瑞
(沈阳农业大学食品学院,辽宁 沈阳 110000)
越来越多的研究表明,全球的食物过敏发生率逐年升高,但发生率增加的机制尚不明确。食物过敏的致敏阶段是一个多因素相互作用的过程,不仅受过敏原及其生物学功能本身的影响,还受到食品中其他小分子化合物(如脂质)的影响。食物中脂质可以改变胃与十二指肠对过敏原的消化敏感性,并通过提供脂质介导摄取或破坏肠道上皮屏障,促进过敏原在肠道的运输和吸收;其也可以作为佐剂,激活机体先天或适应性免疫反应,向辅助型T2(T helper 2,Th2)细胞反应倾斜,最终增强过敏原的致敏特性,增加人群患食物过敏的机率[1]。例如巴西坚果过敏原Ber e 1只有在脂质存在时才能诱导机体产生免疫球蛋白(immunoglobulin,Ig)E或IgG1抗体[2];蛋黄(干质量65%为脂质)可以通过上调机体肠道白细胞介素(interleukin,IL)-33的表达,刺激机体Th2细胞的增殖,从而引起机体对鸡蛋过敏[3];体外消化实验也证实,脂质降低了十二指肠酶对葡萄过敏原非特异性脂质转移蛋白(nonspecific lipid transfer proteins,nsLTPs)的消化速率,提高了其诱导机体嗜碱性粒细胞释放组胺及激发皮肤过敏反应的能力[4]。基于此,本文通过综述食物过敏疾病、膳食脂质及高脂饮食等研究进展,以探究膳食脂质对食物过敏的影响以及可能的机制,以期为预防和治疗食物过敏提供新的思路。
1 食物过敏现象概述
食物过敏现象在全球范围内愈发普遍,已成为一个重要的公共卫生问题。据统计,2019年全世界约有2.2亿 人患有食物过敏疾病,且过去20 年来,西方国家学龄前儿童食物过敏发生率高达10%[5-6]。虽然食物过敏长期以来被认为是一种儿科疾病,且随着年龄的增长病症会逐渐消失,但调查发现,成年和老年食物过敏患者数量近年来也在持续增长[7]。食物过敏有着广泛的临床表现,从轻微的器官局部不适(如腹泻),到严重的休克甚至死亡[8]。虽然每种食物都可能成为潜在的过敏原,但受地域环境、膳食结构和基因遗传的影响,不同年龄段、不同地区食物过敏的主要过敏原种类有所差异。例如儿童过敏最常见的食物是牛肉、鸡蛋、小麦、鱼、贝类、花生、核桃和大豆,成年人则主要对鱼、海鲜、花生、坚果和水果过敏[9-10]。而墨西哥学龄前儿童则主要对巧克力、草莓、甲壳类和鸡蛋过敏[11];智利人却大多对坚果和花生过敏[12]。目前,我国尚缺乏全国范围内及全年龄段儿童食物过敏患病率的流行病学调查大数据,多数研究仅局限于特定地区、特定年龄段和特定过敏原种类。解洪丽等[13]对我国31 个城市共337 560 名0~14 岁儿童家长开展食物过敏问卷调查,结果表明,共有19 676 名儿童患有食物过敏疾病(5.83%),且不同地区食物过敏患病率存在显著差异,华东及东北地区食物过敏发生率最高(分别为7.38%和7.03%),西北地区则最低(4.35%)。Hu Yan等[14]对重庆地区0~1 岁婴幼儿开展了为期10 年(1999—2009年)的食物过敏流行病学调查,发现婴幼儿食物过敏的发病率从3.5%上升至7.7%,主要过敏原为牛奶和鸡蛋。然而由于食物过敏临床症状表现出的轻重程度不同,人们对其认知水平不同,且各个调查采用的方法(问卷调查、临床诊断等)、针对的目标人群(不同年龄)和特定食物(牛奶、花生、鸡蛋等)不同,使得现有的食物过敏流行病学数据存在一定差异,没有统一的标准和结果。但随着中国经济的增长和全球化趋势的增强,未来食物过敏的发病率会大幅度提高,亟需引起高度重视。
2 脂质在食物过敏中的作用
目前,国际脂质分类和命名委员会将脂质分为8 种类型,其中脂肪酸、甘油脂、磷脂、鞘脂和糖脂已被研究证实参与了食物过敏反应[15]。因此,本文重点归纳了近年来文献中报道的多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)、磷脂和甘油脂在食物过敏中的作用。
2.1 多不饱和脂肪酸
Simopoulos[16]研究发现,西方国家食物过敏的发病率升高与其膳食中n-6 PUFAs的过量摄入密切相关。PUFAs主要包括n-6家族(如亚油酸(linoleic acid,LA))和n-3家族(如α-亚麻酸)脂肪酸。这类脂肪酸的特点是不能由机体自身合成,必须从食物中摄取。通常n-6 PUFAs的代谢产物具有促进炎症发生的作用。例如由LA前体合成或从鸡蛋和肉制品摄入的花生四烯酸(C20:4n-6)会在细胞膜磷脂中累积,导致二十烷类化合物含量增加,特别是白三烯和类前列腺素,其一般作为过敏性疾病的临床相关介质,通过其细胞信号效应控制Th2型反应[17]。一些流行病学数据也表明高LA或其他n-6 PUFAs的过多摄入会增加食物过敏的风险。如澳大利亚经常食用人造黄油(高n-6 PUFAs食物)的学龄儿童与不食用人造黄油的学龄儿童相比更易患过敏性皮炎或哮喘[18];而LA摄入量较高的芬兰学龄儿童则较易患支气管哮喘、过敏性鼻炎和过敏性皮炎等疾病[19]。相反,n-3 PUFAs对天然免疫系统的细胞(巨噬细胞和树突状细胞(dendritic cells,DC))具有免疫调节作用,其代谢产物具有消除炎症和改善过敏症状的作用,例如n-3 PUFAs(主要是二十碳五烯酸(C20:5n-3)和二十二碳五烯酸(C22:5n-3))作为底物可与花生四烯酸竞争,从而减少炎症发生,具有抗炎作用[20]。研究表明,怀孕期间母亲经常摄入富含长链n-3 PUFAs的鱼类(如金枪鱼、鲑鱼或沙丁鱼等),其母乳中二十碳五烯酸的比例就会较高,而其婴儿患过敏性疾病的风险较低[21]。此外,由于n-3 PUFAs增强了机体内结肠和脾脏抗炎因子IL-10的分泌,且改变了肠道的微生物菌群,导致喂养富含n-3 PUFAs饮食的小鼠患花生过敏的几率低于喂养富含n-6 PUFAs饮食的小鼠[22]。而n-3 PUFAs衍生的二十烷类化合物含量较低也被认为是高油酸(C18:1)花生致敏性弱的原因[23]。体外研究也表明,与高油酸的相互作用会导致蛋白质聚集,减少IgE与花生和腰果过敏原的结合[24]。食用鱼油对食物过敏症状也有缓解作用,这与肠系膜淋巴结中耐受性CD11b+CD103+DCs的扩张和肠内Foxp3+Treg细胞(调节性T细胞)有关,且二十二碳六烯酸(C22:6n-3)比二十碳五烯酸能更有效地预防IgE和IgG1的产生[25-26]。此外,孟轩夷[27]研究证实了C18不饱和脂肪酸(高油酸、LA、共轭LA、α-亚麻酸和γ-亚麻酸)能够诱导牛乳主要过敏原α-乳白蛋白和β-乳球蛋白的结构发生改变,并促进过敏反应的发生。邢效娟等[28]研究也发现鸡蛋过敏原卵白蛋白可与高油酸通过氢键和疏水相互作用结合,导致卵白蛋白的二级结构变得松散,结构的变化可能会改变过敏原构象性表位,具有降低甚至消除其致敏性的可能性,但目前鲜有结构变化与致敏性关系方面的报道。
综上所述,目前的研究成果表明n-6 PUFAs的过多摄入会增加机体患食物过敏的风险,摄入高水平的n-3 PUFAs则可以降低食物过敏反应的风险。然而,膳食中PUFAs种类繁多(不同长度、不同饱和度、不同构象等),因此PUFAs与食物过敏的关系仍待进一步研究。
2.2 磷脂
磷脂是植物和动物细胞膜的重要组成部分,主要存在于所有食物来源的动植物中,其主要功能是将脂肪酸插入细胞膜中;磷脂(主要是卵磷脂)也可由肝脏合成,通过胆汁运输到近端小肠,以促进机体对胆固醇和其他脂质的吸收;此外,胃黏膜也可以分泌卵磷脂并使其参与胃消化。磷脂不仅对膜的组成、流动性和功能有至关重要的作用,也与过敏性疾病有一定关联。Mackie等[29]研究发现,脂质结合蛋白与磷脂的相互作用对胃肠稳定性和随后的致敏性有重要影响。目前,卵磷脂和磷脂都已被证实可以使某些食物过敏原免受体外胃肠消化的影响,从而对过敏原起到保护作用,例如牛乳α-乳白蛋白、鱼小清蛋白(Sal s 1)和鸡蛋溶菌酶(Gal d 4)[30-32]。然而,也有报道指出,芹菜(Api g 1)、苹果(Mal d 1)、桃子(Pru p1)和榛子(Cor a1)等的过敏原与卵磷脂相互作用后,易于被胃蛋白酶迅速消化,其原因可能为:在低酸性条件下蛋白质本身带负电荷,不能穿透磷脂囊泡,而是通过静电作用松散地与磷脂外表面结合,这种相互作用反而对蛋白酶水解更加敏感[33]。值得注意的是,吸附在油滴上的蛋白质(如被当作乳化剂的蛋白质),其胃消化速率会随着蛋白质在界面上展开的程度而增加[29]。因此,牛乳过敏原β-乳球蛋白作为乳化剂存在时更容易被胃蛋白酶消化[34]。然而,在十二指肠中,胆汁盐会破坏卵磷脂的囊泡结构,将卵磷脂降解成含有胆固醇和脂解产物的胶束,以促进脂质消化和脂肪吸收[35]。进一步的体外消化实验表明,卵磷脂脂解产物加速了肌红蛋白或卵清蛋白的水解,却保护了具有脂质结合位点和/或次级脂质结合位点的β-乳球蛋白或葡萄nsLTPs,后者可能是因为脂解胶束及可溶性游离胆盐降低了蛋白迁移率,使蛋白质水解的灵活性和敏感性降低[36]。此外,牛乳中的鞘磷脂也能够激活自然杀伤T细胞(invariant natural killer T cells,iNKTs),并诱导机体Th2型细胞释放IL-4、IL-5和IL-13,增强其过敏反应[37]。
目前磷脂对食物过敏影响的研究大多停留在其体外胃肠道消化稳定性方面,虽然过敏原胃肠道消化的稳定性与其致敏性密切相关,但在食品加工、运输和储存过程中过敏原与磷脂也可以发生相互作用,此外,体内消化产物如何调节肠道免疫应答,进而引起过敏反应的机制也尚未明确,仍待进一步研究。
2.3 甘油脂
甘油脂又称中性脂肪,是血脂肪的成分之一,在体内小肠上皮细胞将甘油脂(主要是甘油三酯、磷脂、胆固醇和蛋白质)组装成脂蛋白颗粒(乳糜),然后通过淋巴管和体循环输送到机体不同的组织和器官。目前,有关甘油脂对食物过敏影响的研究较少。Wang Yuehui等[38]研究发现,易引起人体致敏的花生或牛奶等食品,多富含长链甘油三酯(n≥12),消化过程中会形成乳糜微粒,促进其肠道吸收和全身扩散,而短链和中链甘油三酯(n<12)恰恰相反。进一步研究发现,中链甘油三酯诱导生成的乳糜微粒促进了小鼠的口服耐受性(机体对特定抗原的免疫无应答),并防止小鼠发生过敏反应,而长链甘油三酯则能明显诱导小鼠发生过敏反应[38]。这可能是因为与通过肠上皮细胞进行的中链甘油三酯辅助吸收不同,长链甘油三酯能够促进过敏原呈递到肠道的派式结(肠黏膜免疫系统的重要组成部分),并有利于过敏原随后转移到肠系膜淋巴结,增加其免疫原性[39]。然而Li Jianing等[40]研究指出,以中链甘油三酯为基础日粮长时间喂养小鼠可刺激其上皮源性Th2型细胞因子(如IL-25、IL-33)和胸腺基质淋巴细胞生成素的表达,并引起自发敏化。此外,联合使用食物蛋白和中链甘油三酯也可以诱导小鼠发生食物过敏,其特点是血清特异性IgE和IgG1水平升高,肠黏膜固有层淋巴细胞Th2、肥大细胞和嗜酸性粒细胞数量增多,以及肥大细胞脱颗粒现象明显[41]。
3 脂质结合食物过敏原的模式
脂质结合是包括过敏原在内的几个蛋白质家族成员共有的特征,如Bet v 1类蛋白、nsLTPs、2S白蛋白、分泌球蛋白、脂钙蛋白、油体蛋白等(表1)[42-51]。其中,Bet v 1类蛋白家族的食物过敏原易受胃蛋白酶消化和热处理的影响,通常只会引起轻微的过敏症状,但家族中花生过敏原Ara h 8与其所含的脂肪酸结合后,不仅显著提高了Ara h 8的热稳定性,还增强了其抗消化性,进一步研究发现,由于花生中PUFAs含量丰富,容易发生脂质氧化并诱导Ara h 8形成新的蛋白质-脂质复合物,会影响其致敏性[42]。苹果过敏原Mal d 1与磷脂酰胆碱的相互作用促进了机体嗜碱性粒细胞活化,增强了其致敏性[43]。脂质运载蛋白β-乳球蛋白(Bos d 5)可以与C8~C18的脂肪酸相结合,主要结合位点为β-乳球蛋白分子结构内部的疏水中心腔,反应驱动力为疏水相互作用力;另一潜在的结合位点在α-螺旋和β-桶状结构的结合界面处[44]。Bossios等[45]发现脂质中的磷脂酰胆碱对β-乳球蛋白的消化起保护作用,导致β-乳球蛋白的致敏性增加。研究发现,nsLTPs具有一个灵活的隧道状亲脂腔,能够结合磷脂、不同饱和脂肪酸、棕榈酰辅酶A等多种脂质,如桃子中的nsLTPs过敏原Pru p 3,与脂质结合后可通过脂质筏和质膜微囊内吞途径作用于Caco-2细胞,导致Th2相关细胞因子的表达量升高[46-48]。2S白蛋白中的巴西坚果过敏原Ber e 1也具有一个与脂质有潜在结合能力的疏水腔,虽然Ber e 1本身不能引起小鼠体内IgE或IgG的产生,但当与富含甾醇或极性脂质组分结合后,便能诱导小鼠发生IgE和IgG1抗体反应,促使T细胞分泌大量IL-4[2,49-50]。油体蛋白(Ara h 10、Ara h 11、Cor a 12、Cor a 13、Ses i 4和Ses i 5等)与脂质结合也可以影响其致敏性,但结合模式和作用机制尚未阐明[51]。巯基蛋白酶类家族中的大豆过敏原Gly m Bd 30K为油体相关过敏原,其可通过二硫键可与大豆球蛋白过敏原Gly m 5形成复合物,并在肠胃中表现出抗消化性,致使Gly m Bd 30K致敏性增强[52-53]。C-溶菌酶家族中的α-乳白蛋白(Bos d 4)与脂质在其Ca2+区域结合,此时脂质会被蛋白质包裹形成胶囊状态,也有研究发现,α-乳白蛋白可以通过疏水作用与脂质在蛋白表面结合,从而对α-乳白蛋白的消化具有保护作用,如磷脂酰胆碱[54-55]。
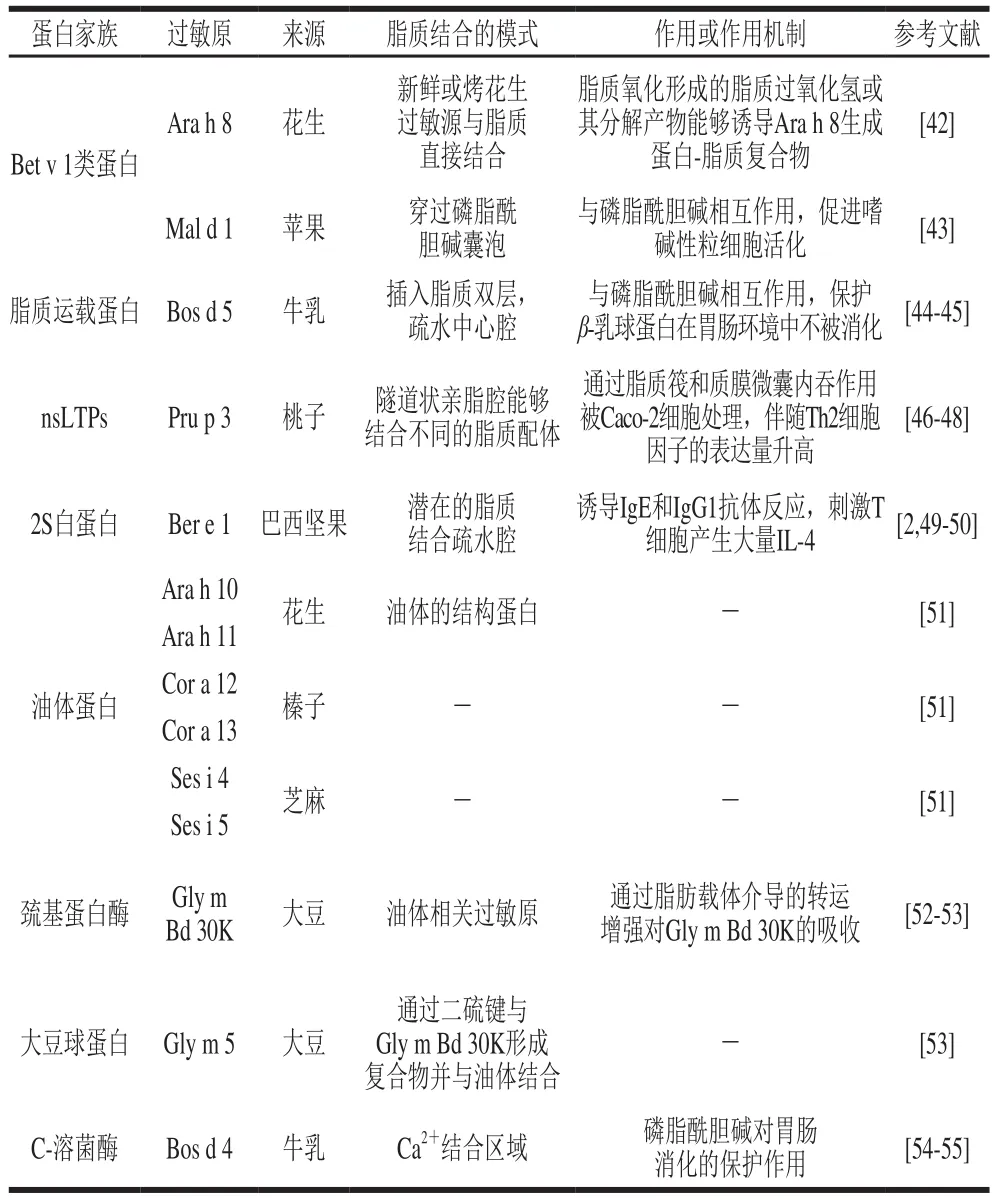
表1 脂质结合食物过敏原的模式Table 1 Patterns of lipid-binding allergens
综上所述,膳食脂质可以作为配体,通过静电相互作用或疏水作用与食物过敏原结合形成过敏原-脂质复合物,然后通过不同的免疫机制影响过敏反应的发生。例如膳食脂质可以促进过敏原通过肠道上皮屏障,或者改变其在胃肠道内的消化速率,或作为佐剂激活先天或适应性免疫从而增强过敏原的致敏性。
4 膳食脂质影响食物过敏的具体途径
食物过敏原与脂质结合后,能干扰肠道上皮细胞的屏障作用,激活DC,促进Th2细胞转化,进而发生过敏反应。这种途径与CD1有关,CD1是一种非经典主要组织相容性复合体I类分子,抗原呈递细胞和上皮细胞表达脂质抗原使其具有免疫原性。iNKTs是一种特殊的T细胞亚群,同时具有自然杀伤细胞和常规T细胞的标记特征[56]。iNKTs的T细胞受体通过CD1d识别DC呈递的脂质(如DC摄取脂质),进而被溶酶体酶加工,插入细胞质CD1d,并运输到质膜,或将脂质抗原负载在细胞表面,继而刺激相关细胞因子的分泌,如γ-干扰素和IL-4[57]。其中,内源性和外源性脂质都可以结合CD1d分子,刺激iNKTs,例如磷脂、鞘磷脂和甘油脂,而iNKTs的T细胞受体也能够识别不同的脂质配体[58]。脂质影响食物过敏的具体途径如图1所示。食物颗粒、脂质结合过敏原首先经过胃肠道的消化分解变为小分子蛋白或多肽,利用与肠道相关淋巴组织中的派式结和孤立淋巴滤泡中的微褶皱细胞等途径跨过肠道屏障(①),并被位于上皮细胞下方或者微褶皱细胞基底表面的DC捕获(②);DC随后向NKT或其他CD1限制性T淋巴细胞呈递捕获的脂质-过敏原复合物,同时释放相关细胞因子(如IL-4)(③),促使淋巴结中的Th0细胞分化为Th2细胞,进而通过人类淋巴细胞抗原II类分子识别肽类过敏原(④),Th2细胞通过IL-3、IL-9促进肥大细胞和嗜碱性粒细胞分泌IL-4进而促进浆细胞的激活(⑤),机体产生特异性IgE抗体,并与肥大细胞所表达的高亲和力FcεRI受体或嗜碱性粒细胞相结合,使机体致敏(⑥)。不同形式存在的脂类,例如附着在载脂蛋白上的脂质(⑦),也能影响过敏原与免疫细胞之间的关系,包括呼吸和肠上皮细胞(⑧)或DC(⑨),但其机制尚不完全清楚(⑩)。
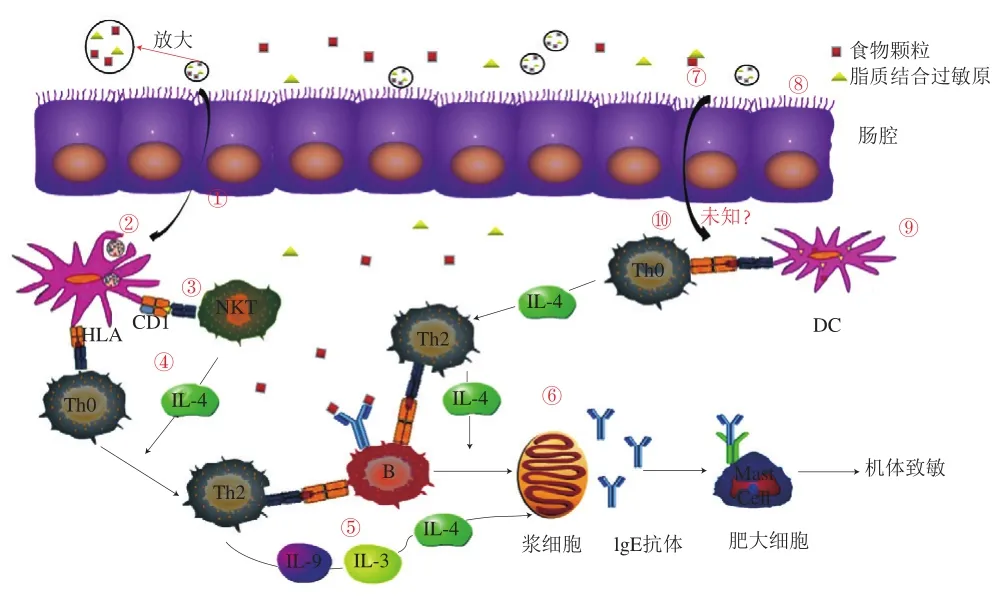
图1 脂质影响食物过敏的具体途径[1]Fig.1 Route through which lipids influence the allergic response[1]
5 高脂饮食对食物过敏的影响
饮食会影响机体肠道屏障的保护功能,而脂质是增强肠道通透性的饮食成分之一。研究表明,高脂饮食会通过降低肠上皮紧密连接的表达来增加肠道通透性,不仅能够提高血浆脂多糖浓度,还能促进过敏原从肠腔进入相关免疫系统,诱导机体发生代谢紊乱,从而引起食物过敏等症状[59]。事实上,肠道通透性增强被认为是促进机体对食物过敏原敏感的一个重要因素,而对食物过敏患者而言,其可能有助于加重接触过敏食物而再次产生过敏反应的症状[60]。机体肠道内稳态紊乱也会导致炎症,使相关细胞因子、自由基和脂质等介质的浓度升高,改变抗原呈递的速率、途径和方式,从而导致食物口服耐受性的失效,引起过敏反应,其原因可能是高脂饮食会改变Toll样受体4的信号,诱导机体产生Th2反应[61]。肠道微生物群是缓解肠道炎症和恢复肠道稳态能力的主要贡献者,也被认为是发展先天和后天免疫反应和诱导食物耐受性的关键因素[62-63]。尽管过敏患者的肠道微生物模式不尽相同,但过敏反应确实会引起某些肠道微生物群发生变化。研究发现,易产生食物过敏症状的小鼠肠道中存在一些特征微生物群,例如产气荚膜杆菌可以刺激和促使Treg细胞抑制Th2反应,避免其产生IL-4和IgE,这一机制涉及肠道微生物区系中的抗原和代谢物,如刺激VA代谢生成短链脂肪酸;此外,产气荚膜杆菌还有利于肠道上皮细胞的完整性,从而调节食物过敏原的肠道通过率[64-66]。
从长远来看,高脂饮食会导致机体脂肪储存和肥胖。然而在过去的30 年,过敏性疾病和肥胖的患病率呈平行上升趋势[67]。Visness等[68]根据问卷调查和总IgE、过敏原特异性IgE水平的测定,在儿童和青少年群体中建立了肥胖与食物过敏(特别是牛奶和虾)的关联性,即在肥胖过敏儿童中,C反应蛋白水平与总IgE水平呈正相关。事实上,肥胖被认为是一种慢性炎症病,其特点是机体内含有较高浓度的炎症细胞因子(IL-6、IL-8、肿瘤坏死因子-α、IL-1β),而这些细胞因子也常见于过敏性疾病中[69]。瘦素是由脂肪组织分泌的脂肪因子,也是IL-6细胞因子家族中的一员,其可以增强机体Th1细胞的分化,使其释放促炎介质,降低Treg细胞的反应性[70-71];此外,瘦素还可通过诱导嗜碱性粒细胞活化、脱颗粒和释放Th2型细胞因子,来促进过敏性疾病的发生[72]。综上所述,高脂饮食易引起人体肥胖,而脂肪组织分泌的IL-6等细胞因子对机体Treg细胞有抑制作用,可能会降低机体对过敏性疾病的防御能力,从而使肥胖患者更易患过敏性疾病。
6 结 语
在食品加工、运输和储存过程中,过敏原与脂类可以发生相互作用,而在机体内,脂类也始终伴随着过敏原的消化吸收。因此,对食物中脂质与过敏原相互作用以及影响其致敏性机制的研究具有重要的价值。目前,对膳食相关脂质在过敏原致敏过程中的作用研究尚处于初步阶段,即过敏原与脂质结合后,干扰肠道上皮细胞的屏障作用,激活DC,促进Th2细胞转化,进而增强过敏反应。研究发现脂质不仅改变了致敏蛋白的免疫刺激特性,也改变了其消化率和肠道吸收能力。但不同类型的脂质对食物过敏的发生机制、过敏原结构的影响以及脂质-过敏原复合物如何调节机体免疫细胞的功能仍待进一步研究。
