牦牛HDAC2基因克隆及其在睾丸中的表达
2021-07-01曲尼拉姆杨柳青袁钰洁
殷 实,王 斌,曲尼拉姆,杨柳青,袁钰洁,李 键,2,3
(1.西南民族大学 青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041; 2.西南民族大学 青藏高原动物遗传资源保护与利用四川省重点实验室,四川 成都 610041; 3.西南民族大学 畜牧兽医学院,四川 成都 610041;4.西南民族大学 现代生物技术国家民委重点实验室,四川 成都 610041)
组蛋白乙酰化是细胞内染色质修饰的一种重要方式,正常情况下细胞内的组蛋白乙酰化平衡由组蛋白去乙酰化酶(Histone deacetylases,HDACs)和组蛋白乙酰基转移酶(Histone acetylases,HATs)共同维持,HDACs能够移除组蛋白赖氨酸上的乙酰化基团,使组蛋白所带的正电荷增加,进而促进其与带负电的DNA分子间的结合变的紧密,使染色质由松弛转变成凝集状态并促使基因沉默[1-2],而HATs则执行相反的过程,由此可见,组蛋白的乙酰化调控对于细胞内基因转录调控以及染色质构象的改变等过程至关重要。
HDACs分为Ⅰ类 (HDAC1、HDAC2、HDAC8)、 Ⅱ类 (HDAC4-7、HDAC9、HDAC10)、 Ⅲ类 (Sirtuins) 及Ⅳ类 (HDAC10)[3]。Histone deacetylases 2 (HDAC2) 属于Ⅰ类HDAC,已有文献报道HDAC2参与了多个重要的生物学过程,例如HDAC2对小鼠的胚胎及神经系统发育至关重要。Hdac2突变的小鼠具有较高的胚胎致死率,存活下来的小鼠体质量、大脑质量及生育力与野生型小鼠相比均明显下降[4-5],而过表达Hdac2则会损害小鼠突触的可塑性及记忆的稳定性[6];HDAC2在肿瘤的发生过程中也扮演着重要角色,在大肠癌及胰腺癌等肿瘤细胞中敲除HDAC2会导致细胞生长停滞并导致细胞凋亡[7-8]。
精子发生的顺利进行是维持雄性动物生殖能力的重要条件,在这一过程中大量基因的表达发生了变化,与此同时,染色体构象以及组蛋白的结构也发生了剧烈变化[9-10]。在小鼠等模式动物中的研究表明,精子发生的过程需要组蛋白去乙酰化的精确调控,例如在雄性小鼠腹腔内注射HDACs抑制剂苯丁酸钠后圆形精细胞形态异常[11];生殖细胞缺失组蛋白去乙酰化酶SIRT1的小鼠无法繁育,其睾丸与正常小鼠相比明显变小,减数分裂进程延迟,且出现大量形状异常的精子[12]。牦牛(Bosgrunniens)是一种主要在我国青藏高原上活动的特有动物,是牧民重要的交通运输工具,也是其重要的经济来源[13]。然而野生牦牛的初次交配成功率不到40%[14],雄性牦牛直到4~5岁才发育至性成熟[15]。 因此,对牦牛的繁殖性能进行研究对于青藏高原人民生活水平的提高和经济的发展具有推动作用。本试验将通过基因克隆的方法获得牦牛的HDAC2基因,对基因的保守性及其编码蛋白的结构和功能进行分析,并检测HDAC2的mRNA在牦牛睾丸中的表达及定位。本研究对后续研究HDAC2在牦牛精子发生中的作用提供了一定的基础数据。
1 材料和方法
1.1 样本收集
采样地点为成都市青白江区屠宰场。依据齿龄将牦牛划分为幼年组(0.5~1岁)、成年组(3~5岁)及老年组(7~9岁)。用无菌剪刀采集断颈剖腹后的成年组牦牛肝脏、肾脏、肺、胃、脾脏、脑、心脏及卵巢组织,并采集各时间段牦牛睾丸组织(n=3)。分离下的组织用无菌剪刀剪成1.0 cm×1.0 cm×0.5 cm大小,立即转移至-80 ℃液氮罐中保存。对于要进行原位杂交的组织,立即放于4%多聚甲醛(无RNA酶)中进行固定。
1.2 主要试剂及仪器
TRIzol(Invitrogen);PrimeScriptTMRT Reagent Kit反转录试剂盒(TaKaRa);Premix TapTMDNA聚合酶(TaKaRa);SYBR®Premix Ex TaqTMⅡ试剂盒(TaKaRa);pMD19-T载体(TaKaRa);DNA胶回收试剂盒(TIANGEN);DEPC H2O(TIANGEN);感受态细胞DH5α(TIANGEN);Real-time PCR Master (ROX)(Roche);CISH试剂盒(上海歌凡生物有限公司);紫外分光光度计(NanoDrop);荧光定量PCR仪(Applied Biosystems)。
1.3 总RNA的提取和反转录
各组织总RNA通过TRIzol进行提取,通过紫外分光光度计测定的260,280 nm 吸光值的比值在1.8~2.0的RNA样品可进行后续试验。反转录体系20 μL:RNA样品1 μL,gDNA Purge 1 μL,NovoScript Plus All-in-one 1st Strand cDNA Synthesis SuperMix 10 μL,RNase Free Water 8 μL。反应条件:50 ℃孵育30 min,75 ℃孵育5 min,反转录产物置于4 ℃冰箱储存。
1.4 基因克隆测序
依据参考GenBank中黄牛HDAC2基因序列(登录号:NM_001075146.1)(表1)设计克隆引物,以牦牛肝脏cDNA为模板,通过普通PCR进行牦牛HDAC2基因的克隆。反应体系如下:2×LA Taq Master Mix 12.5 μL;上、下游引物及模板cDNA各1 μL;ddH2O 9.5 μL。反应条件:95 ℃ 4 min;95 ℃ 30 s,62 ℃ 45 s,72 ℃ 45 s,38个循环;72 ℃ 7 min。将产物与pMD19-T载体在16 ℃条件下连接15 h,之后与感受态细胞混合并在LB液体培养基中培养1 h,离心后将沉淀菌液均匀涂到含有0.1%氨苄的LB固体培养基上,37 ℃培养12 h,挑取白色单菌落接种于液态LB培养基中,摇床振荡培养8 h,随后选阳性菌株交由南京金斯瑞生物科技有限公司测序。
1.5 生物信息学分析
牦牛HDAC2基因及氨基酸序列的预测,以及同源性比对分析由DNAMAN 8软件完成。通过MEGA软件构建系统进化树,通过ProtParam、ProtScale、NetPhos 3.1、PSIPRED、Pfam 以及SWISS MODE分别预测牦牛HDAC2蛋白的基本理化性质和结构。
1.6 荧光定量PCR(Real-time PCR)
牦牛各组织及不同时期睾丸的cDNA为模板,GAPDH为内参基因。PCR反应体系为15 μL:模板cDNA及上、下游引物各1 μL(10 μmol/L),SYBR Premix Ex TaqTM Ⅱ 7.5 μL,ddH2O 5.5 μL。反应条件:95 ℃ 预变性2 min;95 ℃ 变性10 s,60 ℃ 退火30 s,72 ℃延伸 30 s,其中变性、退火和延伸共持续40个循环。每个样本重复3次。
1.7 反转录PCR (Reverse transcription PCR,RT-PCR)
以牦牛不同时期睾丸的cDNA为模板,GAPDH为内参基因。 反应体系:2×LA Taq Master Mix 12.5 μL;上、下游引物各1 μL(10 μmol/L);模板1 μL(800~1 000 ng/μL);ddH2O 9.5 μL。反应条件:95 ℃预变性4 min;95 ℃变性30 s,62 ℃退火45 s,72 ℃延伸45 s,72 ℃ 7 min。其中变性、退火及延伸共持续38个循环。每个样品重复检测3次,引物序列见表1。

表1 PCR引物信息Tab.1 The information about PCR primers
1.8 色素原位杂交(Chromogenicin Situ Hybridization,CISH)
原位杂交的步骤参照CISH试剂盒说明书进行,主要步骤如下:石蜡包埋后的组织切片常规脱蜡至水洗,随后用30% H2O2及纯甲醇按照1∶9的比例配制混合液,室温处理10 min,玻片置于湿盒内,滴加0.25%盐酸,常温孵育15 min;蛋白酶 K 覆盖组织并于37 ℃处理 20 min,0.1 mol/L 甘氨酸洗1 min;4% PFA 固定10 min,分别用乙酸酐(pH值8.0)及5×SSC(Saline Sodium Citrate,柠檬酸钠)(pH值7.5)清洗,预杂交液覆盖组织并于65 ℃预杂交 1 h,用连接了地高辛的探针(500 ng/mL)覆盖切片,65 ℃暗中杂交48 h,封闭液覆盖切片,室温反应30 min;滴加生物素地高辛抗体,37 ℃反应60 min;滴加 SABC(Strept Avidin-Biotin Complex,链霉亲和素-生物素复合物),37 ℃反应20 min;滴加生物素化过氧化物酶,37 ℃反应20 min,DAB(3,3′-diaminobenzidine,二氨基联苯胺)显色,苏木精染核。HDAC2的探针序列:5′-CACAAGCTATTCGTTTGTCTGATGCTCGAATAGAAATTCTCTTGT-3′,一个线虫的非特异性序列探针作为阴性对照(Negative control,NC),其序列为5′-UUGUACUACACAAAAGUACUG-3′。
1.9 统计学分析
采用One-way ANOVA (Tukey′s 多重比较检验)分析数据的显著性差异。结果以平均值标准误形式表示,P>0.05为差异不显著,P<0.05为差异显著。
2 结果与分析
2.1 牦牛HDAC2基因的序列分析及蛋白结构预测
对克隆得到的HDAC2序列进行分析表明,牦牛HDAC2基因的ORF(Open reading frame,开放阅读框)一共为1 467 bp,编码488个氨基酸(图1),序列的同源性分析结果表明,其与黄牛(Bostaurus)和野牛(Bisonbison)的基因及氨基酸序列相似度最高,均为100%,与马(Equuscaballus)、野猪(Susscrofa)、白鳍豚(Lipotesvexillifer)、羊驼(Vicugnapacos)和人(Homosapiens)中HDAC2的序列相似度也均在90%以上 (表2、图2)。
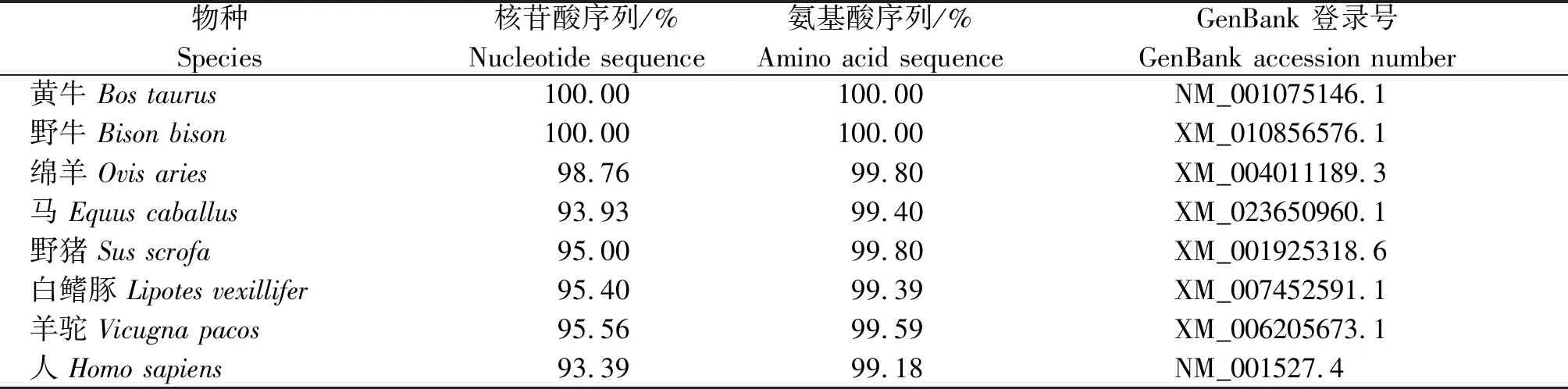
表2 牦牛与部分物种HDAC2核苷酸及氨基酸的序列同源性比对Tab.2 Alignment of HDAC2 nucleotide and amino acid sequences between yak and some species
氨基酸组成分析表明,HDAC2 蛋白由20种氨基酸构成,其中所占比例最高的为甘氨酸(Gly,9.0%)、赖氨酸(Lys,8.2%)、天冬氨酸(Asp,8.0%)及谷氨酸(Glu,8.0%)(表3)。在所有氨基酸中,带正电荷的氨基酸(Arg+Lys)有63个,带负电荷的氨基酸(Asp+Glu)有78个,由此可得,HDAC2蛋白整体上带负电。HDAC2的最大疏水性指数为2.967,最小疏水性指数为-3.367,分别位于第161及454位氨基酸,其平均亲水指数为-0.713(图3),由此表明,HDAC2具有疏水脂溶性蛋白的特点。蛋白修饰位点分析表明,牦牛HDAC2 蛋白中一共含有50个磷酸化修饰位点,其中丝氨酸、酪氨酸和苏氨酸磷酸化位点分别为21,14,15个(图4)。牦牛HDAC2蛋白二级结构主要由α-螺旋、β-转角及无规卷曲构成,其比例分别占38.73%,9.22%,52.05%,同时该蛋白不含有跨膜结构及信号肽(图5-A)。保守结构域预测结果表明,HDAC2含有一个组蛋白去乙酰化酶结构域(图5-B),HDAC2蛋白的三级结构预测的结果与二级结构相吻合(图5-C)。
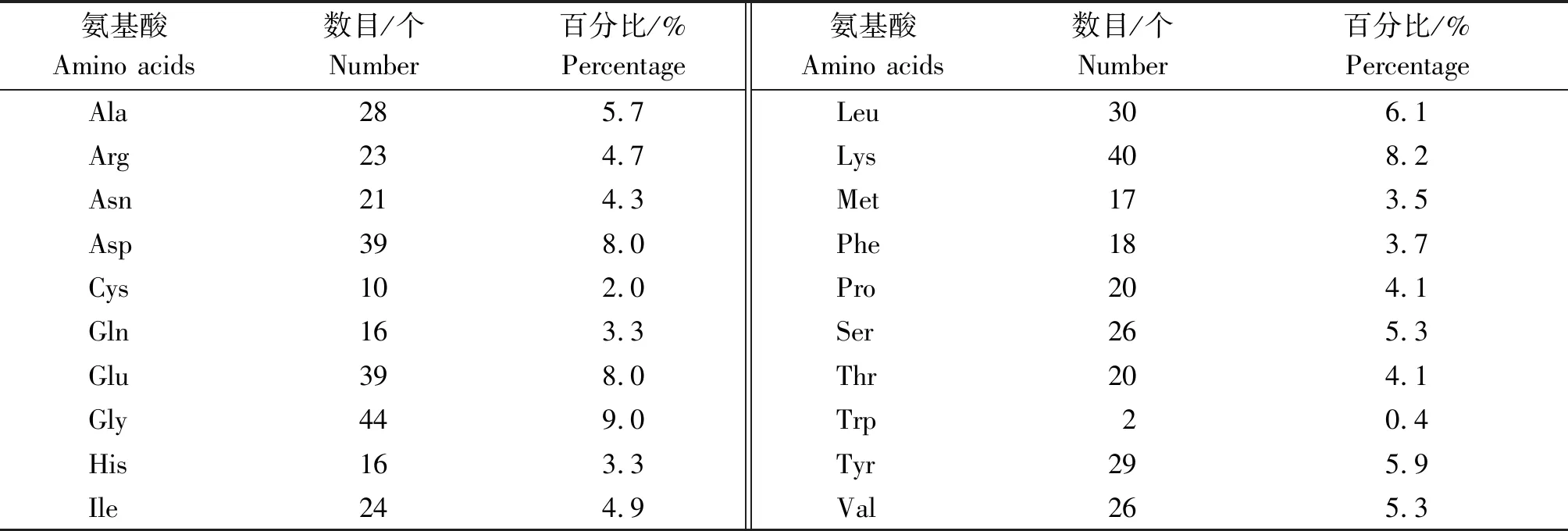
表3 牦牛HDAC2蛋白氨基酸组成Tab.3 The amino acids composition of yak HDAC2 protein
2.2 牦牛HDAC2 mRNA在各组织中的表达情况
实时荧光定量PCR的结果表明,在所检测的9个牦牛组织中均发现有HDAC2mRNA的表达,其中在卵巢和睾丸中表达显著高于其他组织,在脑、心脏和脾脏中的表达次之,在胃、肺、肾脏及肝中表达显著低于其他组织(图6)。
2.3 HDAC2在牦牛不同发育时期睾丸中的表达和定位
利用RT-PCR检测了HDAC2在不同发育阶段(幼年期、成年期及老年期)睾丸中的表达,结果表明,HDAC2在幼年期牦牛睾丸中的表达量最高,在成年期及老年期表达量较低(图7)。原位杂交结果表明,HDAC2mRNA 在牦牛睾丸的非生殖类细胞支持细胞及睾丸间质细胞的胞质和胞核中均有所表达,在生殖类的精原细胞及精母细胞中也发现了HDAC2的表达。然而HDAC2不在精细胞中表达(图8)。
3 讨论与结论
HDAC2所属的组蛋白去乙酰化酶家族是一类影响细胞内组蛋白乙酰化水平的重要酶类[2,16],已有报道HDAC2参与了人和小鼠等模式动物的胚胎发育、神经系统发育及肿瘤生成等生物学过程[4-8],然而有关牦牛HDAC2的信息知之甚少。本研究克隆了牦牛HDAC2的CDS序列,并分析了该序列的保守型及其编码蛋白的结构,同时检测了HDAC2的mRNA在牦牛睾丸中的表达及定位。
生物信息学的分析结果表明,牦牛HDAC2基因序列的保守性较高。HDAC2蛋白结构域的预测刚好证实了这一点。在牦牛HDAC2蛋白中发现了一个保守的组蛋白去乙酰化酶催化结构域,该结构域广泛存在于Ⅰ型去乙酰化酶的不同成员中,通过与锌离子结合催化赖氨酸进行去乙酰化[17-19]。此外,牦牛HDAC2的蛋白结构中含有多个潜在的磷酸化修饰位点,暗示该蛋白可能受到磷酸化调控。已有研究表明,HDAC2的磷酸化参与了多个重要的生物学过程,例如在大鼠中热休克蛋白70(Heat Shock Protein 70,HSP70)能够通过磷酸化HDAC2导致心肌肥大[20],在小鼠中HDAC2 能够通过其第394位丝氨酸的磷酸化与叉头转录因子O亚型3a(Forkhead box O3,FOXO3A)形成复合体,在氧化应激诱导的小鼠小脑颗粒神经元凋亡中发挥重要作用[21]。本研究预测的牦牛HDAC2蛋白结构、保守结构域及转录后修饰位点为后续进一步研究牦牛HDAC2的功能提供了一定的研究基础。
在不同组织中的表达检测表明,HDAC2的转录本在卵巢中的水平较高,提示HDAC2可能参与了牦牛卵巢发育的调控。研究表明,在小鼠的卵母细胞中敲除Hdac2会导致卵母细胞的着丝粒出现异常,导致其无法完成减数分裂并进而引起小鼠不孕等[22];在家猫卵母细胞成熟过程中HDAC2会从细胞核的核质向核仁转移,这一过程对于GV期卵母细胞转录水平的沉默及卵子的成熟是必需的[23]。而HDAC2是否参与牦牛卵母细胞的成熟依然有待进一步研究。
HDAC2 的转录本在牦牛睾丸的除精细胞和精子之外的各类细胞中均有表达,这与小鼠睾丸中HDAC2的表达分布类似[24]。研究表明:精母细胞向精子转变的过程中组蛋白需要被鱼精蛋白所替代,这一过程需要核心组蛋白H3及H4 多个赖氨酸位点的高度乙酰化[25]。推测精细胞中缺少HDAC2很可能是为了保证组蛋白H3及H4 高度乙酰化的进行,进而保证组蛋白能够被顺利的替换。HDAC2蛋白在牦牛睾丸中的表达随年龄的增长不断降低,推测这可能与不同阶段睾丸本身的细胞组成有关,幼年期的牦牛睾丸中以精原干细胞和精原细胞为主,缺少成熟的精细胞,而随着个体年龄的增加,精细胞所占比例持续增加[26],因此,成年期中HDAC2mRNA水平的下调很可能是由于该阶段睾丸中精细胞比例的增高所致;而在老年期牦牛睾丸中各类生精细胞的数量急剧下降[27],这可能是导致该阶段HDAC2表达下降的一个重要原因。
牦牛HDAC2基因的开放阅读框包含1 467个碱基,编码488个氨基酸。牦牛HDAC2基因在哺乳动物中高度保守,预测的牦牛HDAC2蛋白是一个疏水脂溶性蛋白,包含一个组蛋白去乙酰化酶结构域和多个磷酸化位点,在幼年期睾丸组织中牦牛HDAC2mRNA的表达较高,其定位除精细胞之外的各类睾丸细胞中。本研究对于未来深入探讨HDAC2对牦牛雄性生殖系统发育的调控机制提供了一定的参考数据。
