脱落酸对水稻种子萌发期耐高温胁迫的诱抗效应
2021-07-01杨雲雲陈启洲杨洪涛苏佩佩刘晓龙
杨雲雲,陈 鑫,陈启洲,卢 芳,徐 晨,杨洪涛,苏佩佩,刘晓龙
(1.宜春学院 生命科学与资源环境学院,江西 宜春 336000;2.吉林省农业科学院 农业资源与环境研究所,吉林 长春 130033)
长江中下游地区是我国重要的水稻主产区,近年来,由于气候变暖导致的夏季极端高温天气时有发生,最高温度超过35 ℃的天气持续10~15 d。高温胁迫已对当地的水稻生产造成严重影响,并已成为制约当地水稻种植业发展的主要限制因素之一。高温胁迫会对不同生育时期的水稻生长造成影响,在种子萌发期遭遇超过35 ℃的高温胁迫会导致种子发芽迟缓、种子丧失活力、发芽率下降[1]。水稻在幼苗阶段遭受高温胁迫不仅会出现叶片卷曲,含水量降低,叶片颜色变浅、变白、变短和畸形等症状,还会致使植株生长发育缓慢、抑制根系生长[2-3],光合作用受阻,净光合速率和气孔导度降低,光合作用原初反应受到抑制[4-5]。水稻孕穗期遭遇高温胁迫会导致颖花退化、花粉败育、花粉活力下降,进而导致秕粒增加[6-7];在抽穗期和灌浆期遭受高温胁迫会阻碍水稻的开花授粉,穗中秕粒增多、结实率下降,造成千粒质量降低,进而导致水稻减产[8-11]。研究表明,水稻幼苗在碱胁迫环境下,根系活性氧大量积累,破坏了抗氧化防御系统,进而损伤根系细胞,导致幼苗萎蔫和死亡[12]。高温胁迫与碱胁迫类似,其抑制水稻生长发育的一个重要因素就是引起ROS过量积累,破坏ROS产生和清除的平衡体系,导致膜质过氧化作用加剧,进而损坏细胞结构[3,13-14]。高温胁迫抑制水稻种子萌发,但其导致发芽率下降的主要原因尚不明确,本研究拟以ROS积累为线索探究高温胁迫抑制水稻种子萌发的机制。
脱落酸(ABA)是植物体内的重要激素,常作为胁迫激素参与植物对多种逆境胁迫的响应,并发挥重要作用[15]。产生诱抗效应是ABA提高植物抗逆性的一个重要机制[16]。ABA对水稻耐盐碱胁迫产生诱抗效应,能够提高水稻对碱胁迫的抗性和苏打盐碱水田中的产量[17-18]。ABA在提高植物耐高温胁迫中同样具有促进作用,高温处理可降低植物体内IAA、GA、自由脯氨酸及可溶性蛋白质的含量,增加脱落酸含量[19]。抽穗期喷施S-诱抗素或ABA溶液能够提高水稻的结实率和千粒质量,稻米的碾磨品质和蒸煮品质也得到改良[20]。研究表明,外源ABA能够通过增加蔗糖的转运和加速蔗糖代谢来保持碳平衡和能量平衡,进而阻止花粉败育[21]。以上研究结果为ABA提高水稻耐高温特性的效果提供了坚实的科学依据,但目前对于其内在的生理机制及分子机理解析尚不明晰,尤其在ROS相关通路中的报道并不多见。研究表明,ABA预处理能够提高碱胁迫下水稻幼苗的下游抗氧化防御能力,抑制ROS过量积累;且ABA缓解了外源二氯百草枯(Paraquat)对水稻幼苗引发的氧化胁迫,这是ABA诱导水稻耐碱胁迫的主要途径之一[22]。基于以上研究结果,本研究以高温为主要非生物胁迫因子,探究ABA对水稻耐高温胁迫的诱抗效应,以ABA浸种的方式在水稻种子萌发期进行研究,并以ROS积累为出发点初步解析高温环境下ABA对水稻种子萌发的影响机理。
1 材料和方法
1.1 供试材料
以江西省主推常规水稻品种黄华占和日本晴为试验材料。
1.2 试验设计
1.2.1 ABA溶液的配制 脱落酸(ABA:Sigma,Inc.,St,Louis,MO,USA)试剂先溶于少量的无水乙醇中,然后用去离子水定容至一定的浓度。本试验用外源ABA浸种的方式探究ABA对水稻种子萌发的诱抗效应,参照前人研究结果,选用10 μmol/L作为试验用ABA浓度[17-18,22]。
1.2.2 试验设计 萌发试验在培养皿中进行,设置2个处理,即非ABA处理组(-ABA)和ABA处理组(+ABA),每个处理5次重复。每个重复选取饱满一致的50粒种子,ABA处理组用10 μmol/L的ABA溶液于黑暗条件下浸种24 h,非ABA处理组用去离子水于黑暗条件下浸种24 h。
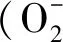
1.3 各项指标的测定方法
1.3.1 相对电导率和丙二醛含量的测定 相对电导率(Relative conductivity,RC)常用来评价细胞膜的损伤程度。用煮沸前和煮沸后的电导率(R1和R2分别表示煮沸前后溶液的电导率)来计算,公式为:RC(%)=R1/R2×100%。丙二醛(Malondialdehyde,MDA)含量采用硫代巴比妥酸显色法测定,采用公式6.45×(A532-A600)-0.56×A450计算各样品的MDA浓度,再根据样品质量计算MDA含量。
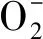
过氧化氢含量的测定:植物中的H2O2与硫酸钛(或氯化钛)反应生成黄色的过氧化物-钛复合物沉淀,在H2SO4中进行溶解,在415 nm处有特征吸收峰,用分光光度计比色可测定H2O2含量[25]。
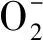
1.3.3 萌发相关基因的表达分析 利用TRIzol法提取水稻幼芽总RNA,并测定RNA浓度,用M-MLV反转录酶(TaKaRaBioInc.,Otsu,Japan)进行反转录,形成cDNA。在实时荧光定量PCR仪(Eco TM 48,Illumina,Saffron Walden,UK)上进行qRT-PCR反应(Quantitative real-time PCR),总反应体系为20 μL,包括:10 μL 2×SYBRPremixExTaqTM(TaKaRa Bio),1.6 μL cDNA,0.8 μL引物和7.6 μL ddH2O。qRT-PCR反应程序为:95 ℃ 5 min;95 ℃ 5 s,60 ℃ 30 s,30个循环;95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s。确定cDNA模板和引物没有基因组DNA污染后,以稳定表达的水稻看家基因β-actin作为内参,进行基因表达量的测定。每个处理设置3次生物学重复,每个模板2次技术重复,利用2-ΔΔCT的方法计算基因的相对表达量[26]。
ROS清除相关基因包括:OsCATB、OsAPX6、OsFe-SOD和OsCu/Zn-SOD;细胞死亡相关基因包括:OsBI1和OsKOD1;ABA应答基因有Salt和OsWsi18[12,22],用于qRT-PCR的基因及相关引物(5′-3′)如下:
OsACT1(内参,Os03g0718100)F:TTCCAGCCTT
CCTTCATA,R:AACGATGTTGCCATATAGAT;
OsBI1(Os02g0125300)F:CTACATCAAGCACGC
ACTC,R:ACCTCTTCTTCCTCTTCTTCTC;
OsKOD1(Os04g0507950)F:TCAAGCCATTCATC
TTCCAT,R:ATCAGCAACCTCGTCAAG;
Salt(Os01t0348900)F:CGAAATAATGTTCCATG
GTGTT,R:TGTACTACGGATCGGTGCAA;
OsWsi18(Os01g0705200)F:TGTGACTCGATCCA
GCGTAG,R:GTTCCTGCTGAGAAGCCATC;
OsCATB(Os06g0727200)F:GCTGGTGAGAGATACC
GGTCA,R:TCAACCCACCGCTGGAGA;
OsAPX6(Os12g0178100)F:CCCCAAGATCCCCA
TGATCTA,R:CCTCTGGCGGGCATTG;
OsFe-SOD(Os06g0143000)F:CGACGCCGAGGAAT
TTCTAG,R:AGGTGGTGTAAGTGTCTCTCATGC;
OsCu/Zn-SOD(Os06g0130900)F:TGTGACGGGA
CTTACTCCTGG,R:CACCCATTCGTAGTATCGCCA。
1.4 数据处理与分析
采用Excel 2013软件进行数据统计,数据绘图应用Origin 9.1绘图软件。利用SPSS 21.0(IBM Corp.,Armonk,NY)软件,基于单因素方差分析(ANOVA)和Duncan方法进行数据的显著性差异分析,显著性差异水平为P<0.05。
2 结果与分析
2.1 ABA浸种预处理对高温胁迫下水稻种子萌发的影响
不同处理下,种子萌发试验结果如图1所示。非高温处理下,ABA浸种与否对种子萌发无明显影响。高温胁迫抑制了日本晴和黄华占的种子萌发,导致芽长和根长缩短。而ABA浸种能够促进高温胁迫下水稻种子的萌发和幼芽的生长。
发芽率统计试验结果表明(图2),ABA浸种在高温胁迫初期促进了水稻种子的萌发。非ABA浸种条件下,与CK-ABA相比,高温处理使日本晴在第2天和第3天的发芽率分别提高了11.60,7.60百分点,使黄华占在第2天,第3天的发芽率分别提高了14.00,4.00百分点。ABA浸种条件下,与CK+ABA相比,高温处理使日本晴在第2天,第3天的发芽率分别提高了7.60,9.20百分点,使黄华占在第2天,第3天的发芽率分别提高了14.40,6.80百分点。随着萌发时间的延长,不管ABA浸种与否,高温胁迫均抑制了水稻种子的萌发。在萌发的第7天,高温胁迫使ABA浸种和非ABA浸种的日本晴发芽率分别下降了12.00,22.80百分点,黄华占分别下降了10.40,20.00百分点。
对照条件下,ABA浸种的种子发芽率略低于非ABA浸种。而高温胁迫下,ABA浸种对水稻种子的萌发起到了一定的促进作用,且胁迫时间越长,促进作用越明显。从萌发的第5 天开始,高温胁迫条件下,ABA浸种提高了2个水稻品种的发芽率;在萌发的第6天,ABA浸种使日本晴和黄华占的发芽率分别提高了4.40,6.80百分点;第7天,ABA浸种使日本晴和黄华占的发芽率分别提高7.60,8.00百分点。
ABA浸种促进了水稻芽和根的生长。试验结果表明(图3),对照条件下,ABA浸种对水稻幼芽和根的生长略有促进作用,ABA浸种显著提高了黄华占的主根长(P<0.05)。高温胁迫下,ABA浸种显著提高了水稻的芽长和主根长(P<0.05),黄华占的芽长增加更明显。高温胁迫下,ABA浸种使日本晴和黄华占的芽长分别提高了21.96%,38.92%;主根长分别提高了48.00%,63.82%。
2.2 ABA浸种对高温胁迫下水稻幼芽ROS积累的影响
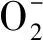
研究表明,外源ABA预处理显著上调了多个ROS清除基因的表达,提升抗氧化酶活性,进而抑制ROS过量积累来提高水稻幼苗的耐碱性。在这些ROS清除基因中上调幅度较大的有OsCATB、OsAPX6、OsFe-SOD、OsCu/Zn-SOD,分别为过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和超氧化物歧化酶(SOD)的主要调控基因[22]。本试验继续分析高温胁迫下ABA浸种对以上4个ROS清除基因表达的影响。结果表明(图5),高温胁迫下,ABA浸种显著上调了4个ROS清除基因的表达(P<0.05),且OsFe-SOD和OsCu/Zn-SOD的上调幅度更大,暗示着ABA浸种提高了抗氧化酶CAT、APX和SOD的活性以清除过多的ROS。
2.3 ABA浸种对高温胁迫下水稻幼芽细胞死亡的影响
研究表明,逆境胁迫下ROS的过量积累是导致水稻细胞损伤和幼苗萎蔫的主要原因[12],本试验进一步对高温胁迫下水稻幼芽的细胞损伤状况进行测定。由图6可知,高温胁迫条件下,ABA浸种处理使幼芽中细胞死亡抑制基因OsBI1的表达量显著上调(P<0.05),而细胞死亡基因OsKOD1表达下调,进而降低了高温胁迫导致的细胞过量死亡。高温胁迫下,与非ABA浸种处理相比,ABA浸种使2个品种OsBI1的上调幅度分别为182.0%,156.0%,而细胞死亡基因OsKOD1则分别下调了33.5%,51.3%。
2.4 高温胁迫下水稻种子萌发与幼芽生理指标的相关性分析
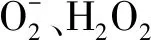
2.5 高温胁迫下水稻幼芽ABA应答基因表达量的变化
进一步分析了2个ABA应答基因的表达变化,结果如图7所示。高温胁迫下,ABA浸种处理下水稻幼芽内ABA应答基因显著(P<0.05)上调,说明ABA浸种激活了水稻内的ABA信号通路,使之在抵抗高温胁迫中发挥作用。高温胁迫下,与非ABA浸种处理相比,ABA浸种使日本晴和黄华占幼芽内Salt基因相对表达量分别提高了4.84,5.46倍(图7-A),OsWsi18分别提高了5.87,7.06倍(图7-B)。

表1 高温胁迫下非ABA浸种处理下水稻种子萌发进程中各指标的相关性分析Tab.1 Correlation analysis of various indexes in rice seed germination process of non-ABA soaking treatment under high temperature stress condition

表2 高温胁迫下ABA浸种处理下水稻种子萌发进程中各指标的相关性分析Tab.2 Correlation analysis of various indexes in rice seed germination process of ABA soaking treatment under high temperature stress condition
3 讨论与结论
良好的种子萌发率是植物适应环境的先决条件。一般来说,水稻在种子萌发期对高温胁迫具有较强的抵抗力,这是因为诱导了种子中小热激蛋白的表达,进而能够帮助种子抵御高温;但超过35 ℃时水稻种子的萌发受阻,种子丧失活力,发芽率降低[27]。本研究结果表明,在萌发初期(前3 d),水稻种子在30 ℃的环境和40 ℃的高温环境下均能够正常萌发,且高温处理对种子萌发具有促进作用,发芽率略高于对照处理,这可能是由于种子经24 h浸泡后,含水量增加,能够在短期内抵抗高温的缘故,这与前人研究结果基本一致[28]。在萌发初期,对照条件和高温胁迫下,ABA浸种对种子萌发有抑制作用,2个品种的发芽率略低于非ABA浸种处理。随着萌发进程的推进,不管ABA浸种与否,与对照相比,高温胁迫均抑制了水稻种子的萌发;在萌发的第7 天,2个品种的发芽率在高温处理下较对照均有不同程度的下降,且芽长和主根长显著(P<0.05)低于对照处理,这与多数研究结果基本一致[29-31]。不管ABA浸种与否,在对照条件下,品种黄华占的芽长和主根长高于日本晴;且在高温胁迫下的芽长和主根长的下降幅度以及幼芽内ROS积累和质膜损伤程度均低于日本晴,说明黄华占在种子萌发期对高温的抗性略高于日本晴。
ABA不仅参与调控植物的多种生长发育进程,且在植物应对盐、碱、低温和高温等非生物胁迫和多种生物胁迫中发挥重要作用[15,32]。ABA调控植物抗逆性的一种重要机制就是产生诱抗效应,通过浸种和浸根等多种方式赋予植物抵抗逆境的潜在能力[18,22-33]。研究表明,水稻种子或幼苗经ABA预处理后能够提高盐胁迫下幼苗的生长发育和最终产量[34-35];水稻幼苗经外源ABA浸根预处理后,能够提高抗氧化清除能力,抑制ROS的过量积累,进而提高对碱胁迫的抗性和苏打盐碱水田中的产量[17-18,22]。在高温胁迫下,外源ABA能够通过多种途径缓解高温胁迫对水稻的伤害,包括调控能量平衡、ROS积累和糖代谢等途径,促进水稻生长发育和产量形成[2,21,36]。本试验结果表明,种子萌发初期,在对照和高温处理下,外源ABA浸种较非ABA浸种在一定程度上抑制了种子的萌发。在长期高温胁迫下,外源ABA浸种加快了水稻种子的萌发速度,促进了幼芽和幼根的生长,缓解了长期极端高温胁迫对水稻种子幼芽生长的抑制作用。对其内在机制进一步研究发现,高温胁迫下,ABA浸种显著(P<0.05)上调了ABA应答基因Salt和OsWsi18的表达量,说明ABA信号途径被激活,进一步提升了高温胁迫下水稻幼芽抗氧化清除基因的转录表达,降低ROS的含量,进而缓解了水稻幼芽的质膜损伤和细胞过量死亡,促进幼芽的生长。
综上所述,本研究探究了高温胁迫下ABA浸种对水稻种子萌发的影响,进一步验证了外源ABA对水稻抗逆性的诱抗效应。水稻种子在萌发初期,高温处理能够短暂的促进种子萌发;此后,高温处理导致幼芽内ROS过量积累,并进一步导致细胞损伤,进而抑制了幼芽的生长。种子在萌发前利用外源ABA浸种能够起到提高抗氧化清除能力的作用,降低由极端高温胁迫而引起的ROS过量积累,从而缓解细胞损伤,促进高温胁迫下水稻幼芽及幼根的生长。
