基于CRISPR/Cas9技术的水稻OsARF12突变体的构建
2021-07-01杜想想赵亚帆赵晨云赵帅兵赵全志杜彦修孙红正孙虎威
杜想想,赵亚帆,赵晨云,赵帅兵,李 源,程 远,赵全志,杜彦修,孙红正,孙虎威,彭 廷
(河南粮食作物协同创新中心,河南省水稻生物学重点实验室,河南农业大学,河南 郑州 450046)
生长素作为最早发现的一类植物激素,参与调控植物多种生长发育过程,如根的发育[1]、顶端优势、向性反应和形态建成[2]等。生长素调控通路中关键蛋白主要包括生长素/吲哚乙酸蛋白(Aux/IAAs)、SCF复合系统和生长素响应因子(ARFs)[3]。生长素响应因子是能与生长素应答元件(AuxRE)TGTCTC序列特异结合,调节生长素反应基因的一类转录因子,最先在模式植物拟南芥中被鉴定出来[4],该家族共有23个基因[5]。其中ARF1/ARF2功能的缺失通过增加拟南芥中Aux/IAA基因的转录进而调控叶片衰老和开花时间[6];ARF3/ARF4主要调控侧生器官的结构发育[7],ARF3直接与细胞分裂素基因AtIPT5启动子结合,负调控AtIPT5的表达,介导生长素与细胞分裂素相互作用,影响新生芽的再生[8];ARF5通过调控AMP1的表达影响胚和维管组织的形成[9];arf6、arf8突变体雄蕊发育迟缓,而arf6/arf8双突变体则不能形成成熟的花,表明ARF6、ARF8共同参与花的形态建成[10],同时,ARF8还负调控果实的起始发育[11];ARF7/ARF19可直接激活下游基因LBD/ASLs的表达来影响侧根形成[12];ARF10/ARF16则是在miR160下游调控根冠发育及根的向地性[13]。
单子叶植物水稻ARF家族中有25个成员[14]。OsARF1是水稻中第一个被发现的ARF基因[15],它与胚芽鞘的向性有关;之后的研究表明,OsARF1对营养生长和种子发育至关重要[16];OsARF4能与OsGSK41/OsGSK互作且被后者磷酸化,调控水稻籽粒大小及千粒质量[17];OsARF16参与细胞分裂素介导的水稻磷酸盐转运和信号传递通路,且敲除株系对外源细胞分裂素不响应[18]。OsARF17和OsARF19通过调节生长素和BR信号来控制水稻叶夹角大小[19-20]。然而,目前对水稻ARF家族的研究大多集中在籽粒发育和叶夹角等方面,ARFs其他成员对水稻农艺性状的影响尚不明确。
CRISPR/Cas9是第3代基因编辑技术,相比其他编辑技术具有成本低、快速高效等优点,已经成为目前最主流的基因编辑系统[21]。近年来,大量研究人员通过CRISPR/Cas9技术对水稻基因编辑,研究水稻基因的功能,也取得了重要进展[22]。本研究利用CRISPR/Cas9系统对水稻生长素响应因子OsARF12第1个和第2个外显子靶位点进行编辑,独立转化粳稻品种日本晴,通过对2个外显子不同突变位点的KO-ARF12-1和KO-ARF12-2突变体进行测序、表达量鉴定、表型性状调查,研究OsARF12对水稻农艺性状的影响。
1 材料和方法
1.1 试验材料
转基因受体材料为:粳稻品种日本晴(Oryzasativaspp.japonicacv. Nipponbare)。CRISPR/Cas9载体为:pOs-gRNA、pH-Ubi-CAS9。试验所需引物(表1)合成与测序分析均由上海生工生物工程股份有限公司完成。

表1 试验所用引物Tab.1 Primers used in this test
1.2 试验方法
1.2.1OsARF12靶位点设计和表达载体构建 根据CRISPR/Cas9原理,在RAP-DB网站(https://rapdb.dna.affrc.go.jp/)上获取水稻OsARF12外显子序列,分别选取第1个外显子PAM序列(CGG)前20 bp(5′-GAACGATGCGTACCTTCCCG-3′)及第2个外显子PAM序列(GGG)前20 bp(5′-TTCACACCCGGATATCGGTT-3′)为靶位点(图1)。分别在2个靶位点5′端前加上BsaⅠ限制性内切酶的黏性末端接头GGCG,即为ARF12Crispr1_F、ARF12Crispr2_F(表1);将选取的2个靶序列分别反向互补并在其5′端前加上BsaⅠ限制性内切酶的黏性末端接头AAAC,即为ARF12Crispr1_R、ARF12Crispr2_R(表1)。将2对加过接头的序列送往上海生工生物工程股份有限公司合成后,经磷酸化修饰和退火形成双链,用T4DNA连接酶与经过限制性内切酶BsaⅠ酶切过后的中间载体sgRNA连接,转化大肠杆菌感受态DH5α,随后进行菌落PCR检测与测序,并用阳性质粒与Cas9终载体进行LR重组,转化DH5α,经菌落PCR和测序检测,将阳性质粒转化农杆菌EHA105。利用农杆菌介导法导入粳稻品种日本晴,获得转基因植株。
1.2.2 植株DNA和总RNA的提取 在野生型和各转基因植株抽穗前取叶片样品,并立即置于液氮中,-80 ℃冰箱保存。采用CTAB法提取叶片DNA;TRIzol法提取总RNA。
1.2.3 反转录 使用天根生化科技有限公司FastKing RT Kit(KR118-02)反转录试剂盒将1 μg总RNA反转录成cDNA。
1.2.4OsARF12表达量分析 将cDNA稀释10倍,使用天根生化科技有限公司定量检测试剂盒SYBR Green(FP209),Actin基因作为内参,采用Bio-Rad CFX96荧光定量PCR仪进行实时荧光定量PCR分析。相对表达量采用2-ΔΔCt法计算。
1.2.5 数据分析 采用Microsoft Excel 2016对试验数据进行整理和作图,利用SPSS 24进行差异显著性分析。
2 结果与分析
2.1 KO-ARF12-1/-2 T0突变体鉴定
将携带CRISPR/Cas9-ARF12-1和CRISPR/Cas9-ARF12-2质粒的农杆菌侵染水稻品种日本晴,得到KO-ARF12-1 T0再生苗5株,KO-ARF12-2 T0再生苗15株。利用CTAB法提取各单株叶片的DNA,并根据OsARF12的序列分别设计2个不同靶位点引物:CrisprARF12-1_F、CrisprARF12-1_R和CrisprARF12-2_F、CrisprARF12-2_R(表1),用对应的引物对转基因植株的DNA进行扩增(图2),并将扩增产物送往公司测序。通过对T0测序结果比对发现:KO-ARF12-1-1为1条链缺失1 nt、互补链缺失7 nt的双等位突变体;KO-ARF12-1-2和KO-ARF12-1-3为1条链缺失4 nt、互补链缺失7 nt的双等位突变体,KO-ARF12-1-4和KO-ARF12-1-5 2条链均未突变(表2)。
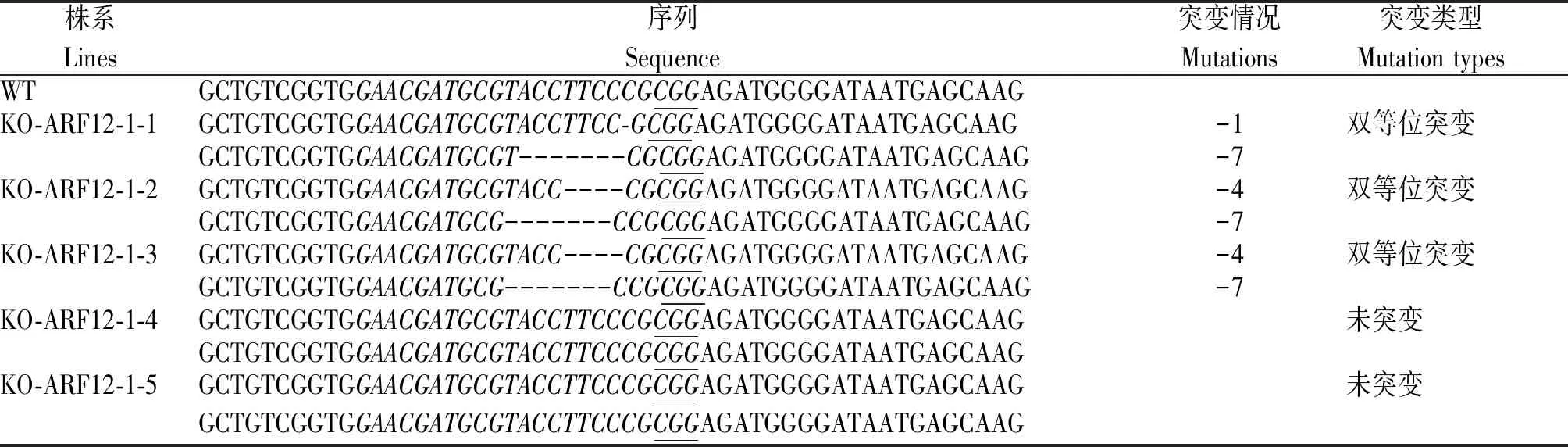
表2 KO-ARF12-1 T0转基因植株突变类型鉴定Tab.2 Identification of mutation types of KO-ARF12-1 T0 transgenic plants
KO-ARF12-2各转基因植株共有11种突变类型:KO-ARF12-2-12和KO-ARF12-2-15为2条链分别缺失了6 nt与5 nt的纯合突变体;KO-ARF12-2-5为1条链缺失2 nt,KO-ARF12-2-8为1条链插入1 nt,互补链均没有突变的杂合突变体;而其余8株均为双等位突变:KO-ARF12-2-1为1条链插入1 nt,互补链缺失4 nt;KO-ARF12-2-3为1条链缺失1 nt,互补链缺失6 nt;KO-ARF12-2-6、KO-ARF12-2-9和KO-ARF12-2-11为1条链插入1 nt,互补链缺失1 nt;KO-ARF12-2-7为1条链插入1 nt,互补链缺失7 nt;KO-ARF12-2-13为1条链缺失4 nt,互补链缺失5 nt;KO-ARF12-2-14为1条链缺失1 nt,互补链缺失5 nt;KO-ARF12-2-2、KO-ARF12-2-4和KO-ARF12-2-10 2条链均未突变(表3)。
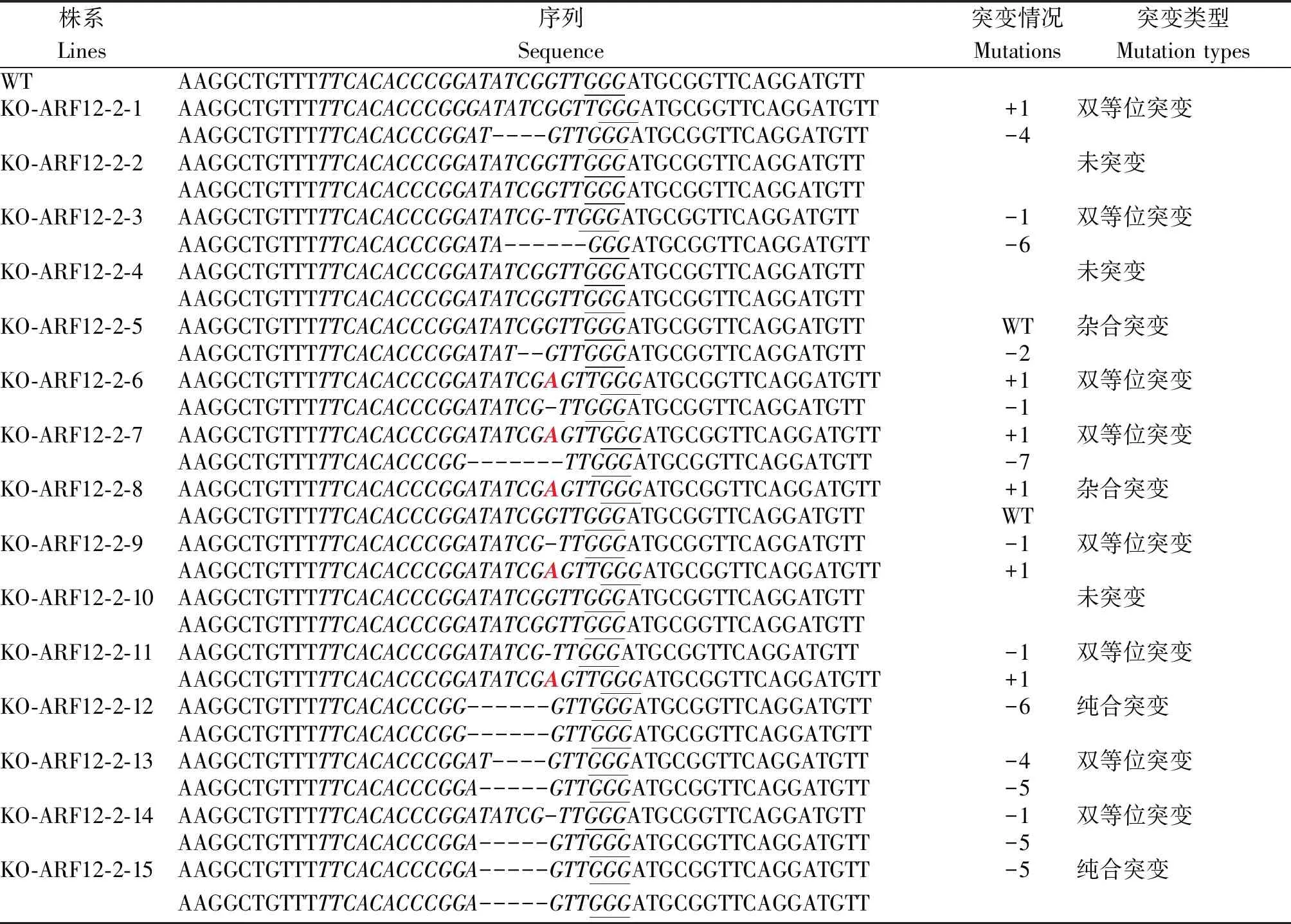
表3 KO-ARF12-2 T0转基因植株突变类型鉴定Tab.3 Identification of mutation types of KO-ARF12-2 T0 transgenic plants
2.2 KO-ARF12-1/-2 T1突变体鉴定
采用CTAB法提取OsARF12在T0发生突变的转基因株系叶片DNA,并用CrisprARF12-1_F、CrisprARF12-1_R和CrisprARF12-2_F、CrisprARF12-2_R对相应的转基因株系DNA进行扩增(图3,4),将产物送往公司测序。测序结果进行比对发现,KO-ARF12-1各突变转基因株系T120个单株中,有3种纯合突变、2种双等位突变,共5种突变类型,分别为:1条链缺失1 nt、互补链缺失7nt的双等位突变体有4株;缺失1 nt的纯合突变体有1株;缺失7 nt的纯合突变体有3株;缺失4 nt的纯合突变体有7株;1条链缺失4 nt、互补链缺失7 nt的双等位突变体有5株(表4)。

表4 KO-ARF12-1 T1转基因植株突变类型鉴定Tab.4 Analysis and identification of mutation types of KO-ARF12-1 T1 transgenic plants
KO-ARF12-2各突变转基因株系T160个单株中,有6种纯合突变、1种杂合突变和4种双等位突变,共11种突变类型,分别为:缺失1,6,2,7,4 nt和插入1 nt的纯合突变体,分别为12,1,6,3,2,10株;1条链插入1 nt、互补链未突变的杂合突变体3株;1条链插入1 nt、互补链缺失4 nt,1条链插入1 nt、互补链缺失1 nt,1条链缺失4 nt、互补链缺失5 nt和1条链缺失1 nt、互补链缺失5 nt的双等位突变体分别为6,9,4,4株(表5)。
2.3 KO-ARF12-1/-2 T2突变体表达量分析
以T22种不同靶位点的6种不同基因型纯合突变体KO-ARF12-1-1-3(缺失1 nt)、KO-ARF12-1-2-1(缺失4 nt)、KO-ARF12-1-2-6(缺失7 nt)及KO-ARF12-2-5-2(缺失2 nt)、KO-ARF12-2-11-4(插入1 nt)、KO-ARF12-2-15-5(缺失5 nt)(图5-A)为研究材料,选取大田正常生长条件下叶片样品提取总RNA,反转录并定量分析发现,除KO-ARF12-2-11-4,其他各突变体株系中OsARF12表达量与野生型相比均显著下降(P<0.05)(图5-B)。

表5 KO-ARF12-2 T1转基因植株突变类型鉴定Tab.5 Analysis and identification of mutation types of KO-ARF12-2 T1 transgenic plants

表5(续)
2.4 OsARF12对水稻株高的影响
为研究OsARF12对水稻农艺性状的影响,于灌浆期将突变体株系和野生型株系进行比较,结果表明,KO-ARF12-1/-2的株高均显著降低(图6-A、C),各突变体株系株高与野生型相比分别减少了16.59%,16.63%,16.06%和14.94%,13.15%,18.39%(图6-C)。进一步对水稻各茎节间长度进行统计分析发现,与野生型相比,KO-ARF12-1/-2显著降低了第3和第4茎节间长度,其中第4茎节间降低幅度最大(图6-B、D),降低的幅度为23.46%(P<0.05),其次为第3茎节间,降低的幅度为21.91%(P<0.05),而第1和第2茎节间长度与对照无显著差异(P>0.05)。
3 结论与讨论
现代农业发展中,对突变体进行基因功能研究已经成为一种重要的研究手段。2013年CRISPR/Cas9技术成功应用于定点突变水稻基因[23],2014年CRISPR/Cas9技术被证实可高效编辑水稻特异基因,并且基因突变能够稳定遗传[22],极大地促进了水稻突变体库的建立。本研究利用CRISPR/Cas9技术分别对OsARF12的第1、第2个外显子靶序列进行定点编辑,获得了OsARF12多种类型的突变体。其中,KO-ARF12-1 T03种突变类型,T15种突变类型;KO-ARF12-2 T011种突变类型,T111种突变类型,为研究OsARF12对水稻农艺性状影响奠定基础。
通过对KO-ARF12-1/-2 2种突变体材料中OsARF12的表达量进行鉴定发现,CRISPR/Cas9基因编辑技术显著降低了OsARF12的表达量。且与对照相比,KO-ARF12-1/-2株高显著降低(P<0.05),表明OsARF12在一定程度上正向调节水稻的株高性状。已有研究借助T-DNA插入或者是Tos17插入的arf12突变体研究发现,OsARF12可能介导根形态和磷诱导的生长素信号反应;Qi等[24]发现,OsARF12改变铁调节蛋白(OsMIR)和铁调节转运蛋白1(OsIRT1)的丰度,导致铁含量的改变。本研究通过CRISPR/Cas9基因编辑技术创制了OsARF12突变体,研究了其在调节水稻株高方面的重要作用,丰富了水稻生长素响应因子OsARF12的生物学功能。
水稻的株高受众多激素以及它们之间的相互作用调控,OsMADS57功能的缺失降低了GA的活性,导致株高降低[25];OsMED14_1与转录因子YABBY5、TDR和MADS29互作,参与调节生长素的动态平衡,进而调控水稻株高[26];miR1848靶向OsCYP51G3调节水稻中植物甾醇和BR的生物合成,影响水稻株高[27]。本研究通过CRISPR/Cas9技术对生长素响应因子OsARF12进行编辑,可能通过影响其生长素调控路径,进而导致株高降低。水稻株高由各茎节间长度组成,水稻抗倒伏能力与近基部茎节间长度呈负相关关系[28]。本研究表明,各突变类型的突变体与野生型相比,第1和第2茎节间长度无显著差异,第3和第4茎节间长度显著(P<0.05)降低,且第4茎节间降幅最大,表明突变体植株越靠近基部,其茎节间长度缩短幅度越大,这对提高水稻的抗倒伏能力有重要作用,但KO-ARF12突变体中不同节间长度改变的内在机制需要进一步研究。
