剪切波弹性成像联合彩色多普勒超声在乳腺癌新辅助化疗中的应用价值
2021-07-01陈宝定
杜 睿,欧 亮,陈宝定
(1江苏大学附属医院超声医学科 江苏 镇江 212001)
(2江苏大学附属医院甲乳外科 江苏 镇江 212001)
乳腺癌作为全球范围内女性最常见的恶性肿瘤之一和中国女性发病率首位的恶性肿瘤,其中约5%~20%因未能及时诊治而发展为局部中晚期乳腺癌,失去最佳手术时机。新辅助化疗(neoadjuvant chemotherapy, NAC)作为局部中晚期乳腺癌综合治疗的手段之一,其疗效与后续治疗密切相关[1]。超声作为乳腺癌筛查的首选手段,因其无放射性、简便、价格低廉等特点尤其适合反复检查。随着剪切波弹性成像(shear wave elastography, SWE)技术在临床应用日益深入,其价值也得到临床医生更多的认可。作为灰阶超声及彩色多普勒(color doppler flow imaging, CDFI)超声的重要补充技术,本文拟利用SWE结合上述常规超声技术回顾性分析我院接受NAC的中晚期乳腺癌患者前后的多参数的变化来评估其在NAC疗效中的应用价值。
1 资料与方法
1.1 研究对象
选取2017年1月—2020年12月我院行NAC的中晚期乳腺癌患者63例,均为女性,年龄45~75岁,平均年龄(56.78±6.94)岁。病理类型均为浸润性导管癌。纳入标准:(1)肿块为单发病灶,且无远处转移;(2)无明显心脑血管疾病,无明显化疗禁忌证;(3)化疗周期为2~4个月不等。
2 仪器与方法
2.1 超声检查
使用TOSHIBA Aplio 500彩色多普勒超声诊断仪,PLT-805AT线阵探头,频率7~14 MHz;具有SWE功能。先行灰阶超声及CDFI检查,记录病灶最大径,并记录病灶血供级别及测量滋养血管的最大血流速度(peak systole velocity, PSV)。随后切换SWE模式,观察病灶硬度情况,测量病灶杨氏模量值。
2.2 CDFI血流信号分级按Adler标准
0级,肿块内未发现血流信号;Ⅰ级,为少量血流,可见1~2个点状或细棒状肿瘤血管;Ⅱ级,为中量血流,可见3~4个点状血管或一个较长的血管穿入病灶,其长度可接近或超过肿块半径;Ⅲ级,为多量血流,可见≥5个点状血管或2个较长血管。
2.3 统计学处理
3 结果
3.1 病理及灰阶超声结果
63例患者中,NAC有效者为50例,NAC无效者为13例,有效率约79.4%。灰阶超声对比:NAC前病灶多表现为形态不规则的实性低回声团块,内部回声不均匀,可见多个成角及小分叶。NAC后病灶仍呈形态不规则的实性低回声团块,内部回声不均匀,成角及小分叶数目较前略少。NAC前后有效组及无效组病灶最大径均明显变小,差异有统计学意义(P<0.05),见表1、表2。
3.2 CDFI及SWE 结果
NAC前有效组及无效组CDFI均显示病灶血流较丰富,可见2支及以上穿枝血管,内部见多个点状血流信号,病灶血流分级以Ⅱ~Ⅲ级为主;NAC后CDFI显示部分病灶穿枝血管仍然可见,但较NAC前变细或数目减少,内部点状血流信号也较NAC前稀疏,血流分级以Ⅰ~Ⅱ级为主,部分为0级。有效组及无效组NAC前后比较血流分级、Vmax明显下降,差异有统计学意义(P<0.05)。NAC前有效组杨氏模量值最高达116.2 kPa,无效组达112.0 kPa;NAC后杨氏模量值最高为71.2 kPa,无效组为76.2 kPa,差异有统计学意义(P<0.05),见表1、表2。
表1 NAC有效组CDFI及SWE多参数对比(±s)

表1 NAC有效组CDFI及SWE多参数对比(±s)
组别 最大径/mm 血流分级 Vmax/(cm•s-1)杨氏模量/kPa NAC前 45.00±5.33 2.32±0.65 30.80±2.87 103.22±5.74 NAC后 34.52±3.90 1.64±0.78 15.86±3.54 81.40±5.00 t 21.605 10.204 23.584 35.904 P 0.000 0.000 0.000 0.000
表2 NAC无效组CDFI及SWE多参数对比(±s)
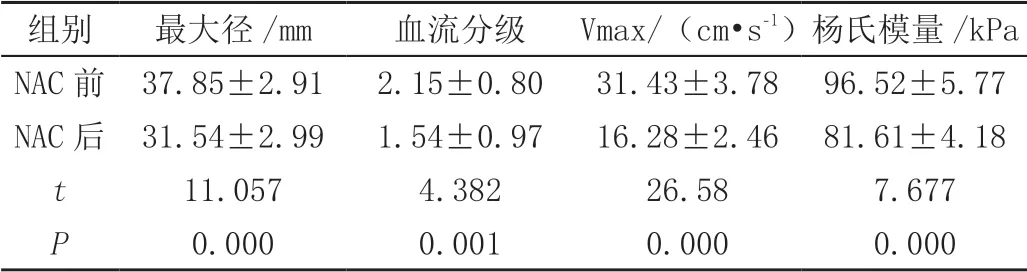
表2 NAC无效组CDFI及SWE多参数对比(±s)
组别 最大径/mm 血流分级 Vmax/(cm•s-1)杨氏模量/kPa NAC前 37.85±2.91 2.15±0.80 31.43±3.78 96.52±5.77 NAC后 31.54±2.99 1.54±0.97 16.28±2.46 81.61±4.18 t 11.057 4.382 26.58 7.677 P 0.000 0.001 0.000 0.000
3.3 CDFI及SWE多参数评估NAC疗效准确度结果:有效组与无效组中,仅最大径下降值与杨氏模量下降值有统计学意义(P<0.05)(见表3)。ROC曲线中,最大径下降值与杨氏模量下降值曲线下面积分别为0.847和0.816。
表3 NAC有效组与无效组前后CDFI及SWE多参数下降值对比(±s)

表3 NAC有效组与无效组前后CDFI及SWE多参数下降值对比(±s)
组别 最大径下降值/mm血流分级下降值Vmax下降值/(cm•s-1)杨氏模量下降值/kPa有效组 10.48±3.43 0.68±0.47 14.93±4.48 21.82±4.30无效组 6.31±2.06 0.62±0.51 15.15±4.63 14.92±7.01 t 4.179 0.434 -0.157 4.483 P 0.000 0.666 0.876 0.000
4 讨论
当前乳腺癌早期发现及准确诊断仍有较大难度,一经发现往往已至中晚期,失去了第一时间手术根治的机会。NAC为治疗局部中晚期乳腺癌提供了新的手段和希望。它通过化疗使原本临床分期较高的乳腺癌降期达到手术条件,使难以手术的局部中晚期患者得到手术治疗的机会,甚至部分患者可以行保乳手术,同时提高了完全缓解或部分缓解患者的生存率,改善了预后。因此,对NAC疗效的评估至关重要。临床上主要评估手段有超声、乳腺X线、CT及MRI。后三者虽有较高的空间分辨率,但存在着放射性或价格昂贵等不足而不作为临床首选。超声因其操作简便、价格低廉且可反复检查等特点一直作为临床首选筛查及复查手段。随着高频CDFI及SWE等技术的逐渐升级,超声亦逐步实现了多模态评估。
本研究结果表明,无论NAC有效或无效,单纯通过测量肿瘤大小变化判断乳腺癌NAC疗效基本有效,但仍有部分病例NAC前后大小变化不明显,这与李蔓英等人研究结果类似[2]。笔者分析这可能与病理亚型及化疗药物敏感性较低有关,因此需要补充其他手段评估。CDFI通过对病灶血供进行定性及定量评价,可清晰地反映血液供应情况,其信号越强,说明病灶内血液灌注水平越高,原因为乳腺癌细胞可刺激形成大量新生血管;而NAC后大量肿瘤细胞死亡,病灶内血管缩小、变窄,血流特征得以改善,表现为穿枝血流及内部血流数目减少,峰值血流速度减低,与李朝喜等人研究结果相近[3]。SWE作为乳腺良恶性肿瘤鉴别诊断的重要工具,通过精确测量病灶内部杨氏模量值能在病灶形态尚未发生明显改变时捕捉到病灶内部硬度的变化,从而间接反映NAC疗效[4]。本研究中SWE在两组前后比较中均差异显著有统计学意义,与之前研究结果一致[5]。将有效组与无效组NAC前后4个参数下降值比较表明,最大径和杨氏模量的变化值在评估NAC疗效中最有意义(ROC曲线下面积最大),笔者分析原因为这二者分别有效地反映了肿瘤形态学的变化和生物学特性(硬度)的变化,从外部和内部都证实了NAC是否有效,而彩色多普勒血流分级和Vmax受操作者手法及经验影响较大,较前两者欠稳定。
本研究仍有部分局限性,如血流分级标准的规范化评价需要进一步更新和完善;观察病例数偏少,需扩大样本量,未来可结合超声造影多参数对评估NAC疗效的体系进一步丰富。
