选择性头部亚低温对缺氧缺血性脑病新生儿血清细胞焦亡相关分子的影响
2021-07-01林先红张诗海解启莲
詹 震,林先红,郑 洪,张诗海,解启莲
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是指围生期窒息、缺氧、缺血引发的新生儿脑损伤性疾病。在发达国家新生儿HIE的发生率为活产儿的1‰~8‰,在欠发达国家这一数字高达26‰[1]。HIE病情进展可导致不同程度的神经系统后遗症,是儿童神经系统损伤如智力障碍、癫痫、脑性瘫痪等的常见原因之一。历史上对于HIE急性期治疗主要以全身支持和对症治疗为主,近年来医学研究致力于寻找治疗HIE新途径。亚低温疗法通过物理方法将体温下降2~5 ℃而达到疾病治疗目的。研究[2]显示,亚低温疗法可降低HIE新生儿的病死率和18月龄时严重残疾的发生率,对于中、重度HIE新生儿,适度的亚低温治疗现已成为标准治疗方案的一部分。
细胞焦亡是一种新发现的促炎性细胞程序性死亡方式,广泛参与许多神经系统相关疾病的发生、发展,如脑损伤、癫痫、中枢神经系统感染、神经退行性疾病等,亦被发现在HIE病理生理中起着至关重要的作用。细胞焦亡的经典途径依赖于半胱氨酸天冬氨酸蛋白酶-1(Caspase-1)的激活,并伴随释放大量炎性细胞因子如白细胞介素(IL)-1β、IL-18,产生促炎信号,从而诱发强烈的炎性反应[3]。亚低温具有明确的神经细胞保护作用,我国选择性头部亚低温治疗新生儿缺氧缺血性脑病多中心协作组[4]证实,选择性头部亚低温(selective head cooling,SHC)治疗可降低HIE新生儿严重伤残率。本研究选取细胞焦亡特征性的炎性关键酶Caspase-1以及细胞因子IL-1β、IL-18三项指标,观察SHC治疗不同临床分期HIE新生儿上述三项指标的变化,以期了解SHC治疗HIE可能的神经保护机制。现作报道。
1 对象与方法
1.1 研究对象 选择2018年8月至2020年7月我院新生儿科病区收治的确诊为HIE的新生儿共45例(HIE组)。其中男21例,女24例;出生体质量2.50~4.33 kg;出生胎龄37.9~38.7周;轻度HIE 13例,中度HIE 20例,重度HIE 12例。中、重度HIE新生儿共32例按照是否进行SHC治疗分为常规治疗组(常规组)15例和SHC治疗组(SHC组)17例,常规组男7例,女8例,出生体质量3.09~3.55 kg,出生胎龄37.9~38.4周;SHC组男7例,女10例,出生体质量2.88~3.52 kg,出生胎龄38.0~38.3周。同期选取正常足月新生儿10名作为对照组,男5名,女5名,出生体质量2.50~3.96 kg,出生胎龄37.6~39.0周。各组新生儿性别、出生体质量、出生胎龄均具有可比性。本研究经医院医学研究伦理委员会审核及批准。
1.2 纳入及排除标准
1.2.1 HIE组 纳入标准:符合2005年8月中华医学会儿科学分会新生儿学组制定的《新生儿缺氧缺血性脑病诊断标准》[5],并按照该标准中临床分度标准确定HIE患儿临床分期。排除标准:新生儿母亲孕期有妊娠合并症如高血压、乙型肝炎、糖尿病、传染病等。
1.2.2 SHC组 纳入标准:诊断为中、重度HIE,出生胎龄≥36周,且出生体质量≥2 500 g的新生儿,同时具有以下情况,(1)存在胎儿宫内窘迫的依据;(2)存在新生儿窒息的依据;(3)存在新生儿HIE或者振幅整合脑电图脑功能检测异常的依据。排除标准:(1)出生时间>12 h;(2)初始振幅整合脑电图检查无异常;(3)具有复杂难治性先天性畸形;(4)存在自发性出血倾向;(5)存在急性颅脑损伤相关疾病;(6)存在先天性感染相关疾病。
1.2.3 对照组 纳入标准:新生儿母亲孕期均无妊娠合并症,新生儿无宫内生长发育迟缓史,出生时无窒息史。
1.3 方法 HIE组新生儿确定临床分期及治疗方案后积极予以治疗,此过程在新生儿出生12 h内完成,常规组予对症支持治疗,即积极三维持(维持良好的通气、换气功能;维持周身和各脏器足够的血液灌流;维持血糖在正常高值),三对症治疗(控制惊厥、降低颅内压、消除脑干症状)。SHC组在积极常规治疗基础上进行SHC治疗,操作过程按照复旦大学附属儿科医院新生儿脑损伤课题组[6]制定的《亚低温治疗新生儿缺氧缺血性脑病方案(2011)》实行。
1.4 观察指标 比较各组新生儿治疗前后不同时点血清Caspase-1、IL-1β、IL-18水平。以确定HIE组新生儿临床分期与治疗方案开始治疗为0 h,分别采集对照组、HIE组新生儿外周静脉血2 mL,并于治疗24、48、72 h分别采集SHC组、常规组新生儿外周静脉血2 mL,均置于采血管中,3 500 r/min离心后分离血清,于-15 ℃冷冻保存。采用ELISA法测定血清标本中Caspase-1、IL-1β、IL-18水平,试剂盒由Solarbio公司提供,操作方法严格按照说明书进行。
1.5 统计学方法 采用t检验、方差分析、q检验和Spearman相关分析。
2 结果
2.1 对照组和不同分期HIE组新生儿血清Caspase-1、IL-1β、IL-18水平比较 不同临床分期HIE组新生儿血清Caspase-1、IL-1β水平均高于对照组,且Caspase-1、IL-1β水平均随HIE临床分期加重而上升(P<0.05);重度、中度HIE组血清IL-18水平均高于对照组和轻度HIE组,重度HIE组亦高于中度HIE组(P<0.05),但轻度HIE组与对照组差异无统计学意义(P>0.05)(见表1)。
2.2 血清Caspase-1、IL-1β、IL-18水平与HIE临床分期相关性分析 HIE新生儿血清Caspase-1、IL-1β、IL-18水平与HIE临床分期均呈明显正相关关系(rs=0.820、0.913、0.683,P<0.01)。
2.3 SHC组和常规组治疗前后血清Caspase-1、IL-1β、IL-18水平比较 2组0 h血清Caspase-1、IL-1β、IL-18水平差异均无统计学意义(P>0.05),SHC组治疗24 h血清Caspase-1和48、72 h时血清Caspase-1、IL-1β、IL-18水平均明显低于常规组(P<0.01)。治疗48、72 h,SHC组Caspase-1、IL-1β、IL-18水平均明显低于0、24 h(P<0.05);而常规组48 h时血清Caspase-1、IL-1β、IL-18水平均较0 h上升(P<0.05),72 h时IL-1β、IL-18水平仍明显高于0 h,而Caspase-1水平与0 h差异无统计学意义(P>0.05)(见表2)。
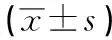
表2 SHC组和常规组各时点血清Caspase-1、IL-1β、IL-18水平比较
3 讨论
新生儿HIE脑损伤发生机制有许多因素参与,如线粒体损伤、自由基的产生、氧化亚氮合酶的活化、炎症反应、细胞凋亡等[7]。HIE最突出的特征是神经元的死亡引起严重的炎症反应,这种炎症反应主要由小胶质细胞介导,小胶质细胞是中枢神经系统唯一的先天免疫细胞,小胶质细胞在各种信号刺激下,NLRP3等相关蛋白形成炎性小体并发展成活化的Caspase-1,Cpaspase-1会切割IL-1β、IL-18原蛋白并激活GSDMD打孔蛋白,释放出大量IL-1β、IL-18并诱导细胞膜穿孔,从而触发细胞焦亡经典途径[8]。研究[9]显示,HIE患儿外周血细胞焦亡经典途径的关键分子水平的升高与损伤的严重程度密切相关,并通过建立缺血缺氧脑损伤体外模型进一步证实NLRP-3/Caspase-1/GSDMD轴介导的经典细胞焦亡途径参与了HIE的病理生理机制,导致更高水平的小胶质细胞活化。
亚低温治疗HIE的神经保护机制与温度与代谢之间的关键关系有关,同时可减少新生儿缺氧缺血再灌注后引起的神经元细胞凋亡以及抑制炎症反应[10]。细胞凋亡已被证实是HIE脑损伤中迟发性级联性神经细胞死亡的方式之一[11],不同于细胞凋亡,细胞焦亡需炎性Caspase介导且具有强烈的促炎性特征,是一种新发现的HIE脑损伤发生机制,目前对于亚低温治疗HIE的神经保护机制尚未完全清楚,为揭示亚低温治疗HIE的可能保护机制,我们假定SHC治疗HIE可通过减少细胞焦亡水平来实现神经保护作用,开展本次研究。
细胞焦亡经典途径依赖于Caspase-1的介导,其具有通过蛋白水解的切割方式作用于大多数底物的裂解,包括炎性体相关的细胞因子IL-1β、IL-18及细胞焦亡的最终执行蛋白GSDMD[12]。XU等[13]利用Caspase-1抑制剂VX765处理CLP诱导的脓毒症小鼠模型,发现抑制剂显著下调了细胞焦亡水平并减少了炎症细胞因子的释放,保护了脑的超微结构。Caspase-1是细胞焦亡经典途径必不可少的关键蛋白。本研究结果显示,不同程度HIE组新生儿血清Caspase-1水平均高于对照组,且其水平随病情严重而增加;接受常规治疗的中、重度HIE新生儿血清Caspase-1浓度水平在48 h前随治疗时间的推移上升,而后缓慢下降,接受SHC治疗的新生儿Caspase-1浓度水平随治疗时间的推移呈逐渐下降趋势,未见高峰。提示Caspase-1与HIE病情发生发展密切相关,且与常规治疗比较,SHC治疗可有效降低Caspase-1水平,SHC可能通过类似Caspase-1抑制剂的神经保护机制减少HIE病程中细胞焦亡水平以改善病程。
IL-1β、IL-18是在天然免疫防御过程中细胞焦亡经Caspase-1充分切割底物释放的主要细胞炎症因子。研究[14]表明,细胞焦亡最终导致细胞膜破裂的重要执行蛋白GSDMD影响着IL-1β的分泌过程。本研究发现,HIE新生儿血清IL-1β、IL-18与Caspase-1水平同时随病情严重程度升高,这或说明它们之间可能存在上下游作用的关系,相关分析结果显示,Caspase-1、IL-1β、IL-18与HIE临床分期具有相关关系。HUANG等[15]利用IRE1α抑制剂STF083010作用于新生HIE大鼠模型,导致了IL-1β、IL-18表达降低,证明抑制剂在新生HIE大鼠模型中通过逆转HIE细胞焦亡的神经保护机制。本研究结果显示,HIE新生儿血清IL-1β、IL-18水平均高于对照组,且随病情严重程度而升高;常规组IL-1β、IL-18水平治疗后呈上升趋势,而SHC组IL-1β、IL-18水平治疗后各时点均呈下降趋势。提示IL-1β、IL-18在HIE病情发生、发展中发挥诱发炎症反应的作用,SHC治疗HIE可通过类似IRE1α抑制剂减少细胞焦亡水平而抑制缺氧缺血后炎症反应的机制发挥作用。
综上,细胞焦亡可能在HIE发生、发展中起重要作用,而SHC治疗可能通过减少缺氧缺血性脑损伤后的细胞焦亡水平而达到神经保护作用,由此可为新的HIE亚低温治疗方案设计及神经保护药物开发提供思路。
