三阴性与非三阴性乳腺癌的表观弥散系数与Ki-67指数的相关性研究
2021-07-01钱吉芳章蓉赵丽李芸芝徐生芳杨爱萍
钱吉芳,章蓉,赵丽,李芸芝,徐生芳,杨爱萍
乳腺癌是女性最常见的恶性肿瘤,据2019 年国家癌症中心统计,我国女性乳腺癌发病率约占女性全部恶性肿瘤发病的17.1%,位居女性恶性肿瘤首位[1]。三阴性乳腺癌(triple-negative breast cancer,TNBC)是指ER、PR、HER-2 均阴性的肿瘤,约占所有乳腺癌的15%~20%,较其他亚型具有更强的侵袭性,局部复发后远处转移和死亡的风险更高,转移复发后的生存期也较短,TNBC更容易发生内脏和肺转移,且发生脑转移的风险更高,脑转移后的中位生存期更短[2-4]。为了提高TNBC 的治疗效果,需要可靠的预测性影像学及生物标志物。DWI利用表观弥散系数(apparent diffusion coefficient,ADC)值定量反映细胞内外水分子扩散程度,从而间接反映肿瘤恶性程度,已广泛应用于肿瘤分级、鉴别及预后评估[5-6]。目前关于ADC 值鉴别TNBC 与其他分子亚型的价值尚存在争议,且ADCmin及ADCDR在乳腺疾病方面的应用研究较少。Ki-67 是与细胞增殖相关的核蛋白,是检测肿瘤增殖活性的可靠指标,其能够发现病理分级较低却具有高度增殖能力的恶性肿瘤,从而更准确地反映肿瘤性质,并可作为肿瘤分级的独立指标[7-8]。基于这些研究,假设定量ADC 值可能是TNBC 与其他分子亚型鉴别诊断的有用参数。本研究旨在评估ADCmean、ADCmin、ADCmax和ADCDR的效用,寻找用于乳腺鉴别TNBC的最佳ADC参数并探讨其与乳腺癌Ki-67增殖指数的相关性。
1 材料与方法
1.1 一般资料
本研究经过本单位医学伦理委员会批准(批准文号:2019 院伦审12 号),免除受试者知情同意。回顾性分析2019年1月到2020年5月我院经手术病理证实不同分子亚型乳腺癌患者的临床及影像资料,所有患者术前行MRI 平扫及增强扫描检查。纳入标准:(1) MRI 检查前均未行穿刺活检或放化疗等诊疗措施;(2)通过乳腺手术治疗或穿刺活检并取得明确的病理及免疫组化结果。排除标准:(1)妊娠期或哺乳期的患者;(2)图像质量不佳,无法进行分析。
1.2 仪器与方法
采用Siemens Skyra 3.0 T 超导磁共振扫描仪,18 通道相控阵乳腺专用线圈。受检者取俯卧位,双侧乳腺自然悬垂于线圈内。扫描序列包括:(1)常规三平面定位及校正。(2)轴位T2WI-tirm 扫描,TR 3860 ms,TE 69 ms,层厚4.0 mm,间隔0.4 mm,矩阵384×384,FOV 36 cm×36 cm,NEX为2。(3)轴位DWI 扫描,TR 4700 ms,TE 62 ms,层厚4.0 mm,间隔0.4 mm,矩阵384×384,FOV 38 cm×38 cm;b 值为50、800 s/mm2。(4)轴位动态增强扫描,采用3D-VIBRANT 序列,TR 3.3 ms,TE 1.3 ms,层厚3.0 mm,间隔0.4 mm,矩阵384×384,FOV 38 cm×38 cm,NEX 为1。先行蒙片扫描,随后经肘静脉团注对比剂钆双胺(Gd-DTPA),流速2.2 mL/s,剂量0.1 mmol/kg,之后注射21 mL 生理盐水冲管,连续采集5 个时相图像,单期扫描时间70 s。
1.3 图像分析与ADC值测量
所有图像均由2 名经验丰富的乳腺影像学诊断医师进行分析。如有分歧,则通过与第三位专家协商达成一致意见。将原始DWI 图像导入西门子后处理工作站后,获得ADC 图像。根据T1WI、T2WI 及增强T1WI 扫描序列,确定实体瘤成分轮廓,避开坏死及囊性区后测量实体瘤成分的ADC 值。测量ADC 值类型及方法如下:ADCmean值:用自由形状标记工具在每层图像的ADC 图上手工勾画感兴趣区(ROI),得到ADCmean;ADCmin值:在包含实体瘤区域的连续水平ADC 图上手动放置ROI,间隔10~15 mm2,每层8~12 个感兴趣区,选择ADCmin值最低的ROI;ADCmax:在包含实体瘤区域的连续水平ADC 图上手动放置ROI,间隔10~15 mm2,每层8~12 个感兴趣区,选择ADCmax值最大的感兴趣区。记录ADCmean、ADCmin、ADCmax并计算ADCDR(ADCDR=ADCmax-ADCmin),然后将2名放射科医生的平均值作为最终的测量值。
1.4 病理学分析
由有乳腺病理诊断经验的病理科医师,不知患者信息的情况下,盲法对病理标本切片进行评估。参照2013 年国际乳腺癌会议专家共识[9],根据免疫组化结果将乳腺癌患者分为4 种分子亚型。其中:(1) Luminal A 型:PR/ER 阳性,且PR 高表达(≥20%),HER-2 阴性,Ki-67 低表达(≤14%)。(2) Luminal B 型:①HER-2 阴性:ER 阳性,HER-2 阴性,且至少一种以下情 况,Ki-67 高 表 达(>14%),PR 阴 性 或 者 低 表 达(<20%);②HER-2 阳性:ER 阳性,HER-2 阳性,任何状态的Ki-67,任何状态的PR。(3) HER-2 过表达型:HER-2 阳性(非Luminal),HER-2 过 表 达 或 增 殖,ER 和PR 阴 性。(4)三 阴 性:ER、PR、HER-2均阴性,Ki-67任意表达。
1.5 数据处理及统计学分析
采用SPSS 25.0 软件对数据进行统计学分析。对符合正态分布且方差齐的数据用(±s)表示,TNBC 与nTNBC 的定量ADC 值(ADCmean、ADCmin、ADCmax及ADCDR)比 较 采 用t检 验,采 用Pearman 相关性分析ADC 与生物学标志物Ki-67 指标的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌类型
根据纳入标准,最终入组乳腺癌患者145 例(共148 个病灶),患者均为女性,年龄25~80 (51.4±10.5)岁。病理结果显示非特殊型浸润性癌127 例,导管原位癌13 例,黏液癌3 例,乳腺髓样癌2 例,浸润性大汗腺癌1 例,实性乳头状癌1 例,混合性癌1 例。免疫组化结果分析TNBC 28 例(28 个病灶),nTNBC 117例(共120个病灶)。
2.2 TNBC与nTNBC的ADC值比较
TNBC 与nTNBC 的ADC 值 见 表1。TNBC 的ADCmean和ADCmin[(0.769±0.117)×10-3mm2/s、(0.633±0.091)×10-3mm2/s]显著低于nTNBC [(0.897±0.088)×10-3mm2/s、(0.712±0.121)×10-3mm2/s],差异均有统计学意义(P<0.05);TNBC 的ADCDR[(0.692±0.082)×10-3mm2/s]显著高于nTNBC [(0.468±0.133)×10-3mm2/s],差 异 有 统 计 学 意 义(P<0.05);TNBC 的ADCmax[(1.325±0.088)×10-3mm2/s] 高 于nTNBC [(1.181±0.112) ×10-3mm2/s],但差异无统计学意义(P>0.05);ROC 曲线结果显示:ADCDR区分两组效果最好,曲线下面积为0.925,以0.635×10-3mm2/s为作为两组鉴别诊断的最佳阈值,其敏感度及特异度分别为78.6%、93.3% (图1,2)。
表1 TNBC与nTNBC的ADC值比较(×10-3 mm2/s,±s)
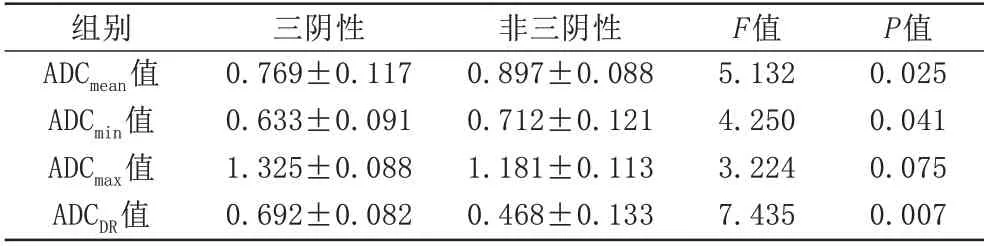
表1 TNBC与nTNBC的ADC值比较(×10-3 mm2/s,±s)
组别ADCmean值ADCmin值ADCmax值ADCDR值三阴性0.769±0.117 0.633±0.091 1.325±0.088 0.692±0.082非三阴性0.897±0.088 0.712±0.121 1.181±0.113 0.468±0.133 F值5.132 4.250 3.224 7.435 P值0.025 0.041 0.075 0.007
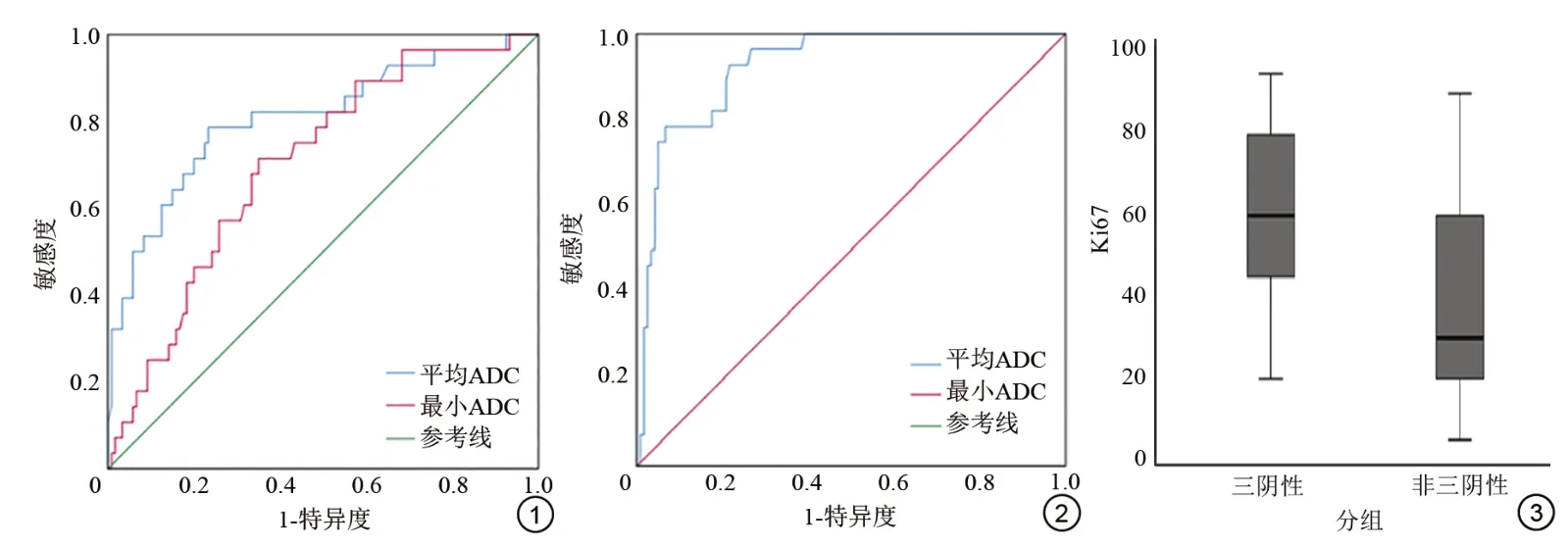
图1 ADCmean和ADCmin鉴别TNBC 与nTNBC 的ROC。曲线下面积分别为0.807、0.701,以0.846×10-3 mm2/s、0.656×10-3 mm2/s 分别为最佳诊断阈值时,敏感度分别为78.6%、71.4%,特异度分别为76.7%、65% 图2 ADCDR鉴别TNBC与nTNBC 两组的ROC 曲线。ADCDR区分两组效果最好,曲线下面积为0.925,以0.635×10-3 mm2/s为作为两组鉴别诊断的阈值,其敏感度及特异度分别为78.6%、93.3% 图3 TNBC与nTNBC的Ki-67增殖指数比较
2.3 乳腺癌ADC值与Ki-67增殖指数的相关性
相关性分析显示:ADCmean(r=-0.321)、ADCmin(r=-0.316)与Ki-67 表达呈负相关(P均<0.01)。ADCmax(r=0.249)和ADCDR(r=0.447)与Ki-67 表达呈正相关(P均<0.01)。此外,TNBC 的Ki-67增殖指数高于nTNBC (图3)。
3 讨论
3.1 TNBC与nTNBC的ADC值的比较
乳腺癌是一组高度异质性疾病,不同分子生物学指标表达水平的差异性可使相同病理分型与分级的患者表现出不同的临床表现和治疗效果[10-11]。TNBC 缺乏激素受体表达和HER2扩增,治疗TNBC的选择相对有限,且TNBC侵袭性强,转移性复发早,病情进展快,对现有治疗的反应时间短,生存结果较差。早期准确预测TNBC 的生物学特性以及临床表现可能是发现提高患者生存率的新方法的关键[12]。ADC 反映组织结构的微环境,因此与肿瘤的恶性特征有关,如细胞结构。大多数研究使用的是ADCmean,而近来研究认为ADCmin值及ADCDR在区分乳腺肿块的良恶性和检测导管原位癌的侵袭性成分方面很有用[13-16]。此外,ADC 还能反映组织结构的其他特征,如纤维基质的数量和细胞增殖的程度。
本研究结果显示:TNBC 的ADCmean和ADCmin显著低于非三阴性型乳腺癌;ADCDR显著高于nTNBC,差异均有统计学意义(P均<0.05),说明ADC 值定量分析在TNBC 与nTNBC 鉴别中具有一定的临床诊断价值,与文献报道一致[17]。Kato 等[18]的研究中证实ADCmin在特殊类型三阴性乳腺癌及导管型中的鉴别诊断具有显著的统计学差异,且Luminal A 的ADCmin明显高于Luminal B 型,均有统计学差异,表明乳腺癌不同分子亚型中ADCmin存在差异。另一项研究表明ADCmin似乎比ADCmean能更好地区分乳腺癌淋巴结转移状态,ROC 分析AUC 值更高,与淋巴结阳性数相关性更强[19]。但有关ADC 值在TNBC 及其他分子亚型中的表现尚存在争议。胡静等[17]的研究中TNBC 在MRI 上表现为更低的ADC 值,与本研究结果一致。而Sharma 等[20]的研究显示TNBC的ADC值高于nTNBC,也有研究证实TNBC的ADC值低于Luminal A 型、Luminal B 型、HER-2 过表达型乳腺癌,但差异无统计学意义[19]。以上研究结果的差异可能是因为ADC受多种因素的影响,除了细胞密度,还有其他方面的因素,如肿瘤血管的高灌注、新生血管通透性的增加及血管源性水肿等都可以导致细胞外间隙的增大,使ADC 增高,考虑到肿瘤异质性使得测量结果存在差异,说明ADC 值对三阴性乳腺癌的意义需要更进一步的研究。
一般认为ADCmin值对应的是病灶的细胞密度最高区域,反映了侵袭性成分的位置。ADCDR对应的是不同成分组织细胞,代表瘤内异质性,反映各种病理成分,如侵袭性癌巢,导管内成分,间质和纤维化。此外,瘤内的间变,如纤维化和坏死,可能影响ADC 值,特别是ADCmax值,进而影响ADCDR[21]。Mori 等[16]研究发现,乳腺良恶性病变分化时,ADCmin值的敏感度和特异度均高于ADCmean值,与ADCmean相比,ADCmin和ADCDR的组合显著提高了乳腺DWI 的诊断性能。在本研究中,ROC 曲线分析显示,ADCDR区分两组效果最好,曲线下面积最大,为0.925,以0.635×10-3mm2/s 为作为两组鉴别诊断的最佳阈值,其敏感度及特异度分别为78.6%、93.3%。TNBC 恶性程度较高,快速生长的肿瘤由于营养供应不均匀而形成混杂的坏死区域,通过上调其代谢,癌细胞最终成长为肿瘤团块。然而,癌细胞的营养供应因肿瘤大小而异,肿瘤表面的细胞可能获得更多的营养并继续复制,但中心区域的细胞可能会因营养供应有限而死亡。此外,肿瘤不同区域营养物质利用率的梯度是代谢途径改变的结果,如葡萄糖代谢、谷氨酰胺合成和氧气利用率[19,22]。因此,营养物质的缺乏会影响肿瘤细胞的代谢活性和生存能力。这最终会导致大体积肿瘤中死亡、静止和有丝分裂细胞的不均匀混合,这可能是TNBC的ADCDR较其他亚型肿瘤高的原因。ADCDR还可以很好地评估肿瘤预后情况。Kim等[3]探讨了DWI 与浸润性乳腺癌远处无转移生存期的关系发现有远处转移的女性ADCDR高于无远处转移的女性,证明ADCDR越高,浸润性乳腺癌远处无转移生存期越低。吴朋等[23]在鉴别DCIS 和DCIS 微浸润的研究中对不同ADC 值诊断效能比较发现ADCDR的准确性、敏感度、特异度均高于ADCmin。笔者认为ADCDR值可能是DWI 鉴别TNBC 与其他分子亚型的最佳影像学参数。
3.2 乳腺癌ADC值与Ki-67增殖指数的相关性
对磁共振成像参数与病理组织学检测结果进行相关性研究一直是影像学研究的热点。Ki-67是细胞增殖相关抗原,由于不受控制的增殖是恶性肿瘤进展的一个关键特征,免疫组化评估核抗原Ki-67 现在被广泛用作乳腺癌分层的工具。除G0期(7期)外,在细胞周期的所有阶段细胞中都可检测到核抗原Ki-67,而Ki-67指数(核免疫染色中Ki-67阳性细胞的百分比)是衡量肿瘤增殖的指标[14,24]。既往研究报道ADC 与Ki-67 之间无显著相关性[25]。在本研究中,ADCmean、ADCmin及ADCmax和Ki-67 之间观察到微弱但有统计学意义的相关性,ADCDR与Ki-67 指标的相关性也有统计学意义,且ADCDR与Ki-67 相关性较其他定量ADC 值相关性更强。其他一系列对乳腺癌的ADC 与Ki-67 的高低表达的研究也表明ADC 值与Ki-67 呈负相关[20-21],与本研究结果一致。之前的研究大多使用的是ADCmean,这是传统的方法,但本研究结果显示ADCmin及ADCDR与Ki-67 存在相关性,并且ADCDR在与Ki-67 的相关性上有更好的结果。另外,本研究中TNBC 的Ki-67 增殖指数高于nTNBC,有文献报道TNBC 与Ki-67 和p53 表达较高相关,这可能是TNBC 肿瘤预后不良的原因之一[26]。ADC 可以对整个病变进行无创评估,而Ki-67 指数只能对活检得到的部分有限的病变进行评估。考虑到ADC 在无创评估整体病变方面的优势,相对于Ki-67 只能评估部分病变,笔者认为ADC 可能成为乳腺癌分子亚型鉴别诊断中Ki-67 指数的无创替代标志物,且ADCmin及ADCDR的诊断性能更佳。
3.3 本研究局限性
这项研究有一定的局限性。本研究为回顾性试验,可能存在选择偏倚。其次,低b值时灌注效应会影响ADC值,因此,本研究中的b 值组合会影响ADC 测量的准确性。另外,ROI 为手动勾画,并未包含整个肿瘤的全部,这可能会漏掉肿瘤恶性程度最高的部分。
综上,ADC值定量分析在TNBC与nTNBC鉴别中具有临床诊断价值,可作为常规MRI 检查的一种补充的量化分析工具,ADCDR值可能是DWI鉴别两组的最佳单一参数,且ADC值与增殖指数Ki-67 之间存在一定的相关性。ADC 可能成为乳腺癌分子亚型鉴别诊断中Ki-67 指数的无创替代标志物,未来有望进一步研究验证ADC值对于TNBC的鉴别诊断价值。
作者利益冲突声明:全体作者均声明无利益冲突。
