距骨骨软骨损伤MR T2-mapping与软骨基质金属蛋白酶-1表达的相关性研究
2021-07-01李伟于泽晨贾岩波于静红海玲乌日汗白心雨
李伟,于泽晨,贾岩波,于静红*,海玲,乌日汗,白心雨
自18 世纪30 年代以来,先后有学者报道或提出了距骨剥脱性骨软骨炎、距骨骨软骨骨折、距骨骨软骨病等概念,上述疾病在临床、影像学表现以及相应治疗方案很难完全区分开来,因此,医疗界将上述疾病统称为距骨骨软骨损伤(osteochondral lesions of the talus,OLT)[1]。OLT 主要累及距骨软骨及相应水平的软骨下骨,其损伤机制至今尚未完全明确[2]。近年来,国内外学者将目光聚焦在了蛋白水解酶家族(matrix metalloproteinase,MMPs),其能够水解所有细胞外基质。基质金属蛋白酶-1 (matrix metalloproteinase-1,MMP-1)是一种胶原酶,其裂解关节软骨Ⅱ型胶原能力最强,而Ⅱ型胶原正是关节软骨细胞外基质主要成分之一。众多学者研究表明,关节软骨损伤可导致软骨MMP-1 含量升高,进而打破MMPs-TIMPs 二者的平衡,进一步加重软骨损伤[3-5]。关节镜探查,一直以来都是OLT 诊断的金标准,但因其有创性这一因素,单纯诊断性探查患者接受程度较差。磁共振成像(magnetic resonance imaging,MRI)已成为临床医师诊断OLT 的最佳影像学检查。MRI 自应用于关节软骨评价以来,因其无创性、多维度(生理、生化、组织学、力学)评价关节软骨而广受临床医师关注,特别是功能MRI 的逐步开发、序列的优化,如T2-mapping成像,现已广泛应用于科研、临床对关节软骨早期损伤、退变的诊断中[6]。
目前OLT 磁共振T2-mapping 功能成像与软骨损伤MMP-1的表达之间的关系国内外报道鲜有提及,笔者通过对健康志愿者正常距骨软骨和OLT 患者退变软骨T2 值的测量、对OLT 患者术后离体软骨行苏木精-伊红染色(hematoxylin-eosin staining,HE)和蛋白免疫印迹实验(Western Blot,WB)检测距骨软骨MMP-1 的表达,前瞻性探讨OLT 患者磁共振T2-mapping 成像T2 值与关节软骨MMP-1 蛋白表达的相关性,以其为临床治疗早、中期OLT 提供影像学定量参考信息。
1 材料与方法
1.1 研究对象
前瞻性研究:选取我院2018 年1 月至2020 年9 月间临床诊断OLT 拟行关节镜手术患者30 例。右踝关节19 例,左踝关节11 例,男性18 例,女性12 例,平均年龄(32.9±4.7)岁。所有患者及志愿者均签署知情同意书,本研究经我校伦理委员会批准(批准文号:YKD201802235)。纳入标准:(1)临床资料完整,年龄:18~45 岁,性别不限;(2)以踝关节疼痛为主诉的患者;(3)术前均行MRI 检查;(4)符合关节镜及磁共振OLT诊断标准的患者。排除标准:(1)多发距骨骨软骨损伤(3 处及以上,含3 处);(2)继发滑膜炎(痛风、类风湿等);(3)确诊为踝关节骨性关节炎(osteoarthritis,OA) (参照2018 中国版OA 诊疗指南);(4)踝关节感染性病变;(5)大量关节积液;(6)踝关节手术史。
招募健康志愿者30名。按照性别分为两组,男女组各15名。平均年龄(31.1±3.9)岁。纳入标准:(1)既往体健,无高强度运动训练史,常态生活;(2)自愿参加本次研究;(3)体重指数(body mass index,BMI)在18.5~23.9 kg/m2之间;(4)踝关节MRI 表现软骨正常。排除标准:(1)既往有踝关节外伤史、感染史、手术史;(2)确诊踝关节OA;(3)确诊踝关节距骨骨软骨损伤;(4)继发滑膜炎。
1.2 仪器、检查方法
1.2.1 MRI检查设备
踝关节扫描仪器设备选用德国Siemens skyra 3.0 T 高场MRI,扫描线圈选用16 通道足踝专用线圈Foot/Ankle 16 A3T Tim coil。图像后处理站为Syngo VIA VB10。
1.2.2 检查方法
常 规 检 查:SE T1WI (TR 750 ms,TE 15 ms)、fs-FSE T2WI (TR 2000 ms,TE 50 ms):FOV 160 mm×160 mm,层厚3.0 mm,间距0.3 mm,矩阵320×320,NEX为4。
T2-mapping 功能成像采用多回波SE 序列,FOV 160 mm×160 mm,TR 1000 ms,TE 13.8、27.6、41.4、55.2、69.0 ms,矩阵320×320,层厚3.0 mm,间距0.6 mm,翻转角180°,扫描时间2 min 24 s。
1.3 图像分析
1.3.1 MRI分型
采用Hepple 改良分型(表1),即Ⅰ型:单纯关节软骨损伤;Ⅱ型:以软骨损伤、软骨下骨骨折合并与否骨髓水肿分为ⅡA、ⅡB 两型;Ⅲ型:损伤软骨分离无移位;Ⅳ型:损伤软骨分离有移位;Ⅴ型:合并软骨下骨囊肿。

表1 OLT分型Tab.1 OLT parting
1.3.2 数据测量、分析
(1)健康对照组距骨软骨分区及数据测量,根据磁共振矢状位成像,距骨前、中、后部对应距骨滑车曲面前1/3、中1/3、后1/3。(2)据MR 冠状位成像,距骨内、外侧部对应距骨滑车各1/2。(3)根据上述(1)、(2)将距骨软骨6 分区,即内前、内中、内后部,外前、外中、外后部,每分区随机测量3个T2值(后处理站感兴趣区放大测量),ROI>1.00 mm2,共计测量18 个T2值。
OLT 组距骨损伤区数据测量:据磁共振矢状位成像、T2-mapping 伪彩图、后处理融合图,选取软骨损伤中心区着色为绿色、黄绿色的区域(非深蓝色、蓝色区),将上述区域等分为4 分区并编号标记,每个分区随机选取ROI 测量1 个T2 值(后处理站感兴趣 区 放 大 测 量),ROI>1.00 mm2,30 例 患 者 共 计120 个T2 值,测量ROI 时注意尽量避免选取邻近分区分界部位。
健康对照组及OLT 组软骨T2 值测量均由3 名副主任医师及以上级别医师独立完成,当测量结果出现不一致时,经测量医师共同协商得出一致结论。
1.4 HE染色、Western Blot检测
1.4.1 观察、标记
运动医学外科医师将关节镜下微创手术取下的OLT 患者踝关节距骨软骨损伤部分(包含距骨软骨及相应软骨下骨)现场做相应编号标记(标记术后取出的软骨具体部位)。肉眼观察距骨软骨病灶中心区域以及术后取下的病灶中心附带周围区域的软骨形态、损伤程度,并做好相应记录。
1.4.2 分组、检测
将医师关节镜下取出的损伤软骨按编号及术后现场记录软骨具体部位,术后软骨等分为4 等份,等分原则:与OLT患者术前MRI病灶软骨4分区顺序、大小相对应(剔除肉眼观察已完全无软骨附着或大部分无软骨附着患者)。行HE 染色、Western Blot 检测。HE检测结果参照Mankin改良分级,依据软骨结构、染色、细胞含量、潮线完整性进行评分。Ⅰ级:0~2 分;Ⅱ级:3~7 分;Ⅲ级:8~11 分;Ⅳ级:12~14 分。由3 名病理诊断医师分别做出诊断,当软骨分级结果出现不一致时,由分级医师共同协商得出一致结论。Western Blot检测采用Image-J软件进行图像分析。
1.5 统计学方法
采用Graphpad Prism 8.0.2 软件对实验中检测的数据进行统计分析,数据满足正态齐性和方差齐性时运用单因素方差分析,采用Pearson相关分析对软骨MMP-1 表达与软骨T2 值进行相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 健康对照组分区T2值
本组30 名健康志愿者距骨内侧平均T2 值(内侧前、中、后部)为(29.15±2.89) ms,与OLT组退变软骨各级别两两比较T2 值(表2)差异有统计学意义(P<0.05);30 名健康志愿者距骨外侧平均T2 值(外侧前、中、后部)为(29.76±3.18) ms,与OLT 组退变软骨各级别两两比较T2 值(表2)差异有统计学意义(P<0.05)。
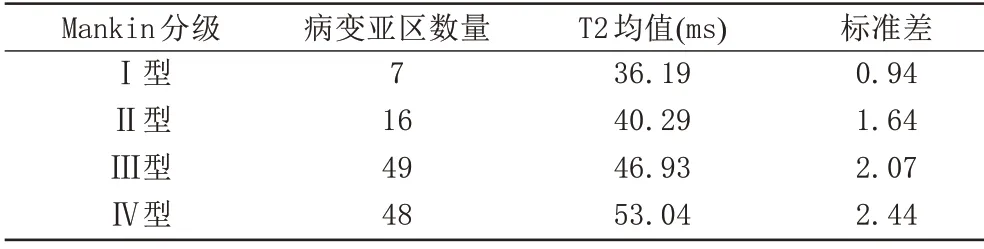
表2 距骨骨软骨损伤区T2值与Mankin分级对照表Tab.2 Cartilage lesions of the talus area T2 values with Mankin classification table
2.2 OLT分型
本组30例患者MRI检查共发现32处距骨骨软骨损伤(2 例患者均有2 处病灶)。根据Hepple's MRI 分型:Ⅰ型2 例,Ⅱ型10 例,Ⅲ型5 例,Ⅳ型2 例,Ⅴ型11 例(表1)。据磁共振6 分区法,全部32 个病灶中有23个病灶部位位于内侧中部。
2.3 OLT的MRI表现
健康志愿者,男,31 岁,踝关节磁共振T2 脂肪抑制图与T2-mapping 伪彩图(图1A~C)。T2 脂肪抑制图示软骨分层较清晰,连续性良好。融合彩图见踝关节距骨骨软骨呈均匀深蓝色色带(融合彩图左侧色阶显示:深蓝-深红,由下到上,渐进,0-100)。
OLT 患者,男,36 岁,距骨骨软骨损伤Ⅴ型:合并距骨软骨下骨囊肿。踝关节磁共振T2脂肪抑制图与T2-mapping 伪彩图(图2A~D)。T2 脂肪抑制图示软骨连续性中断,局部软骨厚度变薄,软骨层侧分界欠清晰。融合彩图见踝关节距骨骨软骨大部分区域呈黄绿色色带(融合彩图左侧色阶显示:深蓝-深红,由下到上,渐进,0-100)。
2.4 OLT 患者距骨软骨T2-mapping 与病理Mankin 分级对照
对30 例OLT 患者术后软骨共计120 个区域进行采片,病理结果见表2。T2 值与病理分级对照可见,软骨退变Ⅰ、Ⅱ、Ⅲ、Ⅳ级相比较,T2 值随软骨退变病理分级程度的增高而呈上升趋势,差异具有统计学意义(P<0.05);软骨退变高级别与低级别相比较,T2值差异具有统计学意义(图3A~D)(P<0.05)。
2.5 OLT 患者距骨软骨MMP-1 表达与病理Mankin 分级对照、与磁共振T2值相关性分析
踝关节距骨软骨MMP-1的表达量随ManKin分级明显增大(图4A),Western Blot检测MMP-1显示(图4B),OLT 中MMP-1 在软骨中的表达随着软骨ManKin 分级呈明显增大的趋势,且随着级别增高,蛋白表达明显增加(图4C)。
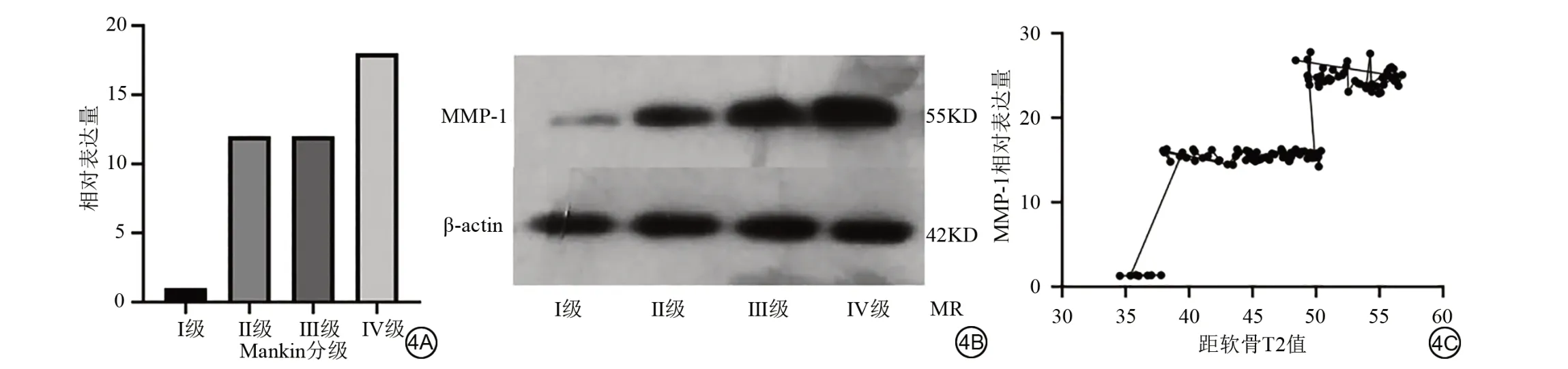
图4 A:距骨骨软骨MMP-1表达Mankin分级比较直条图;B:距骨骨软骨MMP-1蛋白表达图(western Blot);C:距骨骨软骨MMP-1表达与T2值相关性分析图Fig. 4 A: Mankin grading comparison straight bar chart of MMP-1 expression in talus osteochondral. B: Expression of MMP-1 of talus osteochondral (western Blot).C:Correlation analysis of MMP-1 expression and T2 value in talus osteochondral.
3 讨论
3.1 病因、流行病学、发病机制
OLT 多发生于20~40 岁间的中、青年人,男多于女,其发病机制尚未明确,目前认为其发病原因多是外伤导致,本研究30 例患者中28 例有明确外伤史,全部30 例OLT 患者中有23 例发病部位在内侧中部,这与国内学者研究略有出入[7]。从踝关节生物力学机制分析OLT内侧损伤居多的原因,可能为以距腓前韧带、跟腓韧带为主的外侧韧带损伤、松弛导致内侧距骨应力显著增大引起[8]。
研究表明,炎症因子及其相关机制导致了软骨损伤、退变的发生、发展。这其中基质金属蛋白酶(matrix metalloproteinases,MMPs)受到国内外学者的持续关注。MMPs 是酶活性依赖锌离子的蛋白酶超家族,具有极强的同源性,在正常稳定状态的软骨组织中很少表达,但当软骨损伤、退变等因素激活软骨相关炎性机制时,MMPs 的表达显著增多。而MMPs在OLT 软骨细胞外基质合成与降解失衡导致软骨变性这一机制中起决定性作用。国内外学者在与软骨相关的MMPs 领域研究较多是MMP-1、MMP-3、MMP-7、MMP-13。研究报道,MMP-1 对Ⅱ型胶原的裂解作用较强,MMPs家族成员对Ⅱ型胶原的降解需依赖MMP-1的协同作用来发挥效应。有研究显示MMP-1 在关节软骨损伤、退变中表达显著增高,且软骨损伤、退变程度与MMP-1 的增高表达呈正相关[9-14]。本研究结果表明,距骨骨软骨T2 值随软骨损伤Mankin 分级逐级增大,MMP-1 蛋白表达随软骨Mankin 分级显著增加,高级别与低级别差异明显(图4A)。MMP-1 在OLT 软骨中含量的表达变化可以作为重要的量化参数来指导临床评估和治疗OLT 特别是早期OLT 病变的提示及预防。
3.2 MRI表现、分型
虽然关节镜是OLT诊断的金标准,但其因探查盲区,有创等因素,单纯的诊断性关节镜探查,患者接受度相对MRI 较差。MRI 因其固有的优越性,可精确显示OLT病灶的大小以及病灶的位置,在距骨骨软骨损伤术前评估、手术方案制定以及术后复查中都发挥着不可替代的辅助作用。有学者研究表明,60%以上的OLT 患者病损位置居于距骨内侧[15]。本研究中30 例OLT 患者共计32 个病灶(2 例有2 处病灶),其中23 个位于距骨内侧中部(71.9%),这与上述研究结果基本一致。
距骨骨软骨损伤MRI的Hepple 改良分型重点补充了软骨下囊肿形成这一概念。MRI 对距骨骨软骨损伤合并软骨下囊肿(Ⅴ型)显示优良,很好地解决了关节镜难以显示深部软骨、软骨下骨的困扰。临床医师可以依据Hepple Ⅴ型的MRI表现判断病灶的大小及位置,辅助临床手术方案的制定。本研究全部30 例患者中11 例属于Hepple Ⅴ型患者,总站比达36.7%,11 例Ⅴ型患者中9 例患者病灶位于内侧中部(81.8%),这与史尉利等[16]的研究略有出入,分析原因可能与本研究入选患者数较少有关。
3.3 T2-mapping
OLT 是踝关节损伤最常见的疾病之一,其早发现早治疗非常关键。MRI 因其无创、敏感的特性成为临床医师辅助诊断OLT 的首选。这其中MRI 功能成像之一的T2-mapping 很好的弥补了MRI 常规序列对关节软骨本身显示的不足,但是其诊断价值、诊断标准意见尚未统一,其扫描时间过长、对扫描机型要求较高等因素明显制约其实用性。本组患者在保证扫描图像质量的前提下,T2-mapping 单个序列优化后扫描时间均控制在2 min 30 s 以内,扫描时间的缩短显著提高了受检者的接受度及T2-mapping成像的实用性[17]。
T2-mapping通过T2弛豫时间这一参数值来显示软骨内部T2 值,关节软骨的T2 值取决于胶原含量、排列方向及软骨内水的含量,有学者研究表明,关节软骨损伤、退变的T2 值均较正常软骨为高,而且T2 值随关节软骨退变的严重程度增加而升高。关节软骨由浅到深的分层结构的生化特性决定了其T2值范围区间的特性,进而决定其T2-mapping 后处理融合图像能够良好地依靠图像伪彩的不同来显示软骨相应层次结构。本研究所有30例患者的T2-mapping融合图像均能良好地显示距骨软骨正常区、病灶区,通过伪彩图颜色的变化即可初步、直观地判断软骨损伤与否及损伤程度,通过对T2值的测量分析,可客观、定量分析距骨软骨损伤,二者有机结合可为临床医师诊治OLT 提供影像学客观依据(图1A~C,图2A~D)。
踝关节距骨骨软骨损伤时,软骨生化成分的改变出现在软骨发生形态改变之前,这种改变可通过软骨T2 值反映出来。研究表明,软骨损伤早期(Ⅰ、Ⅱ级),水分进入松散的软骨架构,软骨T2 值升高,大部分学者认为此时的关节软骨尚具备自我修复的能力。软骨损伤中、末期,随着软骨细胞数量、软骨水分含量骤降,Ⅱ型胶原纤维的含量降低等因素,导致关节软骨自我修复能力丧失殆尽,关节软骨T2 值虽有增高但不显著。本组患者中距骨软骨损伤级别较高的患者软骨T2 值增高仍旧有统计学意义(表2),分析其中原因,可能是国内外学者大部分关节软骨、损伤退变的研究数据都是基于膝关节OA 得来,而膝关节OA 病程较OLT 患者病程明显为长,OLT 软骨水分丢失较膝关节OA 相对较少,高级别OLT 损伤软骨T2 值增高仍较明显。
T2-mapping可以通过软骨T2弛豫时间来定量检测关节软骨内组织成分的变化,国内有学者研究认为膝关节骨性关节炎软骨的退变程度与软骨MMP-1 的表达量呈正相关[18],这一结论预期可为临床早期诊断、监测退变的关节软骨靶向治疗效果提供客观依据。OLT 软骨退变机理与膝关节骨性关节炎关节软骨退变的机理有众多相似之处,踝关节距骨软骨损伤伴随着关节滑膜及软骨细胞内MMP-1 表达升高,MMP-1 在OLT 患者软骨损伤的病理进程中起关键性作用。调节、阻断MMP-1及其相关信号通路的表达可以防治早中期踝关节距骨骨软骨损伤,这一新的思路为研发治疗早期OLT 的靶向治疗药物提供新途径。本组30 例OLT 患者术后软骨120 个区域T2 值随软骨病理分级程度的增高而呈上升趋势(表2)。软骨损伤级间比较、高级别与低级别相比较,差异具有统计学意义(P<0.05),这与部分学者研究结果略有出入,分析其原因,可能是入组患者数较小、T2 值测量标准的差异等因素导致。
综上所述,踝关节距骨骨软骨损伤软骨损伤、退变与MMP-1的表达具有一定的相关性,磁共振定量成像技术可以为关节软骨损伤以及早期退变评估提供新的手段[19-22],但国内外学者研究主体多为动物模型的初步阶段,还需要更多的临床研究数据佐证。本研究亦有局限性,如患者数较少,病理取材相对难度较大,踝关节距骨软骨正常T2值尚未有统一标准等,这些潜在的影响因素可能会对实验结果产生一定的干扰。
本研究用优化参数后的T2-mapping对临床诊断OLT 行关节镜手术者进行扫描并定量分析,显著提高了T2-mapping 在OLT 定量诊断的实用性,同时对手术切除软骨进行HE 染色观察软骨病理组织学改变,探索OLT 患者关节软骨MMP-1 的表达信息,研究OLT软骨损伤、退变的分子、基因病理基础,为OLT 的MRI定量分析、诊断及病情监测提供客观理论依据,以期提高OLT早、中期诊疗水平。
作者利益冲突声明:全体作者均声明无利益冲突。
