纳米二氧化硅抗结剂对护胃固体饮料稳定性及功效的影响
2021-06-30袁尔东刘靓赟黄敏任娇艳
袁尔东,刘靓赟,黄敏,任娇艳
(华南理工大学食品科学与工程学院,广东广州 510640)
二氧化硅是一种优良的流动促进剂,作为抗结剂在颗粒剂制造中可作内干燥剂,可以较好地改善颗粒流动性以维持产品的稳定性[1],防止颗粒或粉状食品聚集结块、保持其松散或自由流动,在固体饮料中有着良好的应用[2]。随着纳米技术和生产工艺的发展,食品添加剂二氧化硅已经达到了纳米尺寸。由于纳米颗粒特殊的理化特性,纳米级食品添加剂对食品的色泽、味道、质构、货架期等可能产生明显影响,例如纳米级食品添加剂可以通过增强食品中铁和锌的溶解性改善食品的感官品质[3]。当将纳米级食品添加剂用于功能性食品中时对其功效活性发挥也可能产生影响。
研究表明,纳米级食品添加剂可以通过对食品成分的控制和释放来促进生物活性物质在食品中传递,改善功能成分的活性[4]。Canham研制了可用于功能性食品的纳米级硅,其可以提高加工和储存过程中特定营养素的稳定性,并且可以通过促进肠道中生物降解性物质原硅酸的释放来提高机体对营养物质的利用[5]。纳米添加剂还可能影响营养成分在体内的吸收或代谢过程。Lee等人研究发现,纳米二氧化硅可能通过与食品成分的结合,提高大鼠对糖类和蛋白的口服吸收量[6]。
但目前针对纳米二氧化硅作为食品添加剂应用到功能性食品中的研究较少,为使其能够进行有效的推广应用,有必要对其有关生物性能进行深入研究。因此,本文以二氧化硅(SiO2)和纳米二氧化硅(nSiO2)为抗结剂,应用于以黄芪、茯苓、葛根、猴头菇多糖为原料制备的护胃功能固体饮料,分析对比这两种抗结剂对其稳定性及护胃功效的影响,探讨纳米级食品添加剂在功能性食品中应用的可行性。
1 材料与方法
1.1 材料
1.1.1 细胞
人胃黏膜上皮细胞(GES-1),由南方医科大学友情提供。
1.1.2 主要实验材料
磷酸盐缓冲溶液(PBS,pH 7.4)、DMEM培养基、胎牛血清(FBS)、0.25% EDTA-胰酶、青霉素和链霉素双抗溶液均购自美国Gibco公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)购自美国Sigma-Aldrich公司;SiO2和nSiO2,均购自广州新如荣生物科技有限公司;其余试剂均为国产分析纯。
茯苓、黄芪、葛根和猴头菇菌丝体多糖购自安国市一达药业有限公司。
1.1.3 主要实验仪器
恒温恒湿箱购自上海精密仪器仪表有限公司;全功能微孔板检测酶标仪购自美国伯腾仪器有限公司;二氧化碳细胞培养箱购自Thermo Scientific;超净工作台购自苏州安泰空气技术有限公司。
1.2 实验方法
1.2.1 护胃固体饮料的制备
将黄芪、茯苓和葛根按照1:1:1的比例复配,热水提取2次。第一次提取,料液比1:10(W/W),100 ℃,2 h。过滤后的滤渣进行第二次提取,料液比1:8(W/W),100 ℃,1.50 h。合并两次提取液,浓缩、冷冻干燥后,与猴头菇菌丝体多糖按比例复配混匀,为具有护胃功效的复合提取物配料(CE)[7]。最后,加入适量甜菊糖苷和果胶以及抗结剂,混匀,得到护胃固体饮料。
1.2.2 护胃固体饮料理化性质测定
1.2.2.1 总多糖含量测定
采用苯酚-硫酸法进行样品多糖含量的测定[8]。具体步骤是:称取105 ℃干燥至恒重的无水葡萄糖标准品20 mg,用蒸馏水溶解并定容于100 mL的容量瓶中,配制成葡萄糖标准溶液,其浓度为0.20 mg/mL。分别取0、1.00、2.00、3.00、4.00、5.00、6.00 mL的葡萄糖标准液于10 mL容量瓶中,用蒸馏水定容,配成-系列浓度为0、0.02、0.04、0.06、0.08、0.10、0.12 mg/mL的标准使用液。移取不同浓度的标准使用液各2 mL于试管中,加5%的苯酚2 mL摇匀,缓慢加入5 mL浓硫酸摇匀,沸水浴显色15 min,冷却至室温后,在波长为490 nm处测定吸光度值,每个浓度平行测定三次,以空白管调零,横坐标为葡萄糖标准溶液的浓度,纵坐标为吸光值,从而绘制成葡萄糖标准曲线。其线性方程为 y=7.7464x+0.0292,相关系数R²=0.9966,表明该标准曲线线性较好。
样品测定方式同上,将待测样品稀释成合适的倍数后,重复上述操作,将样品的吸光值代入葡萄糖标准曲线即可得到样品的多糖浓度。
1.2.2.2 总多酚含量测定
采用福林酚法进行样品多酚含量的测定[9]。具体步骤为:采用没食子酸为标准物质,准确称量0.10 g没食子酸,蒸馏水定容于100 mL容量瓶中,配置成1.0 mg/mL的标准储备液。分别吸取0、0.10、0.20、0.30、0.40、0.50 mL的标准储备液定容于100 mL的容量瓶中,配制成浓度为0、0.01、0.02、0.03、0.04、0.05 mg/mL的标准使用液。分别吸取0.50 mL上述各浓度的标准使用液,加入2.50 mL福林酚溶液,室温下反应3~5 min后,加入2 mL 7.50% Na2CO3溶液,室温下反应1 h后,在波长为760 nm处测定吸光度值,每个浓度平行测定三次,以空白管调零,并以没食子酸溶液的浓度为横坐标,吸光值为纵坐标,绘制成标准曲线,其线性方程为y=13.735x+0.0187,且相关系数R²=0.9981,表明此标准曲线线性较好。
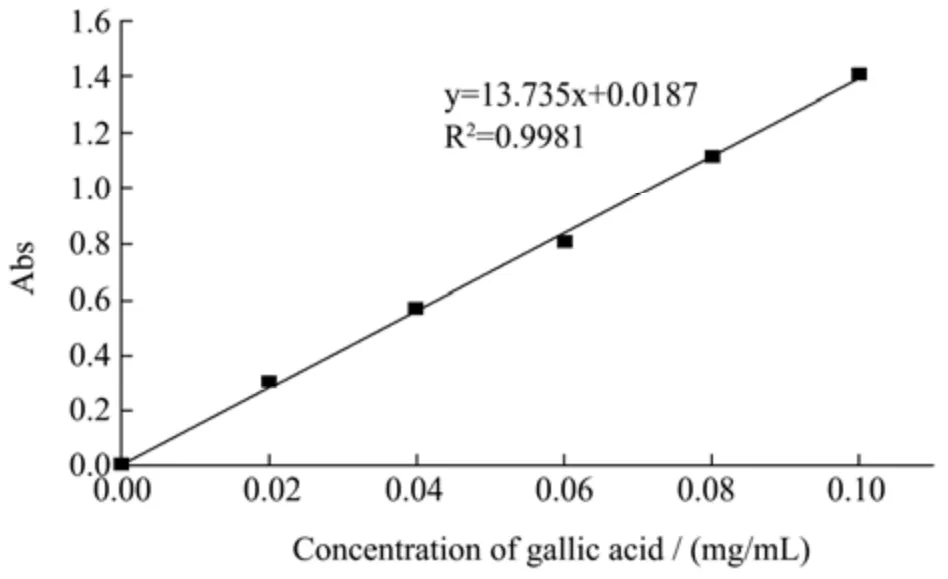
图2 没食子酸标准曲线Fig.2 Standard curve of gallic acid
样品测定方式同上,将待测样品稀释成合适的倍数后,重复上述操作,将样品的吸光值代入标准曲线即可得到样品的多酚浓度。
1.2.3 抗结剂对护胃固体饮料稳定性的影响
根据国家标准GB 2760-2014的规定,二氧化硅在固体饮料中的最大使用量为15.00 g/kg,因此将护胃固体饮料中SiO2或nSiO2的添加量设置为0.30%、0.90%和1.50%等低中高3个剂量。
按比例向护胃固体饮料中加入不同比例的SiO2或nSiO2,灭菌、分装,放入温度37 ℃、湿度75%的恒温恒湿箱中加速保藏一个月[10]。定期取样,检测休止角和堆积密度,分析对比SiO2和nSiO2的抗结作用。
1.2.3.1 休止角的测定
通过休止角的大小来评估粉体的流动性,以评价抗结剂的抗结效果[11]。当颗粒在重力作用下自由下落时,在平面上形成的堆积层斜面上的颗粒所受重力和颗粒之间摩擦力达到静止状态下测得的最大角度。保持的漏斗嘴(直径1 cm)与桌面垂直,下端离桌面高度为5 cm。在桌面上铺一张洁净的白纸,把1 g产品从漏斗口加入,测定产品粉末在白纸上形成锥形的斜面与桌面的角度[12],即为休止角。
1.2.3.2 堆积密度的测定
堆积密度是指产品粉末容易散开的程度,堆积密度越小,越容易散开,颗粒抱团情况越小,更易于溶解在水中。称量一定质量的产品粉末并记录下质量M(mg)。从漏斗中散落到5 mL量筒中,测定产品在量筒中的高度H(mL)[13]。计算堆积密度:
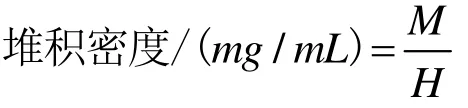
1.2.4 抗结剂对护胃固体饮料护胃功效的影响
1.2.4.1 对正常GES-1细胞的影响
取对数生长期的GES-1细胞消化计数后,接种于96孔细胞培养板中,每孔1×104个。将GES-1细胞随机分为空白对照组及三个实验组(CE、CE+SiO2、CE+nSiO2),其中,SiO2和nSiO2的添加量均为1.50%。每组设置5个复孔。待细胞完全贴壁后,更换培养基,空白对照组加入DMEM培养基100 µL/孔,实验组则分别加入不同浓度(31.25、62.50、125 µg/mL)的样品溶液100 µL/孔,37 ℃、5% CO2孵育24 h后进行MTT试验。
1.2.4.2 乙醇诱导GES-1细胞损伤模型构建
用乙醇进行GES-1细胞损伤模型的构建[14]。取对数生长期的GES-1细胞消化计数后,接种于96孔细胞培养板中,每孔细胞数为1×104个,后放置于培养箱中培养24 h至细胞基本贴壁,培养条件为:37 ℃、5% CO2。用DMEM培养基将无水乙醇稀释成2.00、1.60、1.40、1.20、1.00、0.80、0.60、0.40、0.20、0.10 mol/L,分别加入各孔中,每孔100 µL。每一稀释浓度设置5个复孔,同时设立空白对照组。37 ℃、5% CO2分别孵育2、4、6 h后进行MTT试验。
1.2.4.3 对乙醇损伤GES-1细胞模型的影响
取对数生长期的GES-1细胞消化计数后,接种于96孔细胞培养板中,每孔1×104个。将GES-1细胞随机分为5组,空白对照组、模型组以及三个实验组(CE、CE+SiO2、CE+nSiO2),其中,SiO2和nSiO2的添加量均为1.50%。每组设置5个复孔。待细胞完全贴壁后,更换培养基,空白对照组和模型组加入DMEM培养基100 µL/孔,实验组则分别加入不同浓度(31.25、62.5、125 µg/mL)样品溶液100 µL/孔,继续孵育24 h。除空白对照组外,其余各组加入1.0 mol/L乙醇溶液100 µL/孔进行造模,37 ℃、5% CO2孵育2 h后进行MTT试验。
1.2.5 数据处理
所有细胞实验均进行3次平行实验得出,数据结果均采用平均值±标准差(mean±SEM)的形式展示。实验数据采用SPSS 22.0软件进行统计分析,采用单向方差分析(ANOVA),使用Tukey的分析比较所有组之间的显著差异,p<0.05视为统计学意义上具有显著性差异。实验数据图表采用Prism 6.0和Origin 8.5进行绘制。
2 结果与讨论
2.1 护胃固体饮料理化性质
多糖和多酚被认为是胃黏膜保护的主要生物活性物质。已有研究表明多糖和多酚可以通过减少氧化应激、炎症和细胞损伤对胃粘膜损伤提供重要的保护作用[15,16]。护胃固体饮料的三种中草药原料的主要活性成分为多糖或类黄酮。其中,黄芪和茯苓的主要活性成分是多糖,葛根的主要活性成分是多酚。所以此护胃固体饮料的理化性质主要是对总多糖和总多酚含量的测定。
如表1所示,此护胃固体饮料的主要成分是多糖,含量约为60%,同时含有约4%的多酚。且两种样品的总多糖和总多酚含量均无显著性差异。

表1 护胃固体饮料理化性质测定结果Table 1 Measurement results of physical and chemical properties of solid beverages
许多研究表明,类黄酮可以与多糖反应形成不同的复杂微结构,并可能影响多糖和类黄酮的理化性质和生物学活性。黄酮类化合物可能与多糖具有协同增效的作用[17]等。Pirvu等人[18,19]研究发现,由多糖和多酚组成的矢车菊提取物,对氧化应激引起的中度和浅层胃黏膜损伤都具有较好的功效,甚至比雷尼替丁这种药物具有更好的护胃效果。
2.2 抗结剂对护胃固体饮料稳定性的影响
如图3所示,随着储藏时间的增加,各组样品的休止角逐渐增加。其中,SiO2组和nSiO2组休止角,均比空白对照组小。且SiO2和nSiO2添加量越大,休止角越小。当SiO2和nSiO2添加量达到1.50%时,在第28 d时,SiO2组和nSiO2组的休止角分别为152 °和153 °,明显低于空白对照组(162 °)(p<0.005)。在同等添加量的条件下,SiO2组休止角略低于nSiO2组,但无显著差异。Silverberg等指出在贮存过程中物料晶体的交互生长引起的颗粒间粘连是物料结块的主要机理[20],而SiO2则可以通过抑制颗粒间的粘连来改善物料的流动性。Tonglairoum等人[11]将SiO2添加到粉末混合物中,通过测定休止角来评估其抗结性能,结果发现SiO2可以改善混合物的流动性,具有较好的抗结作用。
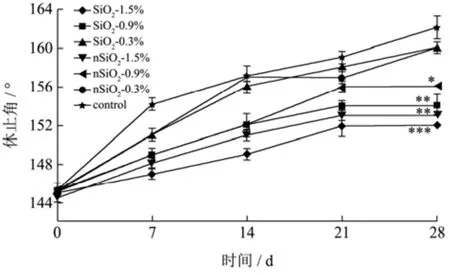
图3 不同样品连续4周的休止角Fig.3 Angle of repose of different samples for 4 weeks
如图4所示,随着储藏时间的增加,各组样品的堆积密度也逐渐增加。与空白对照组相比,SiO2和nSiO2组的样品堆积密度增长较小。在第28 d时,1.50% SiO2和1.50% nSiO2组的堆积密度分别为2.17 mg/mL和2.33 mg/mL,均明显小于空白对照组(3.33 mg/mL)(p<0.005)。在同等添加量情况下,SiO2组堆积密度略低于nSiO2组,但差异并不明显。这与Nortuy等人[21]的研究结果一致,他们发现通过增加SiO2的含量或增大粒径可以减少固体颗粒的聚集。
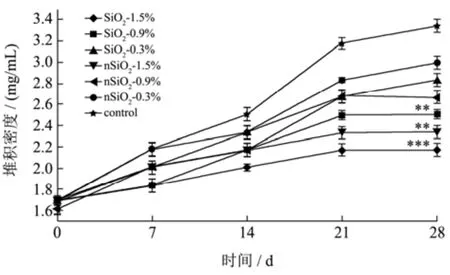
图4 不同样品连续4周的堆积密度Fig.4 Bulk density of different samples for 4 consecutive weeks.
因此,综合休止角和堆积密度两个指标来看,SiO2和nSiO2均有一定的抗结作用,其中SiO2的抗结效果略高于nSiO2,但二者并无明显差异。
2.3 抗结剂对固体饮料护胃功效的影响
2.3.1 促进GES-1细胞增殖
如图5所示,CE、CE+SiO2和CE+nSiO2均能促进GES-1细胞的增殖,并呈现明显的剂量-效应关系。在31.25 μg/mL浓度条件下,CE+nSiO2组的细胞存活率为166%,明显高于CE(116%)和CE+SiO2(132%)组(p<0.005)。而在62.5 μg/mL和125 μg/mL的浓度条件下,与CE组相比,其余两个样品组并无显著差异。可见,SiO2和nSiO2的添加,对CE促进GES-1细胞增殖的功效并无不利影响,其中较低浓度的nSiO2还有助于增强CE的功效。有研究也得到了类似的结果。Anja Wittig[22]等人研究了不同粒径SiO2对人胃癌细胞的毒性影响,表明SiO2能较好刺激细胞增殖,在较低浓度时会增加的总细胞数和细胞活力,但是随着浓度的增加,则会有细胞毒性,并且不同的粒径的SiO2对细胞毒性有不同的影响。Oberdörster等人研究发现,nSiO2不会造成胃黏膜细胞GES-1细胞膜损伤、形态改变、细胞的凋亡与坏死[23]。Yixin Yang等人[24]研究10~50 nm范围内四种不同粒径的nSiO2对GES-1细胞形态、生存力和膜完整性的影响,发现在低于100 µg/mL的浓度下细胞存活率几乎没有变化,甚至可以促进细胞增殖;但若继续增加nSiO2浓度和延长时间,细胞活力则会显著降低。
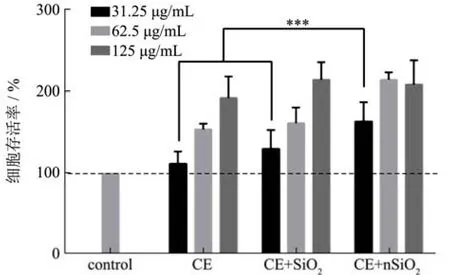
图5 护胃固体饮料对正常GES-1细胞的影响Fig.5 Effect of solid drinks on GES-1 cell
2.3.2 GES-1细胞损伤模型
乙醇型胃黏膜损伤模型是一种急性胃黏膜损伤模型。乙醇能直接作用于胃黏膜,导致胃黏膜出现糜烂、出血、穿孔等损伤[25]。乙醇在引起胃黏膜氧化应激的同时,伴随着胃黏膜细胞的坏死和调亡[26]。因此选择用乙醇对GES-1细胞进行造模,在体外模拟乙醇造成的胃黏膜损伤。
图6 为不同浓度的乙醇作用4 h后GES-1细胞的形态变化。GES-1细胞是由人胎儿胃黏膜上皮细胞转染SV-40病毒后获得的永生化的细胞系,可以在体外稳定传代,但保留了正常的细胞骨架结构[27]。正常GES-1细胞为梭形,细胞之间排列稀疏,贴壁正常,漂浮的死亡细胞较少。与空白对照组相比,乙醇高浓度模型组(1.20、1.60、2.00 mol/L)出现明显的细胞皱缩变小,成圆形,贴壁细胞数量减少,漂浮的死亡细胞增多,细胞间隙增大,即发生细胞损伤。有研究观察到了同样的现象,发现乙醇会引起GES-1细胞的细胞形态出现皱缩并形成调亡小体[28]。乙醇可在短时间内诱导GES-1细胞调亡,且多为早期调亡,随着作用时间的延长、乙醇浓度的增加,细胞调亡现象越为明显[14]。

图6 GES-1细胞经不同浓度乙醇作用4 h的显微镜采集图像Fig.6 Images of GES-1 cells treated with ethanol at different concentrations for 4 h using microscope
不同浓度的乙醇诱导的GES-1细胞损伤的存活率具有显著性差异(p<0.05)。随着乙醇浓度的升高,细胞的存活率逐渐降低,呈现一定的剂量浓度效应。如图7a~7c所示,当乙醇作用时间分别为2、4、6 h、乙醇浓度为1.00 mol/L时,GES-1细胞的存活率均为50%~60%,随着浓度继续增大,细胞存活率继续降低,当乙醇浓度超过1.20 mol/L时,细胞存活率均小于40%,因此,乙醇造模浓度为1.00 mol/L。如图7d所示,当乙醇浓度为1.00 mol/L时,随着作用时间的增加,细胞存活率逐渐降低,为保证实验的结果可靠性,应选择细胞存活率为60%,相应的乙醇作用时间为2 h。因此,选择以1.00 mol/L乙醇诱导2 h,构建GES-1细胞损伤模型。刘翠玲[29]的研究结果表明,细胞的存活率与乙醇浓度和造模时间密切相关,并且以0.80 mol/L乙醇作用4 h得到的细胞模型比较稳定。
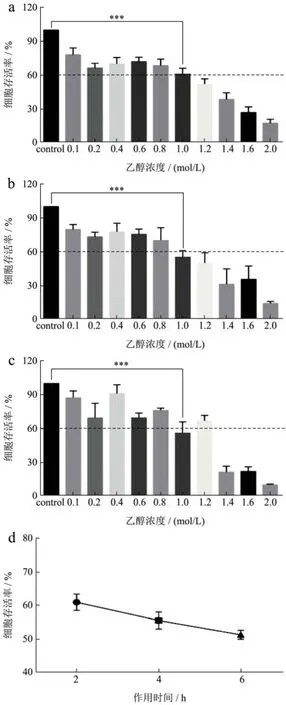
图7 不同乙醇浓度及不同作用时间对细胞存活率的影响Fig.7 Effect of different ethanol concentrations and different action times on cell survival
2.3.3 预防乙醇损伤
以样品作用GES-1细胞一段时间后以乙醇造模,分析对比细胞存活率的情况,可研究其对乙醇损伤胃黏膜细胞的预防作用,以此评价护胃功效[28]。如图8所示,与空白对照组相比,模型组的细胞存活率明显下降至55%,说明1.00 mol/L乙醇作用2 h对GES-1细胞具有明显的损伤作用,表明GES-1细胞损伤模型造模成功。以CE、CE+SiO2或CE+nSiO2作用GES-1细胞24 h,可明显提高受损GES-1细胞的存活率(p<0.005),并且呈现一定的剂量-效应关系,说明三种样品都具有明显的预防乙醇损伤GES-1细胞的作用。在31.25 μg/mL浓度下,CE+nSiO2组的细胞存活率为110%,明显比CE(90%)和CE+SiO2(88%)组更高(p<0.005)。而在62.5 μg/mL和125 μg/mL浓度条件下,三个样品组并无明显差异。由此可见,SiO2和nSiO2对CE预防乙醇损伤胃黏膜细胞的功效并无不利影响,而较低浓度的nSiO2甚至还可增强CE对乙醇损伤胃黏膜细胞的预防作用。这与Zhao Zh等人[30]的研究结论一致,表明可以通过样品对乙醇诱导的GES-1细胞显示出保护活性来评价样品的护胃功效。Zhang Y等人研究发现,nSiO2可以有效提高药物的跨膜率[31],这可能是CE对乙醇诱导胃黏膜细胞保护作用增强的机制之一。
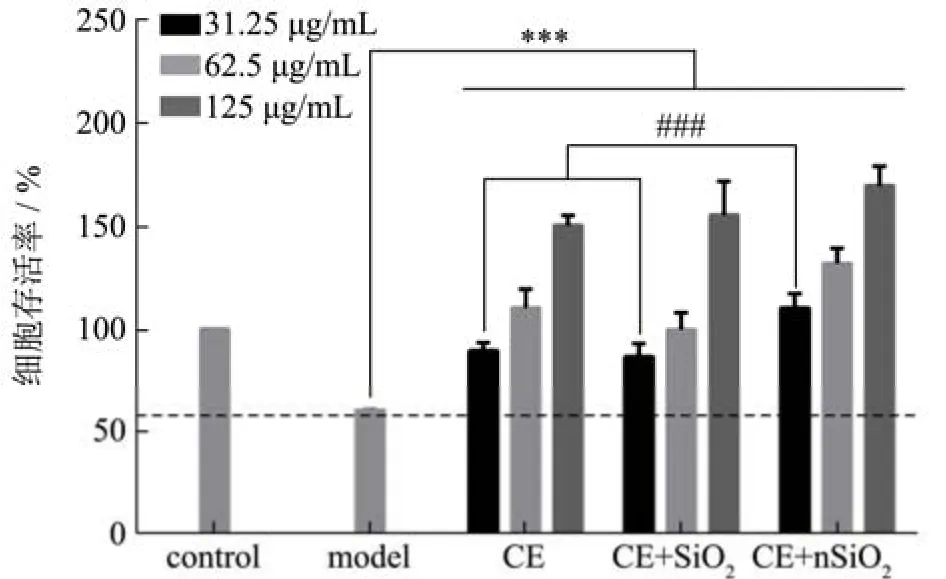
图8 护胃固体饮料对受损GES-1细胞存活率的影响Fig.8 Effect of solid drinks on the cell viability of injured GES-1 cells
3 结论
综上所述,SiO2和nSiO2均有一定的抗结作用,其中SiO2的抗结效果略高于nSiO2,但二者并无明显差异。SiO2和nSiO2的添加,对固体饮料促进GES-1细胞增殖的功效并无不利影响,同时也不会影响其预防乙醇损伤胃黏膜细胞的功效,并且在浓度为31.25 μg/mL时,nSiO2还可有助于增强固体饮料的护胃功效。该研究可以为nSiO2的进一步研究及其在功能性食品中的应用提供参考。
