河豚毒素在暗纹东方鲀体内的转移分布规律及相关代谢酶活性分析
2021-06-30卢义博曾军杰陈思王瑞瑞张小军
卢义博,曾军杰,陈思,王瑞瑞,张小军
(1.浙江海洋大学水产学院,浙江舟山 316021)(2.浙江省海洋水产研究所,浙江舟山 316021)
(3.浙江海洋大学食品与药学学院,浙江舟山 316021)
暗纹东方鲀(Takifugu obscurus)主要分布在中国近海和长江中下游,其肉质鲜美,营养价值丰富,但是野生河豚鱼体内均含有河豚毒素(Tetrodotoxin,TTX)可致人死亡。TTX是一种强效的海洋神经毒素,由Yoshizumi Tahara在1909年首次发现[1],在1964年由Woodward、Hirata Yoshimasa和TsudaKyosuke同时确证了河豚毒素的正确结构[2]。TTX作为一种高度选择性的钠通道阻滞剂,可与肌肉或神经细胞的细胞膜上受体结合,从而使钠离子通道关闭,降低Na+通道传导性,阻断动作电位,抑制神经和肌肉之间的兴奋传导,导致肌肉和神经麻痹,情况严重时,可致人死亡[3]。河豚毒素的毒性属于剧毒物质,人体的最小致死量为0.5 mg[4]。目前,已在多种海洋生物和陆地生物种检测出河豚毒素,日本[5]、中国[6]、泰国[7]、巴西[8]等多个国家发现多起河豚毒素中毒事件。
目前,关于河豚毒素的起源仍存在争议。Yasumoto[9]和Noguchi[10]认为河豚鱼可能并不能够产生河豚毒素,而是通过食物链获得毒素。Matsui等[11]、Yamamori等[12]、Honda等[13]、Kono等[14]发现,经过长期人工养殖和培育的河豚鱼其体内不含有河豚毒素,但是通过投喂含有河豚毒素的饲料后又重新获得毒性。因此,河豚鱼必然存在相应的耐受机制来应对河豚毒素的蓄积。肝脏作为生物体内中最重要的代谢器官,其组织中含有大量丰富的代谢酶。谷草转氨酶(AST)和谷丙转氨酶(ALT)是肝脏生化反应中不可或缺的催化剂,是肝功能测试的重要指标[15]。碱性磷酸酶(AKP)和酸性磷酸酶(ACP)在机体生长代谢和生理健康过程中起发挥重要作用,同时是检测机体受到损伤的重要指标[16]。乳酸脱氢酶(LDH)参与多种供能反应,在能量代谢过程当中发挥重要作用[17]。
本实验选择国内开放养殖的暗纹东方鲀为研究对象,采用口服灌喂河豚毒素的方法,利用超高效液相色谱串联质谱法(UPLC-MS/MS)测定河豚毒素在不同时间的组织含量,分析暗纹东方鲀体内的河豚毒素分布转移规律,为河豚鱼养殖提供指导建议,同时测定肝脏组织中五种代谢酶的活力,初步探讨了暗纹东方鲀对河豚毒素的耐受性。
1 材料与方法
1.1 实验动物与饲养
实验动物采购地点为福建省漳州市东坂村,品种为暗纹东方鲀,实验鱼个体平均体长15.4±0.7 cm,平均体重232±25 g。采用GB 5009.206-2016方法对实验鱼进行UPLC-MS/MS检测得出本批次实验鱼各组织中均不含有TTX。
将暗纹东方鲀体长置于120 L淡水(盐度8‰~10‰)中,每个水箱10尾,温度22~25 ℃。溶氧量大于6 mg/L,氨氮量小于1 mg/L,增氧机24 h全开,自然光照。在进行灌喂实验之前,配合饲料喂养7 d。每天投喂1次,投喂量根据鱼重(湿重)3%计算。
1.2 实验饵料准备
健马牌鳗鱼配合饲料,粉末状,水分含量小于10%,粗蛋白含量大于43%,粗纤维含量小于4%,氨基酸含量大于2.1%,粗灰分含量下小于18%,总磷含量大于1%。
河豚毒素粗提取物由本实验室从河鲀肝脏中提取纯化获得,浓度为8.5 μg/mL。将饲料、水与河豚毒素粗提取物充分混合均匀,使其TTX的含量为850 ng/mL。
1.3 试剂与材料
河豚毒素标准品,纯度≥98.0%,德国Dr.Ehrenstorfer公司;甲醇、乙腈均为色谱纯,德国Merck公司;甲酸、氯化钠(NaCl)、二水合磷酸二氢钠(NaH2PO4·2H2O)、十二水合磷酸氢二钠(Na2HPO4·12H2O)、氢氧化钠(NaOH),上海国药集团;甲酸、醋酸铵均为色谱纯,美国Sigma公司;实验用水为超纯水;河豚毒素免疫亲和柱,北京美正生物科技有限公司,柱容量:1000 ng;总蛋白定量测试盒、乳酸脱氢酶测试盒、谷草转氨酶、谷丙转氨酶测试盒、碱性磷酸酶、酸性磷酸酶试剂盒,订购于南京建成生物工程研究所。
河豚毒素标准溶液配制:准确称取河豚毒素标准品5.00 mg,使用0.1%甲酸5 mmol/L乙酸铵溶液-乙腈(1:1,V/V)的混合溶液充分溶解后准确定容至50 mL,4 ℃下避光储存6个月,使用时用0.1%甲酸5 mmol/L乙酸铵溶液-乙腈(1:9,V/V)的混合溶液逐级稀释。
0.05 mol/L磷酸缓冲盐溶液(PBS):分别称取NaCl 4.25 g、NaH2PO4·2H2O 1.09 g、Na2HPO4·12H2O 6.45 g,用超纯水定容至500 mL,pH约为7。
1.4 仪器与设备
AcquityTM超高效液相色谱仪、Quattro Preemier XE串联三重四级杆质谱仪,美国Waters公司;LPD2550型多管涡旋混合仪,莱普特科学仪器有限公司;Avanti JXN_30高速冷冻离心机,美国Beckman Coulter公司;Nitrogen Evaporator 112型氮吹仪,美国Organomatio公司;超声波清洗器,上海易净超声波仪器有限公司;固相萃取仪,上海那艾精密仪器有限公司;缸外过滤器HW-704B,森森水族公司;盐度计,台湾衡欣公司;交直流电增氧泵S-600BX、MK3微孔板酶标仪,美国ThermoLabsystems公司;可见风光光度计,美国瓦里安公司。
1.5 实验设计与取样
将暗纹东方鲀分成空白对照组和灌喂剂量组,空白对照组灌喂水与饲料混合液,灌喂剂量组灌喂含量为850 ng/mL的水、饲料、河豚毒素粗提取物的混合饲料。每组设三个重复组。实验操作如下:取一根特氟龙管(外径=3 mm,长度为70 mm)与5 mL注射器相连,将混合的饲料匀浆1 mL尽可能深地插入河豚鱼的消化道,然后将1 mL含TTX的饲料匀浆挤入消化道,分别灌喂后,保持鱼身直立3~5 min,观察河豚鱼是否通过鳃排泄饲料匀浆溶液。随后将河豚鱼放回暂养池中,实验期间的投喂与管理与暂养期间相一致,每天观察河豚鱼的生理情况,及时清理水池污染物和补充新鲜干净水体。
从实验鱼灌喂饲料匀浆前作为起始0 h同时进行计时观察和记录。实验选择在0 h、2 h、4 h、6 h、12 h、24 h、48 h、72 h、168 h、336 h分别取样,每次取3条河豚鱼,同时记录每条鱼的体重。分别收集皮肤、肌肉、肝脏、血液(肝动脉取血)、肾脏、胆、脾、肠道、鳃各组织,将各组织用4 ℃的PBS缓冲盐溶液冲洗杂质和血液。取1 mL血液和2 g肝脏储藏在-60 ℃的冰箱中独立储存,其余样品均质后放置-20 ℃冰箱中待测。
1.6 不同组织中河豚毒素的提取、净化
河豚鱼体内的河豚毒素提取参照国标GB 5009.206-2016并做出适当修改:称量肌肉、皮肤、肝脏等器官均质样品2 g(少于2 g的组织样本全部称量)或血液2 mL于50 mL具塞离心管中,使用10 mL 2%乙酸-甲醇提取,涡旋振荡5 min,60 ℃水浴超声提取15 min,分别在5 min和10 min时涡旋30 s。取出恢复常温,8000 r/min离心7 min。取上清液5 mL与20 mL PBS缓冲盐溶液混合均匀。加入适量1 mol/L NaOH溶液使pH至6.8~7.2之间,过柱待测。
1.7 TTX检测方法
1.7.1 色谱条件色谱柱:Waters Acquity UPLC BEH Amide柱(100×2.1 mm,1.7 μm);进样量5 μL;样品室温度10 ℃;柱温40 ℃;流速:0.3 mL/min;流动相A:0.1%甲酸5 mmol/L乙酸铵溶液,流动相B:乙腈;梯度洗脱条件如下:0~1.5 min,90%~90% B;1.5~2 min,90%~40% B;2~4 min,40%~40% B,2~4 min,40%~90%,B。
1.7.2 质谱条件
离子源:电喷雾离子源(electorspray ionization,ESI),正离子模式扫描;检测方式:多反应监测模式(multiple reaction monitoring,MRM);毛细管电压:3.5 kV;离子源温度:120 ℃;脱溶剂气温度:385 ℃;脱溶剂气流量:800 L/h;锥孔气流量:55 L/h;检测参数条件见表1。

表1 河豚毒素质谱检测参数Table 1 Detection parameters of tetrodotoxin mass spectrometry
1.7.3 标准曲线的配制及回收率与精密度的考察
用0.1%甲酸5 mmol/L乙酸铵溶液-乙腈(1:9,V/V)的初始流动相稀释TTX标准品使用液,配制成浓度为1.00 ng/mL、2.00 ng/mL、5.00 ng/mL、10.00 ng/mL、20.00 ng/mL、50.00 ng/mL、100.00 ng/mL的标准曲线。外用外标法定量,以TTX的物质含量为横坐标,定量离子峰面积为纵坐标进行线性回归。
分别称量阴性暗纹河豚鱼肌肉、皮肤、肝脏、肠道、鳃2 g;血液2 mL;肾脏、胆、脾、性腺适量,添加一定量TTX标准品使用液,使其不同组织浓度分别为1.00 ng/mL、5.00 ng/mL、10.00 ng/mL,平行样本数量为3,计算回收率和相对标准偏差。
1.8 肝脏代谢酶的检测
总蛋白的测定采用BCA法测定;AST和ALT均采用King氏法测其酶活性,单位定义为:25 ℃时,1 min内产生的丙酮酸与NADH发生氧化反应产生NAD+,使得吸光度下降0.001位时为1个活力单位。AKP和ACP的酶活力采取比色法测定,其活力单位为:100 mL血清在37 ℃与底物反应30 min生成1 mg酚为1个活力单位。LDH酶活力使用比色法测定,活力单位为:每克组织蛋白37 ℃与基质作用15 min,反应体系中产生1 μmol丙酮酸为1单位。
1.9 数据处理分析
实验结果用SPPS 26.0统计与分析。相关性分析选择皮尔逊系数,单因素方差分析采用邓肯检验进行多重比较,p<0.05表示具有显著差异性。Excel 2016作图分析。
2 结果与讨论
2.1 标准曲线及回收率与精密度
实验数据显示,TTX的浓度范围在1.00 ng/mL~100.00 ng/mL时线性关系较好,回归方程式为y=1375.18x-53.0638,r2>0.9999。
在本实验条件下,肌肉、肝脏、皮肤、血液等不同组织中TTX的平均回收率均在75.37%~90.64%,实验相对标准偏差为3.09%~8.08%,小于10%。结果表明本方法回收率和精密度可以满足检测分析要求,适用于河豚鱼各组织中的河豚毒素检测。
2.2 给药方式及剂量选择
目前关于河豚毒素的给药方式主要分为三种,有毒饮食喂养(Toxic diet-feeding,TDF)、肌肉给药(Intramuscular administration,IMA)和口服灌喂给药(Oral gavage administration,OGA)[18]。有毒饮食喂养具有准确模拟自然界进食的特点,但是存在个体受药不均匀的现象,投喂耗时长、鱼体之间平行性较差的缺点。肌肉给药方式可以快速准确定量给药并且同时保证鱼体平行性,但是肌肉注射破坏河豚鱼的免疫防御系统,从而产生应激反应,导致体内酶活力的改变,从而难以区分河豚毒素带来的分子差异。口服灌胃给药方式综合了有毒饮食喂养和肌肉给药两种方式的优点,即耗时短,准确定量、平行性好,同时也能够避免给药方式对河豚鱼带来生理影响。
TTX毒性较强,研究表明,兔子的肌肉体内注射的最小致死量(MLD)为5.30 μg/kg,小鼠腹腔注射半数致死量(LD50)10.70 μg/kg[19]。综合实验室河豚毒素粗提取物的浓度以及暗纹东方鲀的状态,选择灌喂河豚毒素浓度为850 ng TTX/mL混合匀浆饲料1 mL,即850 ng河豚毒素。
2.3 TTX在暗纹东方鲀体内的转移分布律
在不同转移时间的条件下,排除无法定量的血液,暗纹东方鲀对河豚毒素吸收率如表2所示。
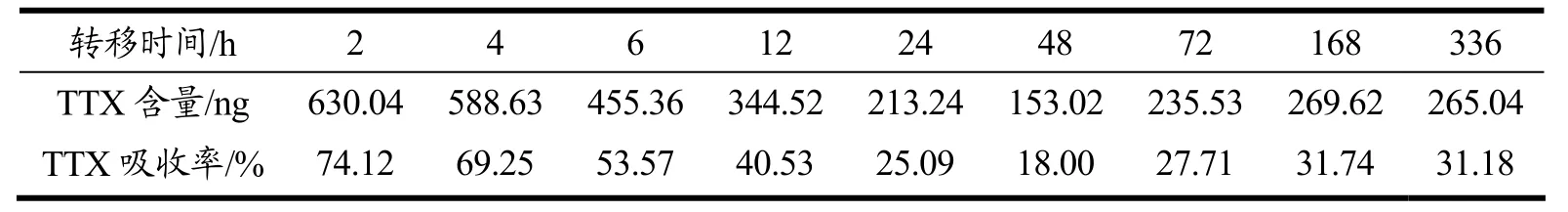
表2 暗纹东方鲀在不同转移时间下TTX的吸收率Table 2 TTX absorption rate of Takifugu obscurus under different transfer time
数据显示,灌喂2 h后河鲀鱼对TTX的吸收率最高,随后时间的增加而逐渐的减少,在48 h时,TTX的残留量达到最低,为18.00%;随后TTX的残留量会出现低幅度的上调,在最长转移时间内,残留量大约稳定31%。
为了探讨TTX的转移规律,实验分别对不同时间下暗纹东方鲀各组织中的TTX含量变化和各组织的相对毒素量(占投毒总量的百分比)进行分析,结果如图1和图2所示。在暗纹东方鲀中经灌喂给药到肠道的TTX被吸收到体内,且主要转移到肝脏、皮肤、肌肉和性腺。肠道中TTX相对毒物量随着时间的增加而逐渐减少,这有可能是因为肠道可以作为吸收屏障阻碍TTX的吸收,或者是TTX迅速被肠道中的酶分解为本实验未检测出的代谢物[20]。在2 h时,鳃组织中的TTX含量浓度最高为31.75 ng/g,此时该组织的相对毒物量为12.44%。在实验灌喂过程中发现暗纹东方鲀可以通过鳃将灌喂的TTX匀浆饲料排泄出来,说明暗纹东方鲀在口服灌胃给药的方式下,鳃是最主要的排泄器官。
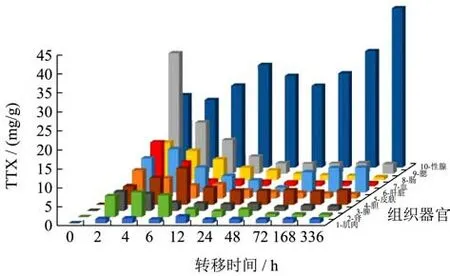
图1 短期灌喂下暗纹东方鲀各组织中的TTX浓度变化Fig.1 Changes of TTX concentration in various tissues of Takifugu obscurus under short-term irrigation
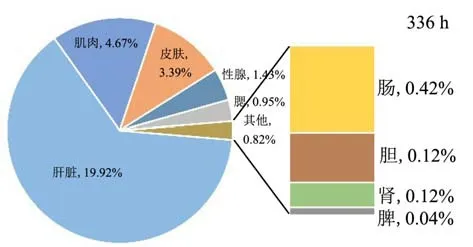
图2 2、48、336 h时暗纹东方鲀各组织中TTX相对毒素量Fig.2 The relative amount of TTX toxin in each tissue of Takifugu obscurus at 2 h, 48 h and 336 h
性腺组织TTX的浓度在整个转移过程中一直处于较高水平,TTX的浓度随着时间的增加而增加,相对毒物量由0.47%逐渐上升至1.43%,TTX含量从19.00 ng/g升到42.02 ng/g,蓄积率为121%。肝脏中的TTX浓度普遍低于性腺,但是均高于皮肤中TTX的浓度。Ryohei Tatsuno等[21]通过灌喂不同月龄的红鳍东方鲀发现,6月龄的幼鱼,毒素含量主要集中在皮肤,其次是肝脏,而15月龄的河豚鱼其主要蓄积器官为肝脏,其次是皮肤和性腺。Vaishali Bane等[22]发现,发育成熟期的河豚鱼,皮肤中的TTX逐渐转移至肝脏,在性成熟时期,肝脏组织中的TTX逐渐转移至性腺,主要是卵巢。本实验选择接近性成熟的暗纹东方鲀,肝脏发育完全,性腺接近成熟,因此性腺是本实验的主要蓄积器官,肝脏次之。同时实验发现,各脏器包括肾脏、脾脏、胆在转移分布前期TTX的浓度呈先升后降的趋势,作为生物代谢的主要反应器官,推测各组织参与了TTX前期的代谢和消除。肝脏中TTX的含量在48 h时降至最低为1.27 ng/g,相对毒物量为3.47%,但肝脏作为第二蓄积器官在48 h后组织中的TTX逐渐增加,在转移后期相对毒物量均占比第一。

Takuya Matsumoto等[23]认为河豚鱼可通过与特定的蛋白(PSTBP)相结合,从而降低与钠离子通道的结合所带来的神经毒性,以此来提高河豚鱼对TTX的耐受性。此外,Mari Yotsu-Yamashita等[24]在2001年首次从豹纹东方鲀的血液中分离此蛋白,并且Mari Yotsu-Yamashita等[25]在2003年通过免疫组织化学染色法发现豹纹东方鲀中肝脏、肠道、皮肤和卵巢均含有PSTBP。本实验发现皮肤和血液组织中的TTX含量在灌喂初期最高,分别为7.43 ng/g和11.44 ng/g,此后随着时间的增加而逐渐降低,因此推测皮肤和血液可能通过PSTBP参与TTX的转运过程。
2.4 五种肝脏代谢酶的活力变化
2.4.1 不同时间下暗纹东方鲀肝脏中乳酸脱氢酶(LDH)活力变化
随着转移时间的增加和肝脏中TTX的含量不断改变,肝脏中的LDH活力变化如图3所示。SPSS双变量相关分析得出,LDH活力与TTX的含量的相关系数0.415,p=0.233(p>0.05),说明两者之间相关不显著。肝脏中的LDH活性呈波动性变化,首先在0~24 h时先升高后降低,在第6 h出现峰值,且峰值显著性高于其它值(p<0.05)。其次在24 h后逐渐趋于稳定状态,且无明显差异(p>0.05),此时LDH活力高于0 h,即灌喂TTX后暗纹东方鲀肝脏中LDH活力略微升高。LDH是糖无氧酵解及糖异生反应中的重要参与酶,在生物氧化还原反应中发挥重要作用,JonnA.Berges等[26]研究发现LDH可以作为衡量无氧代谢水平的检测指标之一。LDH活力升高说明灌喂TTX后河豚鱼无氧代谢反应旺盛,糖酵解反应持续进行,可为组织器官转移代谢河豚毒素提供了能量,提高了机体的耐受量。
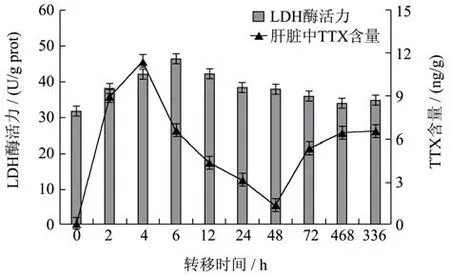
图3 灌喂TTX后不同时间下肝脏中LDH活力和TTX含量的变化Fig.3 Changes of LDH activity and TTX content in the liver at different times after feeding TTX
2.4.2 不同时间下暗纹东方鲀肝脏中转氨酶活力变化
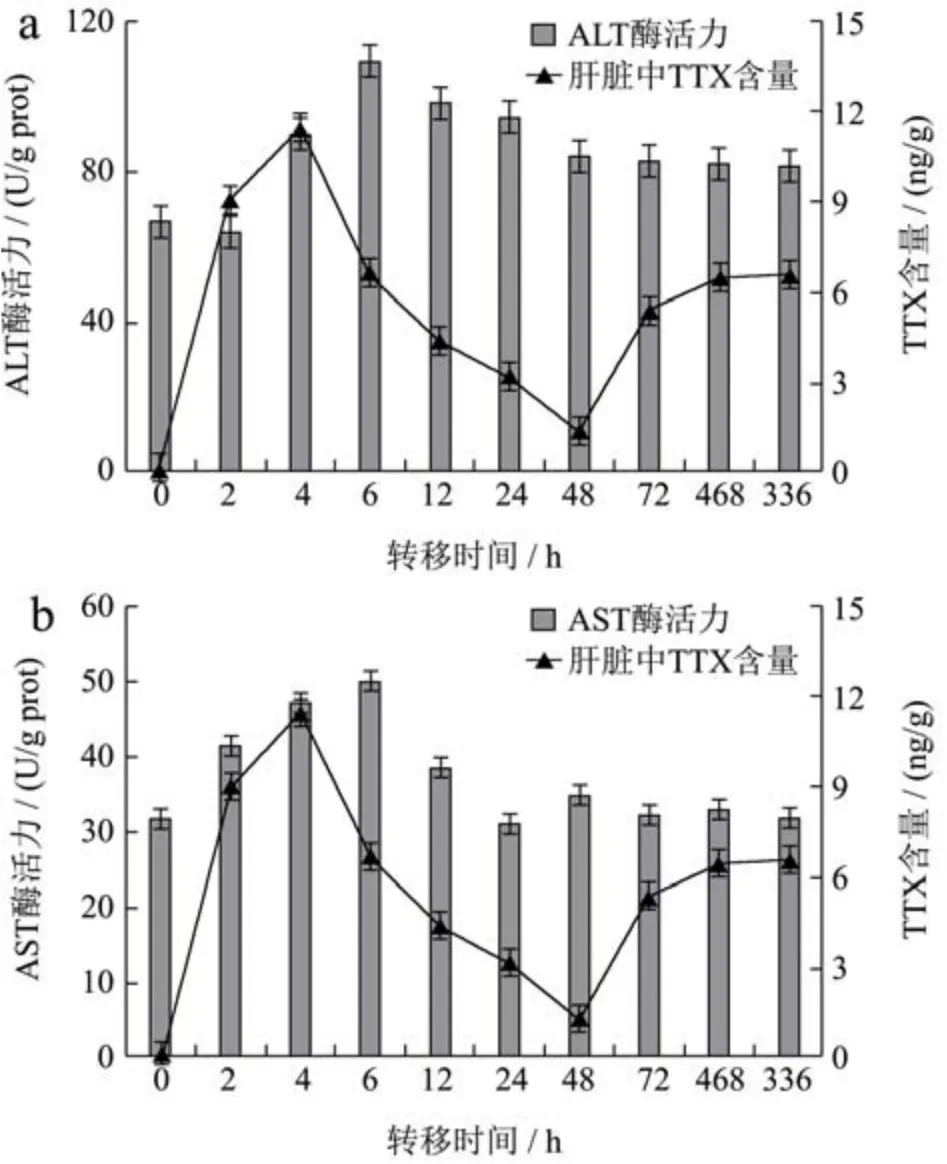
图4 灌喂TTX后不同时间下肝脏中ALT(a)和AST(b)活力与TTX含量的变化Fig.4 Changes of ALT (a) and AST (b) activity and TTX content in the liver at different times after feeding TTX
肝脏中TTX含量及ALT和AST活性随时间的变化趋向如图所示。SPSS双变量相关分析得出,ALT活性与TTX的含量的相关系数为0.109,p=0.765(p>0.05),说明两者之间相关不显著。AST活力与TTX的含量的相关系数为0.649,p=0.042(p<0.05),说明两者之间显著相关。
ALT和AST活力变化趋势相似,呈先升高后降低最终趋于稳定的趋势。ALT和AST活力在6 h时达到最高点(p<0.05),在48 h后逐渐趋于稳定(p>0.05),此时两种酶活力的值均高于对照组。2010年Mari Yotsu-Yamashita等[27]发现,可通过改变河豚鱼组织中钠离子通道的氨基酸序列进而提高机体对TTX的耐受性。因此推测转氨酶活力的提高有利于河豚鱼体内蛋白质转化为游离氨基酸,从而与LDH共同提供河豚鱼转运河豚毒素所需的能量以及增加钠离子通道中氨基酸的丰富度。
2.4.3 不同时间下暗纹东方鲀肝脏中磷酸酶活力变化
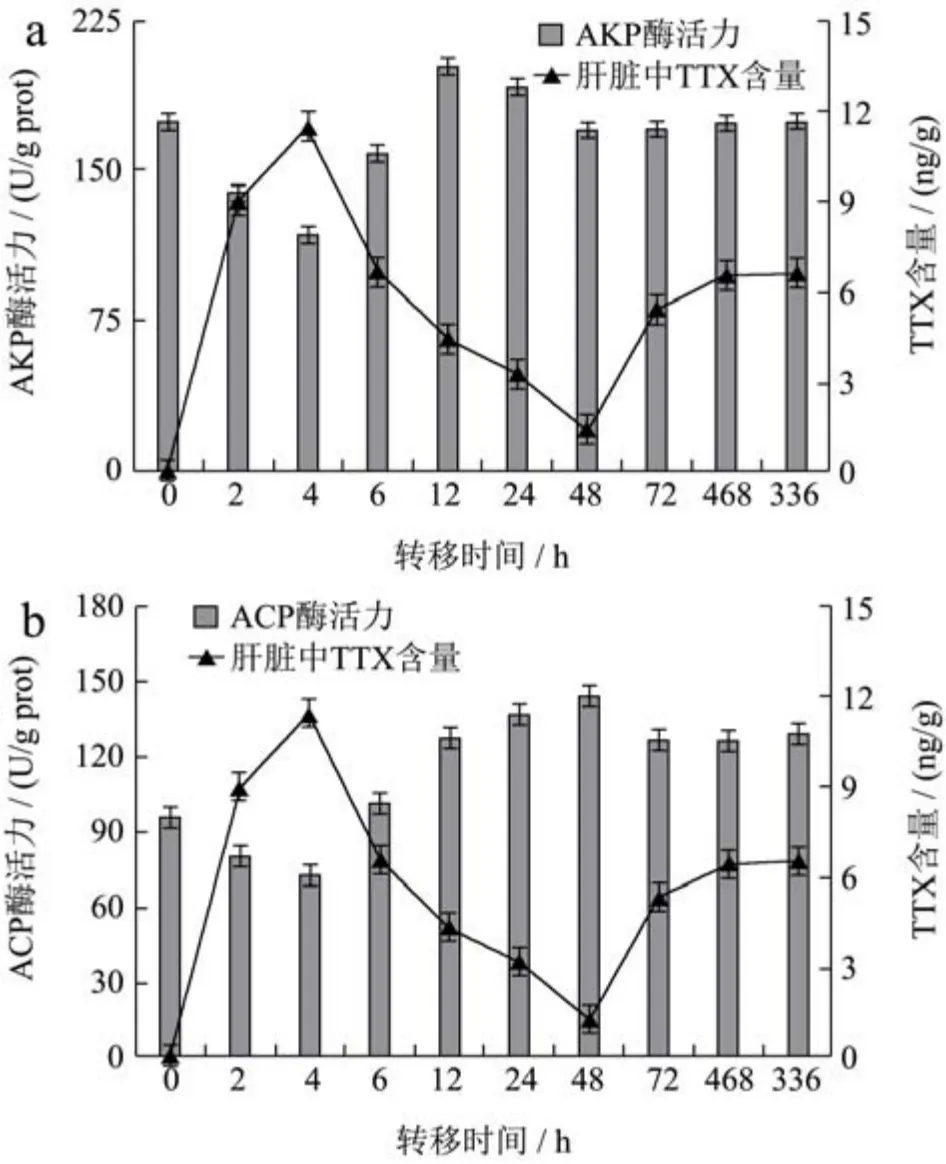
图5 灌喂TTX后不同时间下肝脏中AKP(a)和ACP(b)活力与TTX含量的变化Fig.5 Changes of AKP (a) and ACP (b) activity and TTX content in the liver at different times after feeding TTX
肝脏中TTX含量及AKP和ACP酶活性随时间的变化趋向分别如图所示。相关分析得出,AKP酶活力与TTX的含量的相关系数为0.718,p=0.019(p<0.05),说明两者之间显著相关。ACP酶活力与TTX的含量的相关系数为0.589,p=0.072(p>0.05),说明两者之间相关不显著。
磷酸化和去磷酸化是生物机体新陈代谢的过程,其中磷酸酶是该反应不可或缺的催化剂,其中AKP和ACP同时是机体判断健康状态和免疫功能的重要参数。在本实验中,AKP活力和ACP活性变化趋向相近,呈先下降后上升最终趋于稳定。AKP和ACP活力在4 h时降至最低水平(p<0.05),表明大量TTX的灌喂引起了暗纹东方鲀的应激反应,降低了鱼体的免疫力。随后,AKP和ACP活力逐渐上升,分别在12 h和48 h时达到最高点(p<0.05),在此过程中磷酸酶活力增加以增强河豚鱼免疫防御能力,从而降低TTX对机体免疫系统的破坏。Takuya Matsumoto等[28]通过抑制性消减杂交技术检测出河豚鱼经肌肉注射后肝脏组织中在免疫因子表达上调,该实验结果证实了本实验的可能性。最后AKP和ACP分别在48 h和72 h后逐渐趋于稳定(p>0.05)。
3 结论
实验以暗纹东方鲀为研究对象,采用口服灌喂河豚毒素的给药方式,结合超高效液相色谱串联质谱法分析河豚毒素在不同组织器官中的转移分布规律,并同时对比分析肝脏组织中代谢酶活力的差异来探讨河豚毒素的耐受机制。结果表明,性腺是河豚毒素首要蓄积器官,肝脏是第二蓄积器官且与肾脏、脾脏、胆同时参与河豚毒素的转移代谢,皮肤和血液是参与河豚毒素的转运分布的主要组织,鳃是河豚毒素主要的排泄器官,肠道是河豚毒素的直接接触的器官。同时河豚鱼可通过提高肝脏中乳酸脱氢酶、转氨酶活性和调整不同时间下磷酸代谢酶活性,共同应对河豚毒素对机体的损伤。
