高场强超声波对大豆分离蛋白溶解性的改善作用
2021-06-30李笑笑孙东晓张祎孙为正
李笑笑,孙东晓,张祎,孙为正
(华南理工大学食品科学与工程学院,广东广州 510640)
大豆蛋白具有优异的营养价值和功能特性,是人类膳食中重要的蛋白来源[1,2]。还因其优良的功能特性如乳化性、持油性、持水性、发泡性等在食品工业生产中有着广泛应用[2,3]。由于商业大豆分离蛋白(SPI)在提取工艺中经过湿热处理、加热灭酶处理等过程,导致蛋白严重变性,进而影响其功能性质[4],这很大程度上限制了SPI营养和功能特性的开发利用。因此,通过改性处理以改善商业SPI的功能特性并提高其生物有效利用率已成为行业的研究热点之一。其中,物理改性是一种绿色、成本低、效率高的食物蛋白改性方式。近年来,许多超声波技术的应用研究表明,超声能够显著改变SPI的结构,并且进一步起到改善其功能特性的作用[3,5,6]。但同一处理条件,蛋白浓度不同,改善效果也存在一定差异。汤虎等人[7]的研究发现不同质量体积分数的小麦面筋蛋白经过超声后溶解度有显著差异。Gordon[8]研究发现,不同浓度的蛋白经超声处理后,其颗粒大小与浓度显著相关。Tang等人[9]在研究中采用高压处理三种浓度的大豆分离蛋白(质量体积分数分别为1%(W/V)、3%(W/V)、5%(W/V)),结果表明大豆分离蛋白经过高压处理后各项理化性质如表面疏水性、游离巯基含量、热力学性质、蛋白溶解性、乳化性质和热致凝胶性都与蛋白浓度有着密切的关系。Boulet等人[10]的研究表明β-乳球蛋白在一定pH和温度条件下,聚集体的粒径大小取决于蛋白浓度大小,聚集程度和体积浓度的增大呈现对数增加现象。
因此,本文选取两个质量体积分数(3%(W/V)和5%(W/V))商业SPI进行超声波处理,研究SPI经超声处理后的结构变化,进而研究其结构变化与溶解性改善作用的关系,研究结果将对食品工业超声预处理参数选择提供方法指导。
1 材料与方法
1.1 原料
商业SPI采购自广州合诚实业有限公司,经凯氏定氮法测得其蛋白含量为88.74%。
1.2 试剂与设备
1.2.1 试剂
电泳预制胶(浓缩胶4%,分离胶12%)、分子量标准品(PM2510,10 ku~180 ku)、样品缓冲液等购买自碧云天生物技术有限公司。其余常规化学试剂均为分析纯且购买自广州丛源科技仪器有限公司。
1.2.2 主要仪器设备
凯氏定氮仪KND-103F,上海纤检仪器有限公司;高速冷冻离心机CR22N,日本日立公司;pH计pHS-3E,北京雷磁仪器有限公司;激光衍射粒度仪Mastersizer 2000,英国Malvern公司;PowerPacTM Basic电泳仪,美国Bio-Rad Laboratories公司;细胞破碎仪JY92-Ⅱ DN,宁波新芝生物科技股份有限公司;磁力搅拌器JB-1,上海雷磁新泾仪器有限公司;多功能酶标仪Thermo Scientific 3001,芬兰Thermo Fisher科技公司。
1.3 试验方法
1.3.1 超声处理大豆分离蛋白
超声处理参照Hu等[11]方法并略有改动。配制3%(W/V)和5%(W/V)的商业SPI分散液,调节pH至7.0。室温下(25±1 ℃)磁力搅拌3 h使SPI充分溶解,置于4 ℃过夜水化。在超声处理过程中保持样品处于冰水浴中以防蛋白过热。超声仪工作电压220 V,频率50 Hz,变幅杆末端(超声探头)直径6 mm。超声功率分别为200 W、400 W、600 W、800 W,超声时间均为15 min。未超声处理样品为Control。
1.3.2 溶解度测定
溶解度测定参照汤虎等[7]方法并稍加改动。将样品用去离子水稀释至5 mg/mL,双缩脲法测定蛋白含量。样品离心(25 ℃,15 min,12000 r/min)后取上清液测定蛋白含量。蛋白质溶解度即上清液中蛋白质与总蛋白质含量比值。
1.3.3 表面疏水性测定
由于蛋白质溶解度较低,故采用溴酚蓝(BPB)结合法来测定蛋白表面疏水性,步骤参考Shen等人[12]并略有改动。SPI分散液稀释到5 mg/mL,用双缩脲试剂法测定蛋白含量。取1 mL稀释后的SPI分散液加入200 μL溴酚蓝溶液(1 mg/mL)涡旋混合,室温下反应10 min,作为样品组。用1 mL去离子水代替1 mL稀释后的SPI溶液和200 μL溴酚蓝溶液涡旋混合,作为空白对照。样品经12000 r/min,25 ℃条件下离心15 min,上清液稀释10倍,测定595 nm处吸光值。分别将样品组和空白对照组记为Abs样品和Abs空白。表面疏水性用溴酚蓝结合量(BPB bound,μg)表示:
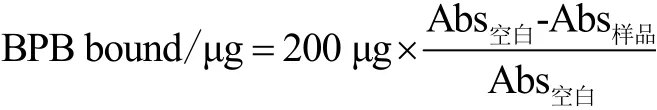
1.3.4 粒径分布测定
SPI粒径分布采用激光散射粒度分析仪测量,具体步骤参照Han等[13]的方法。测定时分散剂的折射率设为1.626,颗粒折射率为1.33,颗粒吸收率为0.001。所有测量重复3次。结果数据中D4,3指的是体积平均直径,D3,2指的是表面积平均直径。
1.3.5 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)
分离胶的浓度是12%,浓缩胶的浓度是4%。详细步骤参考陈曦等[14]并稍加改动。用去离子水将样品稀释至5 mg/mL。分别取150 μL SPI分散液,加入50 μL样品缓冲液(含二硫苏糖醇),在沸水浴中处理10 min。然后离心(12000 r/min,10 min),取10 μL上清液进样。凝胶电泳结束后,用染色液将预制胶染色1 h。染色完成后脱色,脱色时间约20 h。染色液的成分主要是0.1%考马斯亮蓝R-250、45%(W/V)乙醇和10%冰乙酸。
1.4 数据处理
所有实验数据采用SPSS 20进行单因素方差分析(ANOVA)。统计分析时采用Duncan's新复极差法比较3组实验均值在0.05水平上是否有显著性差异。
2 结果与讨论
2.1 溶解度
由表1知,未经过超声处理的3%(W/V)SPI溶解度为25.54%,5%(W/V)SPI的溶解度为24.22%;经过超声处理后,所有样品的溶解度都有显著性提升(p<0.05),3%(W/V)SPI超声处理(200 W、400 W、600 W和800 W)溶解度分别提高了75.90%、87.40%、54.90%和35.70%,5%(W/V)SPI超声处理后溶解度分别提高了68.20%、73.90%、65.00%和52.80%。而5%(W/V)SPI在同等功率超声作用下所得的溶解度都小于3%(W/V)SPI。当超声功率达600 W后,两种浓度的SPI溶解度较为接近。而在800 W超声后,5%(W/V)SPI具有更高的溶解度。
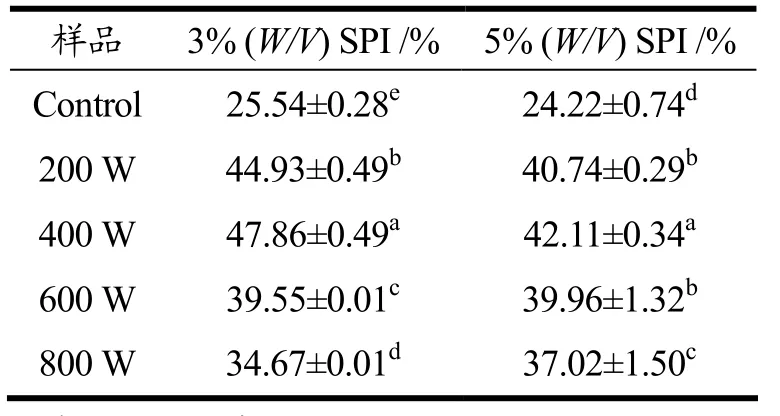
表1 超声处理前后商业SPI的溶解度变化Table 1 Protein solubility of ultrasound-treated and untreated comercial SPI in different concentration
溶解度是影响蛋白质功能特性的主要指标,是决定蛋白质应用的关键理化特性。200 W和400 W的超声处理,使SPI溶解度升高,主要原因可能是蛋白分子聚合物被超声波的空穴气泡和湍流等打散。当超声波功率增大到600 W和800 W时,溶解度呈下降趋势,其主要原因可能是过度展开的SPI分子之间通过疏水相互作用,形成部分不溶性的聚集体,进而导致溶解度的下降。汤虎等人[7]研究发现经540~720 W改性小麦面筋蛋白,蛋白溶解度变化与超声功率的提高呈正相关,但超声功率大于720 W后,溶解度显著下降,本文实验结果与其规律相类似。超声波的空穴效应产生的如涡旋、局部高压、湍流剪切力等使得较大颗粒的蛋白聚集体解聚成更小的蛋白颗粒。超声波作用改变了蛋白质的空间构象,增加了蛋白质和水分子之间的相互作用[3,5,9,15]。
2.2 表面疏水性
蛋白质分子的疏水相互作用在维持其三级结构和稳定的空间构象等方面有着重要作用[16],蛋白质表面疏水性结果如表2所示,SPI经超声处理(200 W和400 W)后,蛋白分子聚集体被机械作用打散,粒径减小,疏水性降低,溶解度升高。而超声600 W和800 W后蛋白疏水基团进一步暴露,疏水性略有增强,蛋白质分子形成部分聚集体,粒径增大,溶解度降低。值得注意的是,5%(W/V)SPI溴酚蓝结合量在800 W时有轻微减少,对应溶解度有小幅度上升。Hayakawa和Nakai[17]研究表明蛋白质的表面疏水性变化趋势通常与其溶解性呈负相关。主要是由于蛋白疏水性残基暴露增加蛋白质的表面疏水性,蛋白分子表面疏水性基团广泛参与蛋白质分子间的相互作用,导致蛋白质的溶解性降低[18]。
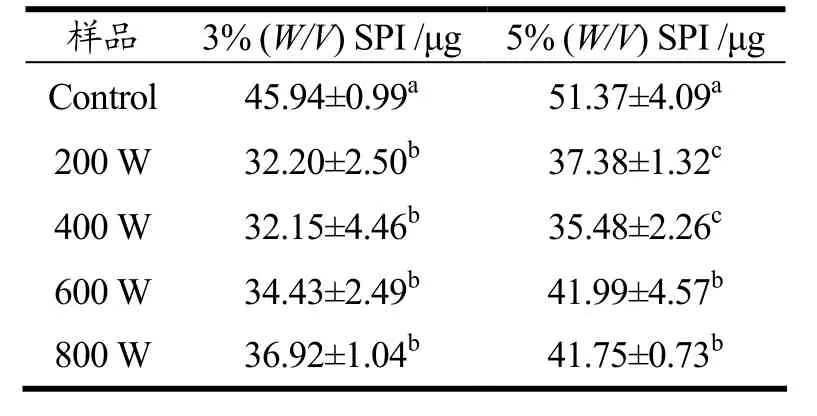
表2 超声波处理对两种浓度的大豆分离蛋白表面疏水性的影响Table 2 Surface hydrophobicity of ultrasound-treated and untreated SPI of two different concentration
2.3 粒径
经超声处理和未处理的SPI粒径分布见图1,平均粒径见表3。在未经超声波处理的样品中,3%(W/V)SPI平均粒径和5%(W/V)SPI基本接近,由图1和表3可知,所有功率的超声波处理都使得SPI粒径显著降低(p<0.05)。但经超声波处理后,在200 W、400 W和600 W功率下,3%(W/V)SPI的平均粒径均小于5%(W/V)SPI。而在800 W的超声作用下,5%(W/V)SPI平均粒径低于3%(W/V)SPI,这可能是800 W的超声作用让5%(W/V)SPI更早地进入了重新解聚的过程。
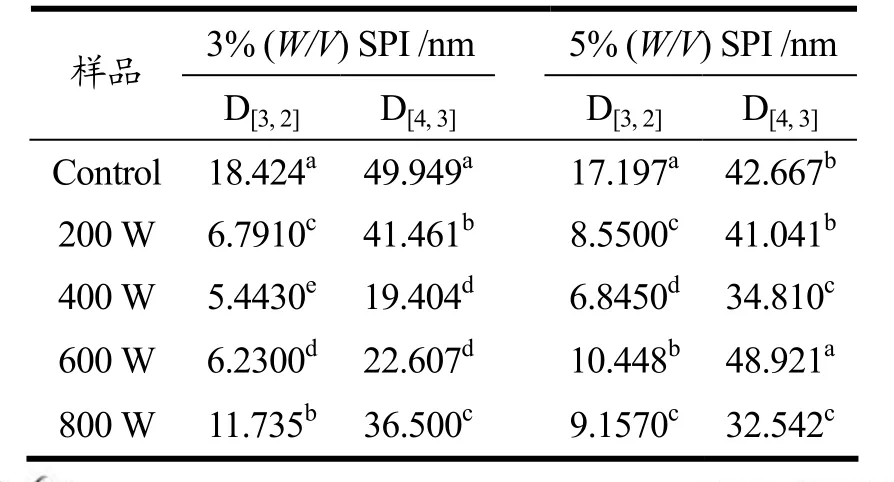
表3 超声波处理对大豆分离蛋白粒径的影响Table 3 Average SPI size after ultrasound treatment
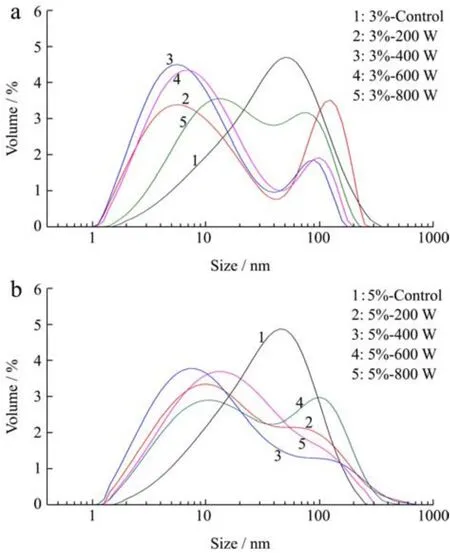
图1 超声处理前后的大豆分离蛋白粒径分布:3%(W/V)SPI(a)和5%(W/V)SPI(b)Fig.1 Size volume distribution of treated and untreated 3%(W/V) SPI (a) and 5% (W/V) SPI (b)
超声波促使蛋白粒径减小的原理是超声波产生的空穴效应和微流束现象,两者的机械作用破坏了蛋白分子之间的相互作用[2,4],导致蛋白质的聚集物或者大颗粒显著减少。但在600 W和800 W处理时,SPI粒径显著增大,这可能是更高功率的超声波使蛋白疏水基团暴露,疏水性上升,导致蛋白发生了一定程度的重新聚合[5]。从图表中可见,Control样品主要分布在10~100 nm范围内,呈单峰状态分布,分布较为均匀。200 W超声处理后SPI粒径显著降低,呈双峰分布,小粒径的峰仍占主要部分。400 W超声后粒径进一步减小,小粒径颗粒所占比例增加,大粒径分布减少。600 W超声后粒径分布接近400 W,双峰向大粒径方向偏移。800 W超声后粒径增大,仍呈双峰分布。两峰分布面积趋向于接近。造成这种现象的主要原因在低功率下,蛋白分子的聚集体在超声波作用下解聚导致粒径减小。但在达到一定功率后,在600 W以及800 W超声波作用下,部分蛋白分子彼此联接,重新产生聚合体,造成粒径变大。
2.4 电泳(SDS-PAGE)
图2 为超声处理后大度分离蛋白的电泳图。由图2可知,还原条件下,商用大豆分离蛋白呈现清晰的7S和11S亚基。经超声处理后,3%(W/V)和5%(W/V)SPI的电泳条带均表明大豆球蛋白的A亚基和B亚基和伴大豆球蛋白的β亚基、α´亚基和α亚基并未遭到破坏。本文实验结果和胡昊[5]、包中宇[3]等的研究结果一致。由此可见,一定功率的超声波处理并不会破坏大豆分离蛋白的亚基结构,综合溶解度和粒径的结果分析,超声波处理能显著影响蛋白分子聚集体的解聚和重构,在整个改性过程中也促使蛋白质分子粒径发生变化。
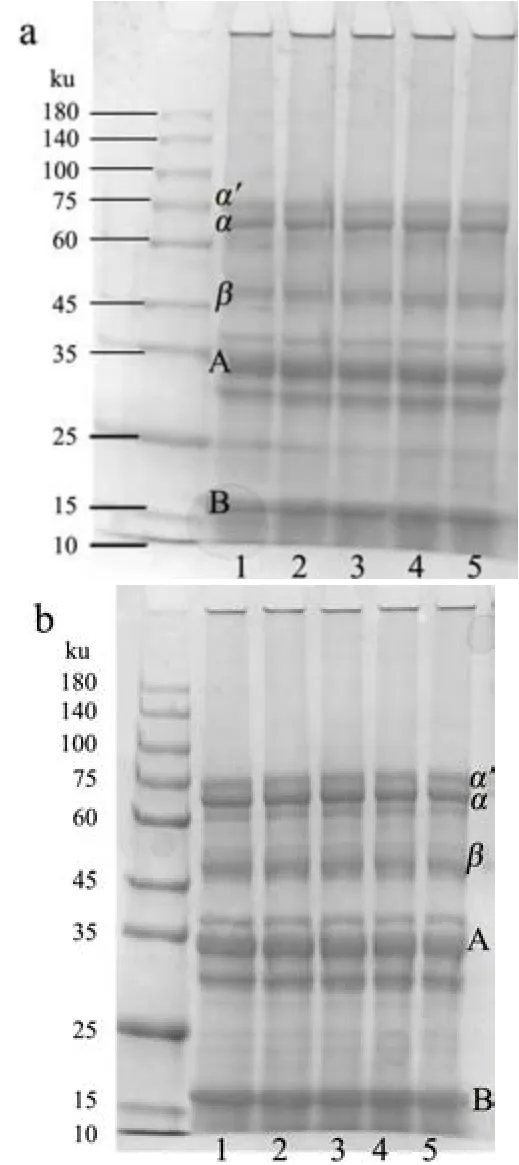
图2 超声处理前后3%(W/V)(a)和5%(W/V)(b)SPI电泳图Fig.2 SDS-PAGE graph of treated and untreated 3% (W/V) SPI(a) and 3% (W/V) SPI (b)
3 结论
3.1 本文以商业SPI为原料,对两种质量体积分数(3%(W/V)和5%(W/V))的商业SPI进行不同功率梯度(200 W、400 W、600 W、800 W)的超声处理,研究对其结构的影响,解析结构变化对溶解性的影响。
3.2 经过超声处理后,SPI的溶解性呈先增加后降低的趋势,400 W的超声处理可获得最大溶解性;超声处理对不同体积质量分数的SPI溶解性具有不同的影响,低功率超声处理(<400 W)可使3%(W/V)SPI获得较好的溶解性,而高功率超声处理(800 W)5%(W/V)SPI溶解性优于3%(W/V)SPI。
3.3 超声处理对不同体积质量分数的SPI的表面疏水性、粒径具有不同的影响,表明低强度的超声处理可解聚SPI聚集体,而高强度超声处理可使SPI形成新的聚集体且不会引起SPI亚基的变化。
