肥胖儿童血清Asprosin水平及其与糖脂代谢的相关性研究
2021-06-30谭雪净康玉蓉肖延风
谭雪净,王 敏,康玉蓉,肖延风
(1.西安交通大学第二附属医院,陕西 西安 710004;2.陕西省铜川市人民医院儿科,陕西 铜川 727031)
近30年来,儿童肥胖的发病率在全球范围内正以惊人的速度增长,儿童肥胖使成人慢性病低龄化,使心血管疾病、2型糖尿病和高血压等的风险显著增加,儿童肥胖已成为一个日趋严重的公共卫生问题[1]。脂肪组织不仅是储存脂肪的场所,也是分泌脂肪因子的内分泌器官,参与胰岛素抵抗(insulin resistance,IR)、糖尿病等病理过程[2]。随着研究的深入,人们逐渐认识到许多脂肪因子可以调节多种代谢性疾病的发生、发展,如脂联素(adiponectin)、瘦素(leptin)、鸢尾素及锌a2糖蛋白等[3]。Asprosin是2016年Romere等发现的一种新的脂肪因子,主要由白色脂肪细胞分泌,也称白脂素[4]。有研究已发现Asprosin可作用于肝脏、大脑、骨骼肌、胰腺等多个器官,并与糖尿病、肥胖、多囊卵巢综合征、冠心病等疾病有关[4-6]。关于Asprosin在肥胖儿童中的表达及其对机体糖脂代谢影响方面的研究较少,为此,本课题就肥胖儿童血清Asprosin水平进行分析,探讨其与糖脂代谢指标的相关性及临床意义。
1研究对象与方法
1.1研究对象
选取2017年7月至2018年9月在西安交通大学第二附属医院小儿内分泌门诊确诊的7~18岁单纯性肥胖儿童作为肥胖组,共79例;选取同时期、同年龄的健康儿童作为对照组,共40例。
儿童单纯性肥胖的诊断标准:按照2004年中国肥胖问题工作组制定的中国学龄儿童青少年超重、肥胖筛查体质量指数(BMI)分类标准[7]:将BMI≥同年龄同性别儿童第95百分位数(P95)定义为肥胖。排除标准:年龄<6岁或>18岁;患有1型糖尿病;伴有原发性甲状腺功能减退症、库欣氏综合征等继发性肥胖;伴有肥胖综合征;急性感染性疾病。本研究符合我院人体试验伦理委员会所制定的伦理学标准,所有研究对象均签署知情同意书。
1.2方法
1.2.1基本信息收集
详细询问并记录两组儿童的性别、年龄、既往史、用药史、个人史及家族史等资料。
1.2.2身体测量指标
体重测量采用RGZ-120型标准体重秤,身高测量采用身高测量仪。由专人负责测定体重、身高、腰围、臀围、血压,血压包括收缩压和舒张压。测量血压(收缩压/舒张压)分别在休息10min后进行。测量时受试者穿轻薄的衣服,脱鞋。根据Tanner分期评估所有受试者的青春期发育,睾丸体积大于4mL的男孩和乳房发育为Ⅱ期及以上的女孩均认为进入青春期。BMI=体重(kg)/[身高(m)]2;腰臀比(WHR)=腰围(cm)/臀围(cm)。
1.2.3生化指标测定
所有受试者,要求隔夜禁饮禁食至少12h,采血前一天禁高糖高脂饮食,于当日清晨7∶00—8∶00空腹采集肘部静脉血5mL,1 200r/min离心10min,分离血清,并分装于1.5mL EP管冻存,置于-80℃冰箱贮存。采用化学发光法测定空腹胰岛素(FINS);全自动生化仪(日立747,日立、日本东京)测定空腹血糖(FBG)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、丙氨酸氨基转移酶(ALT)、谷草转氨酶(AST)、谷酰转肽酶(GGT)、尿酸(UA)。采用酶联免疫吸附法(ELISA)检测血清Asprosin、瘦素、脂联素和肿瘤坏死因子(tumor necrosis factor,TNF)-α的浓度,按照试剂盒的操作说明进行检测。青春期前的稳态模型胰岛素抵抗指数(HOMA-IR)>2.5,青春期HOMA-IR>4.0,说明发生IR[8]。HOMA-IR=(FINS×FBG)/22.5。
1.3统计学方法
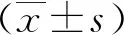
2结果
2.1一般资料
肥胖组与对照组在性别、年龄、身高及处于青春期者的比例方面差异均无统计学意义(P>0.05),见表1。

表1 肥胖组与对照组一般资料比较
2.2体格测量指标和生化指标
肥胖组体重、BMI、BMI-SDS、腰围、臀围、WHR、收缩压、舒张压、丙氨酸氨基转移酶、谷酰转肽酶、血清总胆固醇、甘油三酯、FBG、FINS、Asprosin、瘦素、瘦素/脂联素(LAR)、TNF-α的水平均显著高于对照组,而脂联素水平显著低于对照组,差异均有统计学意义(P<0.05),见表2。

表2 肥胖组与对照组各指标比较分析
2.3肥胖儿童血清Asprosin水平与体格测量指标、糖脂代谢指标的相关性分析
调整BMI-SDS和年龄后,对肥胖儿童血清Asprosin水平与糖脂代谢指标及测量指标进行偏相关分析。结果显示,血清Asprosin水平与WHR、DBP、HOMA-IR及FBG、TNF-α、瘦素水平呈正相关(相关系数r值分别为0.332、0.275、0.225、0.216、0.324、0.215),与脂联素水平呈负相关(相关系数r=-0.209),P<0.05,见表3。
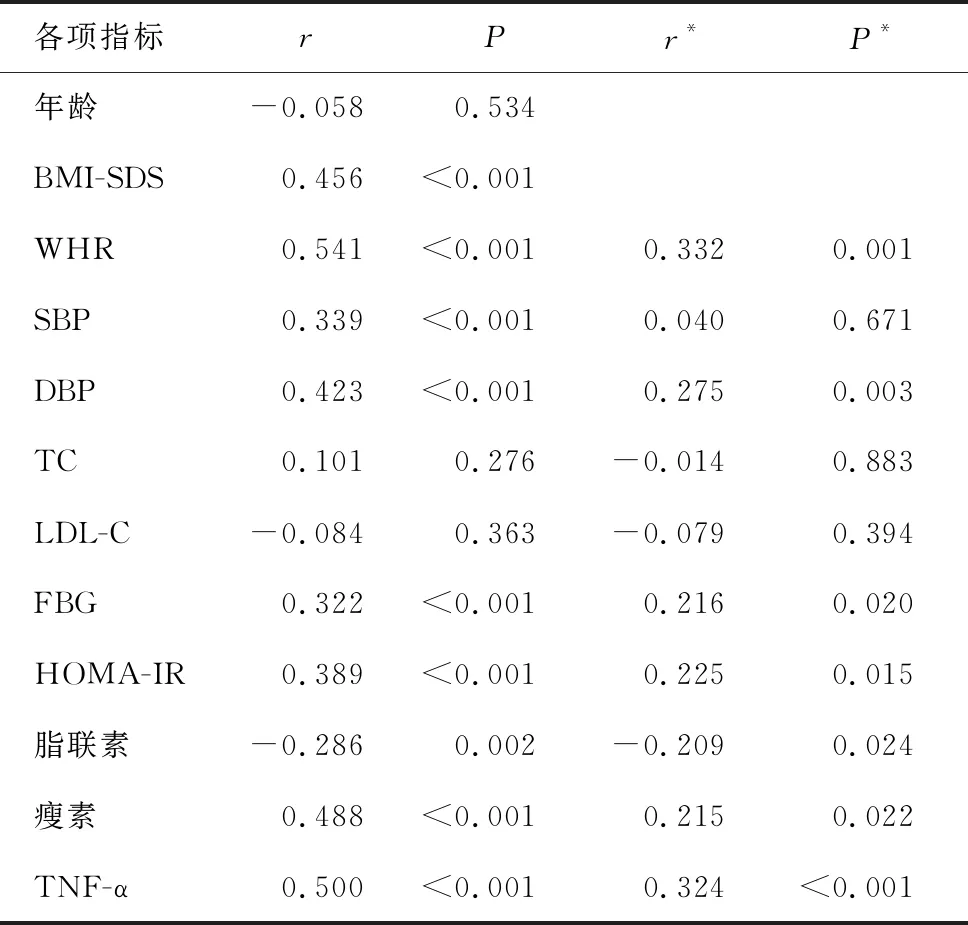
表3 肥胖儿童血清Asprosin水平与各项指标的相关性分析
3讨论
3.1肥胖与炎症、细胞因子
儿童肥胖是一个严重的健康问题,在世界各地已达到流行病的程度,并与一些代谢综合征和心血管并发症有关[9]。许多发展中国家“营养转型”与食品“西方化”的现象盛行,导致了肥胖的显著增加[9]。肥胖患者体内大量聚积的脂肪组织分泌脂肪因子和炎性因子的功能失衡,可影响机体多器官代谢功能,抑制胰岛素的信号通路,引起IR,增加2型糖尿病、心脑血管疾病的发病风险[10]。本研究就肥胖与健康儿童体格测量指标、糖脂代谢指标及与相关脂肪细胞因子进行分析,结果显示肥胖组儿童身体测量指标BMI、腰围、臀围、WHR、血压均显著高于对照组,差异均有统计学意义(P<0.05);肥胖组的生化指标ALT、GGT、CT、TG、FBG和FINS水平均显著高于对照组,提示肥胖儿童随着体重的增加,机体发生糖脂代谢紊乱;进而,肥胖儿童血清炎性因子TNF-α水平增高,脂肪因子瘦素水平增高、脂联素水平减低,提示肥胖儿童体内存在轻度的炎症反应和细胞因子分泌异常。
3.2 Asprosin与中心性肥胖、IR
Asprosin由白色脂肪细胞产生和分泌,释放入血,循环至肝脏,通过激活G蛋白耦联受体,促进肝脏糖异生,使得血糖在IR的人和鼠体内升高[11]。Duerrschmid等[12]构建了Asprosin水平明显下降的FBN1NPS/+小鼠模型,在高脂饮食喂养下未出现糖尿病风险,表明Asprosin可能在葡萄糖代谢中起着重要作用。Wang等[2]分析糖调节受损组、2型糖尿病组及健康对照组血浆Asprosin浓度,结果发现,糖调节受损及2型糖尿病患者血中Asprosin水平显著高于对照者;相关性分析显示,Asprosin水平和腰围、FBG、餐后2小时血糖、糖化血红蛋白、甘油三酯和HOMA-IR呈正相关;多因素Logistic回归分析显示,血浆Asprosin水平和糖调节受损、2型糖尿病显著相关。关于肥胖儿童Asprosin的分泌状况及其与糖脂代谢紊乱的关系研究较少。本研究测定了肥胖儿童血清Asprosin水平,并与健康儿童进行比较。结果显示,肥胖儿童血清Asprosin水平显著高于正常儿童。进一步在控制年龄和BMI因素后,进行Asprosin与其他指标的相关分析,结果显示,肥胖儿童血清Asprosin水平与WHR、DBP、FBG、HOMA-IR呈正相关,而与血脂指标无相关性,提示脂肪因子Asprosin分泌增多与中心性肥胖、IR密切相关。
3.3 Asprosin与肥胖儿童IR的发病过程
文献资料显示,脂肪组织分泌瘦素、脂联素、TNF-α、白细胞介素-6等都在IR发生、发展中起重要作用[13]。TNF-α影响胰岛素敏感性的机制主要是干扰IRS-1的磷酸化及抑制葡萄糖转运蛋白4(GLUT-4)由细胞内向细胞膜转位。血浆脂联素水平与胰岛素敏感性指数呈正相关,脂联素可通过促进骨骼肌细胞的脂肪酸氧化等途径改善胰岛素敏感性,并可以明显改善TNF-α引起的炎症反应。在肥胖状态下,瘦素可引发内皮素-1(ET-1)、一氧化氮合酶(NOS)的合成,以及单核细胞趋化蛋白-1(MCP-1)等的分泌而促进炎症发生发展,并且可激活胰岛β细胞的ATP敏感K+通道,抑制胰岛素分泌并使胰岛素储存脂肪作用降低,从而引发IR;瘦素还可通过促进脂肪分解,使游离脂肪酸(FAA)浓度增加,加重IR的程度。本研究结果显示,Asprosin水平与TNF-α和瘦素水平呈正相关,与脂联素呈负相关,提示脂肪因子Asprosin参与了肥胖儿童IR的发病过程,其分子机制有待进一步研究。
综上所述,本研究初步探讨了肥胖儿童血清Asprosin浓度及其与人体测量指标、糖脂代谢指标、脂肪因子瘦素和脂联素,以及炎性因子TNF-α的相关性,结果显示,肥胖儿童Asprosin与中心性肥胖、IR有密切相关,并且Asprosin与TNF-α、瘦素及脂联素有相关性,提示Asprosin参与肥胖及IR的发生和发展,对其深入研究将为IR发病机制及其干预提供新思路。
