基于16S rDNA测序及培养基法探究虹鳟鱼贮藏优势腐败菌
2021-06-30盖园明付绍平林心萍张大伟
周 慧, 盖园明, 徐 超, 付绍平, 林心萍, 张大伟*
(1.大连工业大学 食品学院,辽宁 大连 116034;2.中国科学院 天津工业生物技术研究所,天津 300000)
虹鳟鱼原产自北美洲北部地区和太平洋西岸地区,是鲑科、太平洋鲑属的冷水性鱼类,在中国已经大范围养殖[1]。虹鳟鱼是高级鱼类之一,品种较为名贵,其肉质鲜嫩,味道鲜美,无腥味,也没有小骨刺[2]。由于虹鳟鱼鱼肉中蛋白质、脂肪的含量较高,在贮藏过程中容易受到微生物及酶的作用,导致其腐败变质[3]。微生物因素对虹鳟鱼腐败过程起着至关重要的作用[4]。因此鉴定虹鳟鱼在贮藏过程中的优势腐败菌对于虹鳟鱼保鲜具有重要意义。16S rDNA由10个保守区域和9个高变区域构成,位于原核细胞核糖体小亚基上。16S rDNA保守区域的差异性在不同的细菌之间不大,而高变区域在不同的属或种之间存在特异性,随细菌间亲缘关系不同存在差异。因此将16S rDNA作为特征核酸序列用来揭示生物物种特性,是最适合用于细菌系统发育和分类鉴定的指标[5]。16S rDNA扩增子测序,是指选择其中一个或几个变异区域,对保守区域设计通用引物进行PCR扩增,然后利用高变区进行测序分析和菌种鉴定[6]。16S rDNA扩增子测序技术已成为研究环境样品中微生物群落组成结构的重要手段[7]。常见的腐败菌致腐能力鉴定方法有两种,分别是将待测菌种接种于无菌鱼块或者无菌鱼汁中。无菌鱼块虽然能作为天然培养基模拟自然贮藏环境,但是只能在制备过程中尽量保证无菌,鱼块本身存在的微生物无法去除,因此会对实验结果产生干扰。而对于无菌鱼汁可选用高温高压灭菌,在保证绝对无菌的同时,额外补充一些氨基酸类物质,能够保证腐败菌生长的营养需求[8]。此外有研究表明,以挥发性盐基氮(TVB-N)作为腐败指标,分析无菌鱼汁中腐败菌腐败能力的方法更为可靠[9]。因此,将腐败菌种接种到无菌鱼汁的方法在时效性和可靠性方面都更具有优势。本研究通过菌落总数及挥发性盐基氮含量等指标对虹鳟鱼腐败周期进行确定,通过16S rDNA高通量测序方法分析虹鳟鱼贮藏的各个时期腐败菌种类及相对丰度。同时采用传统培养方法,使用选择培养基分离常见的水产品优势腐败菌假单胞菌属及希瓦氏菌属。利用无菌虹鳟鱼鱼汁模拟腐败菌生存环境,通过接种实验,以腐败菌菌落总数及挥发性盐基氮含量作为评价指标,鉴定腐败菌的致腐能力,从而获得虹鳟鱼在0 ℃贮藏条件下的优势腐败菌,为虹鳟鱼腐败机制的研究以及保鲜剂的开发提供参考。
1 材料与方法
1.1 材料
1.1.1 实验材料及预处理 新鲜虹鳟鱼购自天津SM超市,及时运回实验室,立即杀死,去除头、骨及内脏,处理成60 g左右的鱼片装入自封袋,放置于冰盒中,并及时更换新冰,保证贮藏环境的低温状态。定期取样检测。
1.1.2 培养基 假单胞菌选择性培养基(CFC)、三糖铁琼脂培养基(TSI)购自青岛海博生物技术有限公司;LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,琼脂粉15 g/L,水1 L。
1.1.3 试剂与仪器 细菌基因组DNA提取试剂盒购自天根生化科技(北京)有限公司;DNA聚合酶购自南京诺唯赞生物科技有限公司。XP-基因扩增仪(TC-XP-G,杭州博日科技有限公司);全自动鼓风干燥箱(ZFD-A5090,上海智城分析仪器制造有限公司);电热恒温培养箱(HPX-9162 MBE,上海博迅实业有限公司医疗设备厂);恒温培养振荡器(ZWY-240,上海智城分析仪器制造有限公司)。
1.2 方法
1.2.1 菌落总数测定 参考国标GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》中的方法[10]。每3 d取10 g鱼肉样品搅碎,与90 mL生理盐水混合均匀,震荡5 min后取上清液梯度稀释,选择合适的稀释梯度,取1 mL倾注PCA培养基并摇匀,每个梯度2个重复,30 ℃培养48 h后计数。
1.2.2 挥发性盐基氮的测定 参考国标GB 5009.228-2016《食品安全国家标准食品中挥发性盐基氮的测定》中第一法半微量定氮法进行测定[11]。每3 d取20 g鱼肉样品,搅碎后准确加入100 mL蒸馏水,不时震荡,使样品分散均匀,浸渍30 min后过滤取滤液。利用半微量定氮装置进行蒸馏,用盐酸标准滴定溶液滴定。
1.2.3 16S rDNA高通量测序 ①样本提取:无菌环境条件下,取贮藏的初期、中期和末期的鱼片样品,分别于鱼片的不同位置取样,共取10 g鱼肉样品,混合均匀。将样品送至北京诺禾致源公司进行微生物多样性检测。②DNA抽提和多样性检测:CTAB法提取鱼肉样本中微生物的基因组,将得到的基因组进行琼脂糖凝胶电泳检测。以提取的基因组为扩增模板,再利用515F和806R两条引物对V4可变区进行PCR扩增,目的产物利用胶回收试剂盒回收。使用建库试剂盒进行文库构建,检测合格后,使用Thermofisher的Ion S5TMXL进行上机测序。对测序结果初步质控并去除其中的嵌合体序列,得到最终的有效数据(Clean Reads)。使用Uparse软件对Clean Reads进行聚类,默认将97%的一致性的序列聚类成为OTUs。
1.2.4 优势腐败菌的分离鉴定 将贮藏末期的样品搅碎后加无菌水进行梯度稀释,选取适宜的浓度,分别涂布在假单胞菌选择性培养基(CFC)和三糖铁琼脂培养基(TSI)上,30 ℃培养48 h,挑取菌落形态不同的单菌落划线纯化3次。将纯化后的单菌落接种到5 mL LB液体培养基的试管中,30 ℃,220 r/min培养12 h后,使用细菌基因组提取试剂盒提取基因组。使用细菌通用引物1492r和27f对16S区域进行PCR扩增。PCR产物进行琼脂糖凝胶电泳检测后,将产物送至苏州金唯智生物科技有限公司进行测序,测序结果进行BLAST分析比对。
1.2.5 无菌虹鳟鱼汁的制备 鲜活虹鳟鱼去除头、骨及内脏后,搅碎,每1 000 g鱼肉加入500 mL蒸馏水,混合均匀后,加热煮沸5 min,混合物过滤后得到鱼汁。每1 000 mL鱼汁加入氧化三甲胺(TMAO)1.6 g,L-半胱氨酸和L-甲硫氨酸各40 mg,以补充加热可能损失的营养物质。混合均匀后,121 ℃高压灭菌15 min得到无菌鱼汁[12]。
1.2.6 菌悬液的制备 将1.2.4中分离得到的优势腐败菌在LB培养基活化两次,以1%(体积分数)接种量接种于LB培养基中,30 ℃,220 r/min培养12~18 h,使菌体有效活菌数达到109cfu/mL,4 ℃条件下12 000 g离心10 min,收集菌体,无菌生理盐水重悬,得到菌悬液。
1.2.7 接种实验 吸取20 μL菌悬液(OD600为0.1)接种于400 mL无菌鱼汁中,对照组为20 μL无菌生理盐水。分别于第0天、第3天、第6天、第9天、第12天、第15天取样,测定菌落总数及挥发性盐基氮含量,确定优势腐败菌的致腐能力,方法见1.2.1、1.2.2。以挥发性盐基氮产量因子YTVB-N/cfu作为评估优势腐败菌腐败能力的指标[13]。
2 结果与分析
2.1 虹鳟鱼贮藏期间品质变化情况
影响水产品货架期的因素有很多,包括环境温度、初始微生物污染情况和微生物的生长繁殖情况[14]。菌落总数可以反映水产品在贮藏过程中受微生物污染情况,也能作为评价水产品腐败情况的指标之一。如图1所示,虹鳟鱼在0 ℃贮藏条件下,菌落总数在逐步增长。在贮藏的第6天时,菌落总数达到了5.59 lg(cfu/g),第12天时菌落总数增长到7.36 lg(cfu/g)。参考食品国家标准相关规定(≤ 105cfu/g)[15],可以判定虹鳟鱼片0 ℃贮藏条件下的货架期为5 d。参考国际微生物规格委员会规定的食品微生物最高安全限值(≤107cfu/g)[16],判定在该贮藏条件下的虹鳟鱼贮藏12 d已经腐败。

图1 0 ℃贮藏条件下菌落总数变化情况Fig.1 Change of total bacterial count under 0 ℃ storage
挥发性盐基氮(TVB-N)产生的原因是在腐败过程中,鱼肉在酶和细菌的作用下使蛋白质分解产生的氨以及胺类等碱性含氮物质[17]。挥发性盐基氮同样可以作为评价腐败的标准之一。此类物质有一定的挥发性,挥发性盐基氮的含量越高,表明样品的腐败程度越高。如图2所示,虹鳟鱼片在整个贮藏过程中,挥发性盐基氮持续积累,在贮藏末期达到最高值18.344 mg/100 g,虽未达到腐败标准,但已接近不可食用程度[18]。

图2 0 ℃贮藏条件下TVB-N变化情况Fig.2 Change of TVB-Nt under 0 ℃ storage
综合菌落总数及挥发性盐基氮含量变化情况,确定贮藏的第5天为0 ℃贮藏条件下的货架期终点。
2.2 16S rDNA测序结果及优势腐败菌分离鉴定
2.2.1 Alpha多样性分析 Alpha Diversity用于分析样品内部的微生物群落多样性,可以反映样品内部微生物群落的相对丰度以及多样性[19]。如图3所示,3个样品的稀释曲线都逐步趋于平缓,即斜率趋于0,说明测序结果的数据量合理,再多的序列量也不会产生新的物种(OTUs)。此外,由稀释曲线可知,虹鳟鱼样品在第5天时物种相对丰度最大,在第8天时物种相对丰度最小。可以说明优势菌在贮藏过程中,会抑制其他菌株的生长繁殖,使物种数量趋于单一。以得到的OTUs按相对丰度进行排序,绘制Rank Abundance曲线。Rank Abundance曲线能够直观地反映样品中物种的相对丰度和均匀度。水平方向能够说明物种的相对丰度,曲线在横轴上的跨度越大,其物种相对丰度越高;垂直方向上曲线的平滑程度能够说明物种的均匀程度,曲线越平缓,物种分布越均匀[20]。由图4所示,曲线从左到右分别为第8天、第0天和第5天样本的Rank Abundance曲线,可知虹鳟鱼样品贮藏过程中第5天,物种相对丰度最高,第8天物种相对丰度最低。

图3 稀释曲线Fig.3 Dilution curve

图4 Rank Abundance曲线Fig.4 Rank Abundance curve
如表1所示,Alpha多样性指数反映微生物分布的相对丰度及均匀程度。其中,反映群落分布相对丰度的指数有chao1和ACE指数,由表1可知,虹鳟鱼在0 ℃贮藏条件下第5天的物种相对丰度最大,第8天的物种相对丰最小;反映群落分布多样性的指数有shannon和simpson,由表1可知,虹鳟鱼在4 ℃贮藏条件下贮藏第5天的群落多样性最大,第8天的群落多样性最小;goods_coverage指数用来表示本次测序结果能否代表样本的真实情况[21],经过检测的3个样品的coverage值都达到了0.99以上,表示样品文库的覆盖率高,有很小的可能性序列未被检出,因此本次检测结果能够用于样品微生物多样性分析。

表1 0 ℃贮藏条件下贮藏不同时间的虹鳟鱼样品的多样性指数
2.2.2 虹鳟鱼贮藏过程菌群变化情况 高通量测序技术的优点在于不需要对微生物进行分离培养,是一种快速检测技术。高通量测序技术不仅可以检测出不易培养的优势微生物,同时能够确定样品中优势微生物的相对丰度[22]。在虹鳟鱼鱼肉样品上检测到变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、醋杆菌门(Acidobacteria)、软壁菌门(Tenericutes)等菌落,选取丰度前10的菌种绘制成门水平的菌落结构分布图。由图5可知,虹鳟鱼在贮藏初期厚壁菌门所占比例最大,达到67.44%,其次为拟杆菌门,所占比例为22.23%;随着贮藏时间的延长,厚壁菌门和拟杆菌门所占比例逐步减少,到贮藏末期分别占比6.00%和0.29%。而变形菌门的所占比例随着贮藏时间的延长,所占比例逐渐提高,从贮藏初期的5.28%增长到72.14%,最终达到93.33%成为优势菌。变形菌门中包括水产品常见的腐败菌,如假单胞菌属、希瓦氏菌属等,在水产品腐败过程中发挥着重要作用。

图5 虹鳟鱼贮藏过程菌群变化情况(门水平)Fig.5 Changes of microflora during storage of rainbow trout (phylum level)
在虹鳟鱼鱼肉样品上检测到不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、希瓦氏菌属(Shewanella)、寡养单胞菌属(Stenotrophomonas)、拟杆菌属(Bacteroides)、嗜冷杆菌属(Psychrobacter)、乳杆菌属(Lactococcus)等菌落,选取丰度前30的菌种绘制成属水平的菌落结构分类图。
如图6所示,贮藏第0天存在多种菌属种类,所占比例最高的菌属为拟杆菌属,随着贮藏时间的延长,不动杆菌属、假单胞菌属所占比例显著提高。不动杆菌属从最初的0.2%逐渐增长到37.37%,贮藏末期达到70.59%,成为优势菌;假单胞菌属从0.2%增长到5.33%,最终达到13.32%。到贮藏末期,除不动杆菌属、假单胞属外,希瓦氏菌属也占有较大比例,达到1.13%。而拟杆菌属在贮藏过程中在逐渐消失。此外,鱼肉样品在贮藏初期,菌群种类极为丰富,而随着贮藏时间的延长,物种的相对丰度逐步下降,趋于单一。

图6 虹鳟鱼贮藏过程中菌群变化情况(属水平)
结合菌群总数变化情况以及各菌群所占比例,随着鱼肉贮藏时间的延长,优势菌群并可能发挥腐败作用的菌群数量在逐渐增多,与之相对的,生长环境不适宜,无法有效利用虹鳟鱼鱼肉环境而生长的菌群数量在逐渐减少,甚至消失。很可能特定腐败菌代谢产物对其他菌属的生长起到负面作用,从而抑制其他菌的生长繁殖。
2.3 典型菌株致腐能力分析
利用选择性培养基分离得到9株假单胞菌属菌株(P1:Pseudomonasfragistrain ATCC 4973;P2:Pseudomonasfluorescensstrain KBL29;P3:Pseudomonasfluorescensstrain CP DA19;P4:Pseudomonasfluorescensstrain KBL17;P5:Pseudomonasputidastrain DSQ4;P6:Pseudomonasfragistrain NBRC 3458;P7:Pseudomonasfragistrain 2-2;P8:Pseudomonasfragistrain Sneb811;P9:Pseudomonasfragi)及2株希瓦氏菌属菌株(S1:Shewanellasp. S05;S2:Shewanellasp. S5-52),高通量测序结果也同时检测到这两个菌属。之后根据挥发性盐基氮产量因子对其致腐能力进行分析。由图7可知,S2菌株的挥发性盐基氮含量在整个贮藏期间的积累量最多,一直到贮藏末期从初始的14.87 mg/100 g增加到100.56 mg/100 g。其次是P5菌株,从14.87 mg/100 g增加到73.32 mg/100 g。初步判定这两株菌的致腐能力较强。而P4、P8两株菌的挥发性盐基氮含量的积累与对照组几乎一致,在整个贮藏期间没有挥发性盐基氮的产生及积累,说明这两株假单胞菌菌株无致腐能力。

图7 接种优势腐败菌的鱼汁贮藏过程挥发性盐基氮变化情况Fig.7 Changes of volatile base nitrogen during storage of fish juice inoculated with dominant spoilage bacteria
由图8可知,所有菌株的菌落总数均呈现逐日递增的趋势。而在贮藏第9天之后,部分菌株的菌落总数开始有减少的趋势或是趋于平稳,说明菌株生长到达了衰退期或稳定期。随着贮藏时间的增加,培养环境中的营养物质不断地被消耗,菌株分泌的有毒有害物质逐渐积累,菌株的生长受到抑制。在贮藏第9天开始,大部分腐败菌开始出现死亡现象。因此,选择第9天作为观察点,对优势腐败菌的致腐能力进行评价。
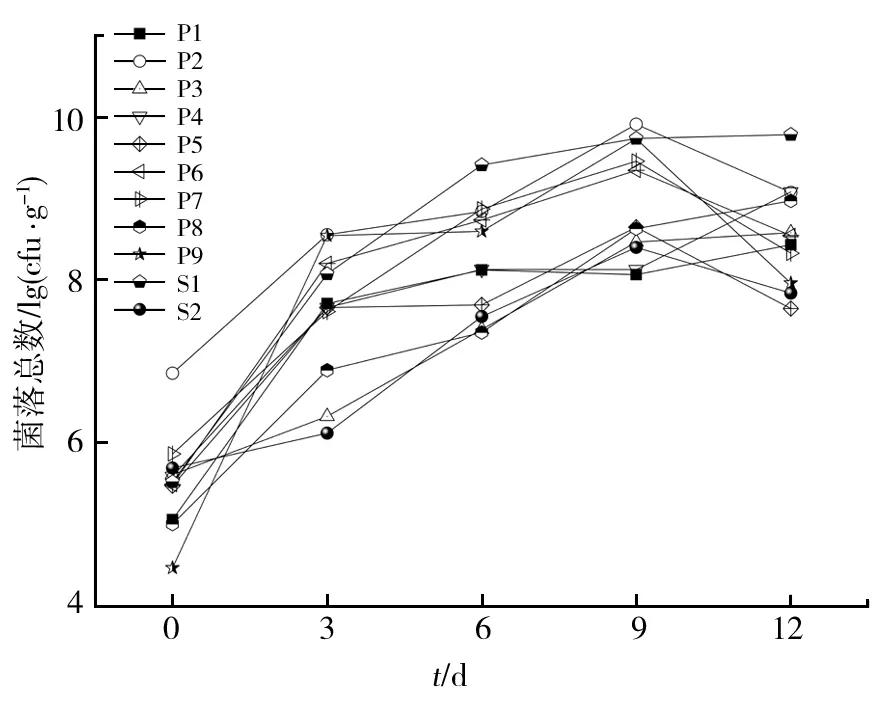
图8 接种优势腐败菌的鱼汁贮藏过程菌落总数变化情况Fig.8 Changes of the total number of colonies during the storage of fish juice inoculated with dominant spoilage bacteria
由于不同腐败菌所需营养物质不同,生长代谢存在一定差异,因此将菌落总数与挥发性盐基氮相结合,通过产量因子Y(TVB-N/cfu)定量表征各优势腐败菌的腐败能力[23]。表2数据显示,致腐能力最强的菌株为S2,TVB-N产量因子可达15.13×10-8mgTVB-N/cfu,其次是P5以及P1菌株,说明在虹鳟鱼贮藏过程中,希瓦氏菌属的致腐能力强于假单胞菌属。希瓦氏菌是一种嗜冷性及产硫能力极强的菌属[24],是虹鳟鱼贮藏过程中的优势腐败菌属。

表2 各种腐败菌的TVB-N产量因子
3 讨 论
虹鳟鱼在0 ℃贮藏过程菌落总数持续增长,在贮藏第6天时达到5.59 lg(cfu/g),已经超过相应的卫生标准,达到虹鳟鱼贮藏的货架期。同时腐败产物挥发性盐基氮在贮藏过程中逐渐积累,在贮藏第15天时达到18.344 mg/100 g,说明虹鳟鱼鱼片在贮藏过程中品质逐渐下降。利用16S rDNA测序技术对虹鳟鱼贮藏初期、中期、末期的菌群变化情况进行测定。结果表明,在贮藏末期的优势菌群为假单胞菌属、不动杆菌属和希瓦氏菌属等。利用选择性培养基分离水产品常见腐败菌假单胞菌属及希瓦氏菌属,高通量测序结果同时包含这两种菌属,对这两种菌属部分菌株的腐败能力进行评价,结果显示,优势腐败菌中的一株希瓦氏菌属在虹鳟鱼贮藏过程中的致腐作用强于其他假单胞菌属的致腐作用。
本研究主要利用高通量测序技术及传统培养分离技术分别从群落数量及致腐能力两方面分析特定腐败菌种类。对比两种技术特点,高通量测序可以几乎完全覆盖样品中的物种种类,反映各贮藏时期的物种组成,从数量上分析腐败菌种类,但无法对具体物种的致腐能力进行有效分析。利用传统培养分离手段分离特定腐败菌,进而对其致腐能力进行分析,可以更准确地了解各菌属的致腐能力,但同时无法兼顾各个物种及各个物种中的每株细菌。例如同属假单胞菌属的菌株,有部分菌株却不具备致腐能力。两种方法各具特点,在研究中应结合两种方法更加深入地探究水产品的优势腐败菌。
本研究确定了虹鳟鱼贮藏过程的特定腐败菌为希瓦氏菌属。有研究表明,大黄鱼[25]和鲈鱼[26]在冷藏过程中的优势腐败菌均为希瓦氏菌属。通过与其他腐败菌致腐能力进行比较,结果表明,希瓦氏菌属的致腐能力最强,这与本研究结果相一致。有相关文献报道,希瓦氏菌生长过程产生大量硫化物,是产硫能力较强的菌属[27]。同时能够形成大量生物膜,说明其黏附能力较强,更容易黏附在水产品表面。此外,有研究表明希瓦氏菌株可以窃听外源群体感应信号分子,增强自身的致腐能力[28]。因此,希瓦氏菌能够在虹鳟鱼贮藏过程中逐渐成为优势菌群,并对虹鳟鱼的腐败产生巨大作用。本研究揭示了虹鳟鱼贮藏过程中的特定腐败菌,为虹鳟鱼腐败机制的研究及虹鳟鱼保鲜剂的开发提供参考。
