甲醇对丙烷/氧气混合气爆炸极限的影响
2021-06-30于瑞广刘杰马彪
于瑞广,刘杰,马彪
(1北京交通大学机械与电子控制工程学院,北京100044;2北京交通大学新能源汽车动力总成技术重点实验室,北京100044)
引 言
柴油及汽油燃料是多种烃类的复杂混合物,其中柴油中的烃类组分超过100种,汽油中的烃类组分超过150种[6],因此通常采用一种或几种燃料的混合物作为实际燃料的替代燃料进行研究。实际燃料的一个典型特征是其在特定温度区间内具有负温 度 系 数(negative temperature coefficient,NTC)特性,同时具有低温及高温两段着火特性。丙烷(C3H8)是具有负温度系数的最小链烷烃[7],且丙烷与柴油都有着低温燃烧特性[8]。丙烷含有的正丙基具有大烃烷基点火过程的所有关键特征[9],因此丙烷也被称为大分子碳氢燃料的原型燃料[10]。丙烷作为液化石油气的重要组成部分,是石油类替代燃料的研究热点[11-12],研究表明在冷焰区域中出现的NTC现象主要由高烷烃的低温氧化动力学主导[13-14]。此外,研究发现NTC现象主要由过氧类化学反应决定[15]。关于丙烷在不同条件下的NTC现象有很多研究,如在反应器内温度区间为633~655 K[16],10~15 atm(1 atm=101325 Pa)下的高压射流反应器[17-18],快速压缩机[19],以及1200 K下的烯丙烷混合物中都发现了NTC现象[20]。据最新研究表明,在丙烷/氧气的S形冷焰爆炸极限曲线同样出现了NTC现象[21]。NTC响应的倾斜程度随浓度比的增加逐渐降低,而惰性气体的添加会引起NTC位置的平移,对NTC的倾斜程度影响较小。丙烷的爆炸极限曲线中的NTC现象主要受丙烷的低温反应控制,其低温反应中两次生成的OH能够明显提高反应系统的活性[22]。此外,添加一定量的臭氧能够使得丙烷/氧气的冷焰区域向低温、低压区域扩展,同时NTC现象随臭氧的增加呈现出先增强后逐渐消失的现象[23]。作为含氧燃料的甲醇,其着火过程是由链式反应动力学决定[24-25]。但是由于甲醇分子可以与高碳氢燃料低温反应产生的OH反应,从而延长混合燃料的着火时间[26]。碳氢燃料的爆炸极限是由活性离子的链分支及链终止反应的竞争决定,因此甲醇的添加势必会影响碳氢燃料的爆炸极限。然而,目前关于甲醇对高碳氢燃料的爆炸极限的研究较少,亟须开展相关研究。
本文以丙烷/甲醇混合燃料作为研究对象,研究甲醇对丙烷/氧气混合气爆炸极限的影响规律。通过定义冷焰爆炸极限及热焰爆炸极限曲线的拐点,探究甲醇对爆炸极限曲线NTC响应的影响。通过提取三个不同着火状态(非爆炸工况、冷焰工况以及热焰工况)下的温度、压力以及主要物质变化规律,研究甲醇对混合气反应过程的影响。此外通过开展丙烷/甲醇/氧气混合气反应过程的路径分析,研究主要反应路径的变化规律。最后通过对爆炸极限曲线拐点的敏感性分析获得影响爆炸极限的主要基元反应。本研究在促进替代燃料的开发与应用,以及研制稳定高效的动力装置方面提供了理论支持。同时,有助于进一步理解丙烷掺混甲醇二元混合气的化学反应动力学特性,从而进一步控制丙烷/氧气混合气的燃烧进程,为开发先进燃烧模式以及其在双燃料发动机的实际应用提供理论基础。
1 数值方法
丙烷/氧气混合气的温度-压力爆炸极限采用SENKIN程序进行计算[27]。其中爆炸极限的判据为在特定压力下10 s内系统温度上升超过50 K[28]。爆炸极限的计算压力范围为(3.2~3.5×107)Pa,爆炸极限的温度计算范围为300~2500 K,涵盖了典型内燃机的工作范围。
研究中使用了四个详细的化学动力学机理模型,包括KAUST异辛烷模型[29]、Aramco2.0模型[30]、UCSD模型[31]和爱尔兰国立大学(NUIG)的Methane/Propane模型[32]。KAUST和Aramco 2.0模型都包含较大的烃类分子,本研究只使用其中的C3亚种群物种以及相应的反应。由于只有少量到达壁面的活性离子被吸附,因此假定活性离子到壁面的扩散速度远远大于壁面对活性离子的吸附速度[33]。此外,假设在壁面上活性离子的浓度与气相中的浓度是一致的,因此假设反应系统是空间均匀的[29]。
活性离子在壁面上通过式(1)反应被吸附
单位体积的等效反应速率常数kH,kO,kOH,kHO2,kH2O2和kHCO由式(2)确定

式中,vˉ=(8kBT/πm)1/2是活性离子在温度T下的热运动平均速度;m是摩尔质量;kB是玻尔兹曼常数。黏附系数ε表示与壁面碰撞时的吸附速率,通常玻璃或石英容器材料的ε≈10-5~10-2[33]。
控制系统是否爆炸的主要参数有燃烧室的形状和大小,活性离子的黏附系数,气体总浓度、温度,燃料和氧气的摩尔分数等因素。在本文中采用球形燃烧室,其直径为2r=0.074 m,表面积与体积比S/V=3/r。
根据《中医临床诊疗术语证候部分》[11] 中所罗列的如对火热证、血虚证、气虚证、阳虚证等各证候的表现,由2名中医专业研究生对筛选出的500例郁证病历进行中医证候要素的提取。
2 结果与分析
2.1 爆炸极限的验证与计算
为确定数值计算中采用的化学动力学模型,将SENKIN程序计算的丙烷/氧气混合气的爆炸极限与Newitt等[34]实验数据进行对比,如图1所示。此外,由于实验数据采集时间较长(大部分在30~150 s之间),因此为与实验数据采集时间保持一致,图1中的计算反应时间设置为60 s。实验和计算结果表明,爆炸压力随温度的升高呈现出非单调下降的趋势。在温度范围为580~750 K,出现负温度系数特性。爆炸极限曲线的计算结果与实验结果略有偏差,主要是由于实验中的爆炸判据是基于甲醛(CH2O)的化学发光,而计算中的爆炸判据为温度的升高量。如图1所示,以爆炸极限曲线上的两个拐点为边界,C3H8/O2混合气在温度区间内共有三个爆炸极限。对于C3H8/O2混合气的第三爆炸极限即低温区域,临界压力随温度的升高而单调降低,主要由于随着温度的升高链分支反应增强。然而在中温区域,即第二爆炸极限,随着混合气温度的增加,触发爆炸需要较高的临界反应物浓度(较高的压力),即在中温度区域存在NTC行为。可以看出四种反应机理预测的爆炸极限均出现了NTC现象,且第一与第三爆炸极限有着相同的变化趋势。由于Aramco 2.0与KAUST机理C3高压反应速率常数几乎相同,因此在中低温区域两个机理计算的爆炸极限基本保持一致,但是计算的爆炸极限始终高于实验值。UCSD机理与Methane/Propane机理计算的第二爆炸极限值略低于实验值,UCSD机理与Methane/Propane机理计算的第二爆炸极限与第三爆炸极限拐点的温度分别为600和585 K,实验值为581 K。与Aramco 2.0机理、KAUST机理以及UCSD机理的计算结果相比,Methane/Propane机理在接下来主要研究的第二爆炸极限处的计算误差较小。此外,Methane/Propane化学反应机理在甲烷/丙烷混合气的不同组分下,计量比从稀混合气(计量比为0.5)到化学计量比以及浓混合气(计量比为3.0),压力区间为5.3~31.4 atm(1 atm=101325 Pa)的综合条件下对滞燃期进行验证,结果取得了计算与实验的一致准确性[32],且涵盖了本文的主要工况。因此,下文中将采用Methane/Propane机理展开研究。

图1 等分子的丙烷/氧气冷焰爆炸极限机理验证Fig.1 Comparison of the calculated and experimental cool flame explosion limit of equimolecular C3H8/O2 mixtures
2.2 化学反应时间对丙烷爆炸极限的影响
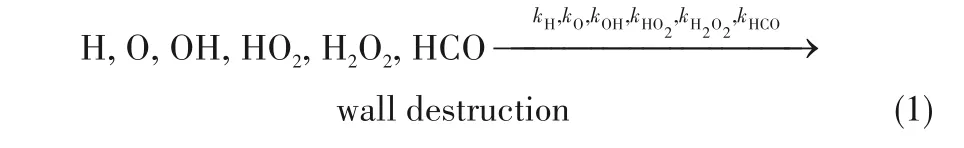
为探究化学反应时间对C3H8/O2混合气冷焰爆炸极限的影响,计算了在化学计量比下的C3H8/O2混合气在不同反应时间的冷焰爆炸极限,如图2所示。随着化学反应时间的增加,C3H8/O2混合气爆炸极限整体向低压、低温区域移动。当化学反应时间在前120 s内时,随着化学反应时间的增加,爆炸极限的压力及温度降低趋势较为明显。当化学反应时间为150 s以上时,爆炸极限的压力及温度的变化较为缓慢。同时,反应时间为150与180 s的爆炸极限曲线几乎重合,表明反应时间对爆炸极限的影响几乎消失。此外,在低温区域,压力的降幅明显要大于中温区域。随着化学反应时间的增加,NTC区域的下拐点(第二爆炸极限与第三爆炸极限分界点)逐渐向低温、低压区域移动,而NTC区域上拐点(第一爆炸极限与第二爆炸极限分界点)的温度与压力的变化较小。当化学反应时间在60 s内时,NTC区域上拐点的温度几乎没有发生变化,但随着反应时间的增加向低压区域移动。当化学反应时间在90 s以上时,NTC区域上拐点的温度与压力基本保持稳定。整体看来,随着化学反应时间的增加,C3H8/O2混合气的NTC区域呈现出不断增大的趋势。虽然反应时间的增加会引起爆炸极限的移动,但是由于实际反应装置中混合气的反应时间较短,10 s的反应时间与实际化学反应特征时间相比已经足够大,为充分研究其化学反应进程,因此在后文的研究中化学反应时间均设置为10 s。
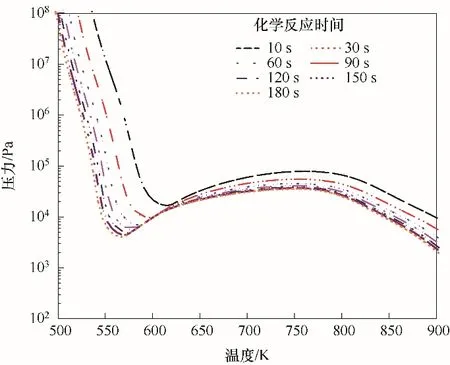
图2 反应时间对化学计量比下C3H8/O2混合气冷焰极限的影响Fig.2 Effect of induction period on the cool flame limits of stoichiometric C3H8/O2 mixtures
2.3 甲醇对丙烷爆炸极限的影响
如图3所示为化学计量比下C3H8/O2混合气的冷焰爆炸极限及热焰爆炸极限随甲醇摩尔分数的变化规律。其中热焰爆炸的判断标准为在反应时间10 s内混合气温度能够升高400 K的工况[23],冷焰爆炸的判断标准为在反应时间10 s内混合气温度能够升高50 K的工况。图3中定义(P1,T1)为冷焰第一爆炸极限和第二爆炸极限的分界点,(P11,T11)为热焰第一爆炸极限和第二爆炸极限的分界点,(P2,T2)为冷焰第二爆炸极限和第三爆炸极限的分界点,(P22,T22)为热焰第二爆炸极限和第三爆炸极限的分界点,统称(P1,T1)和(P11,T11)为上拐点,(P2,T2)和(P22,T22)为下拐点。对于冷焰爆炸极限,随着添加CH3OH摩尔分数的增加,其爆炸极限曲线向高压区域移动。在NTC区域,当添加CH3OH摩尔分数低于10%时,下拐点的压力升高量较小。当添加CH3OH摩尔分数高于20%时,下拐点的压力升高量开始逐渐增大。但下拐点的温度变化较小。然而上拐点的温度与压力随着CH3OH摩尔分数的增加几乎没有变化,即CH3OH的摩尔分数对上拐点的位置变化基本上是没有影响的。整体看来,随着CH3OH摩尔分数的增加,C3H8/CH3OH/O2混合气的NTC区域是不断减小的。对于热焰爆炸极限,其变化规律与冷焰爆炸极限的一致,其上拐点随CH3OH摩尔分数增加保持不变,但是其下拐点随着添加CH3OH摩尔分数的增加温度增加的趋势较为明显。
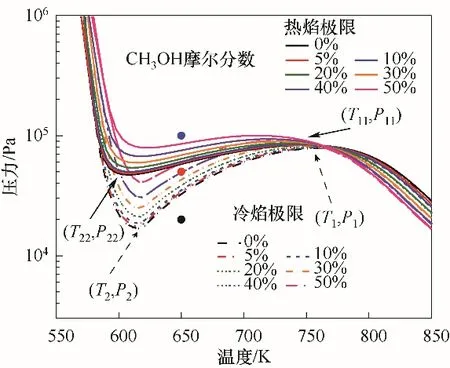
图3 甲醇对化学计量比下的C3H8/O2混合气冷焰和热焰极限的影响Fig.3 Effect of methanol on the cool flame and hot flame limits of stoichiometric C3H8/O2 mixtures
为进一步分析不同爆炸区域的反应过程,沿650 K等温线,选取压力为2×104、5×104和105Pa的工况点,在图3中分别由黑色、红色、蓝色点标记,分别代表无爆炸、冷焰和热焰三种工况,并分别提取三种工况下的温度及压力变化数据。如图4(a)和(b)所示为C3H8/(30%)CH3OH/O2混合气在三种典型工况下的温度和压力变化规律。对于非爆炸工况,在反应时间内未能进行快速反应,因此温度和压力曲线变化较为平缓。在冷焰区,压力和温度曲线呈现缓慢上升的趋势,但整体升高量均比较小,在反应时间10 s内混合气的温度升高为71 K。此外,热焰工况下,混合气的温度和压力曲线具有典型的两段着火特性,如图4(a)和(b)所示。在0.9 s左右出现第一阶段的温度及压力升高现象,在3.06 s左右出现第二阶段的温度及压力急剧升高现象。
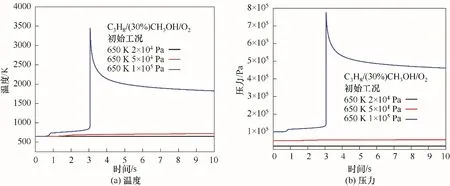
图4 无爆炸、冷焰和热焰区域的温度与压力对比Fig.4 Comparison of the temperatures and pressures under non-explosion,cool flame and hot flame regions
图5为无爆炸、冷焰和热焰三个典型工况下丙烷、甲醇和甲醛在反应过程中的摩尔分数变化情况。在非爆炸工况下初始压力较低,在反应时间内反应较为缓慢,因此丙烷和甲醇的消耗较小,几乎没有甲醛生成。对于冷焰工况下,丙烷在1 s以后的消耗较为明显,在10 s的反应时间内被消耗掉约7%。同时,甲醇也在1 s左右开始参与反应,在反应时间内的消耗量约为9%。此外,在反应开始1 s后,逐渐有甲醛生成,整体生成量较少(约为0.01 mol)。对于热焰工况下,在反应第一阶段0.85 s前约有0.01mol的丙烷参与反应,在0.85~3.0 s内丙烷的消耗量约为15%,在3 s左右,由于出现热焰现象,剩余的丙烷被快速消耗。甲醇的反应进程基本与丙烷的反应进程保持一致。在0.85 s产生少量的甲醛,此后甲醛生成量急剧增长,并在3.07 s附近达到其峰值(约为0.0236 mol)。但由于第二阶段反应温度较高,甲醛随即被完全消耗。
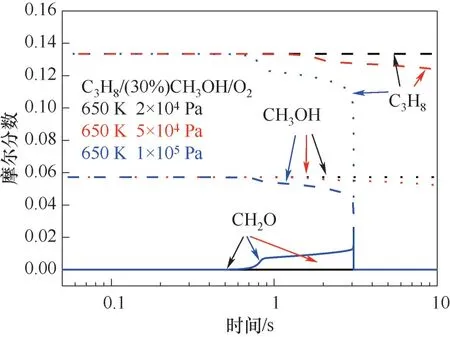
图5 无爆炸、冷焰和热焰区域的主要组分含量对比Fig.5 Mole fractions of the main species under non-explosion,cool flame and hot flame regions
图6对比了C3H8/(30%)CH3OH/O2混合气中冷焰和热焰工况下主要的产热反应。在这两种工况下,放热反应主要是丙烷的低温反应,包括丙烷与OH自由基的脱氢反应、i-C3H7O2的分解反应以及n-C3H7O2的异构化反应。在冷焰工况下,还包括CH3和CH3O的加氧反应,如图6(a)所示。此外关于热焰工况,高压环境下CH3OH的链传递反应加剧,首先CH3OH与HO2反应生成CH2OH,CH2OH的加氧反应生成CH2O,CH2O进一步与HO2反应生成HCO与H2O2,HCO的加氧反应生成CO和HO2,如图6(b)所示。此外,对比分析图6(a)、(b)可知,在热焰工况下相同反应的热释放率远远高于冷焰工况下的热释放率。
为进一步验证CH3OH是否能够改变C3H8/O2的反应路径,降低C3H8/O2混合气中温条件下的反应活性,针对图6中出现的CH3OH的链传递的相关放热反应中HO2的主要生成与消耗反应的正向与反向速率比进行计算分析,反应初始条件为650 K,5×104Pa下的C3H8/O2和C3H8/(30%)CH3OH/O2混合气,如图7所示。从图7可知,CH3OH在该温度区间下的链传递反应即R94:CH3OH+HO2CH2OH+H2O2;R71:CH2OH+O2CH2O+HO2;R47:CH2O+HO2HCO+H2O2;R27:HCO+O2CO+HO2。在反应初始时刻正反应速率远远大于逆反应速率,随着反应的进行,正、逆反应的速率比逐渐趋于常数。其中,在甲醇的链传递反应中,C3H8/(30%)CH3OH/O2混合气中的HO2消耗反应R94、R47的反应速率比略大于C3H8/O2的速率比,但两种混合气中两个反应的最终反应速率比基本一致。特别注意的是,关于HO2的生成反应R71,在C3H8/O2中仅在反应初始时刻速率比小于1,随后速率比等于1。而在C3H8/(30%)CH3OH/O2混合气中,在反应初始时刻R71的反应速率比较大,伴随着反应的进行正逆反应速率比逐渐降低并趋于稳定,在反应进程趋于稳定时,正逆反应的速率比仍为70左右。即在甲醇的链传递反应中,HO2的生成量远大于其消耗量。同样对于HO2的生成反应R27,C3H8/(30%)CH3OH/O2混合气在反应时间1 s后的反应速率比始终大于C3H8/O2混合气的反应速率比。这表明,混合气添加的甲醇促进了HO2的生成,从而增加了丙烷与HO2反应比例。
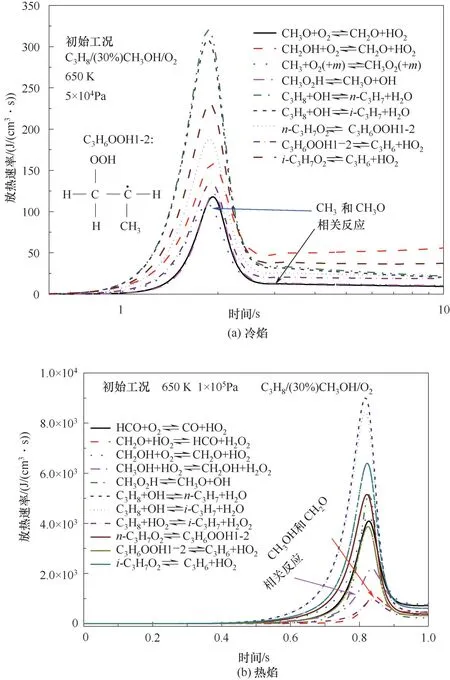
图6 主要反应的放热速率Fig.6 Heat release rates of the main reactions
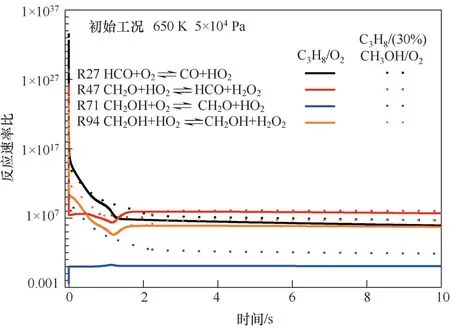
图7 650 K、5×104 Pa下C3H8/O2和C3H8/(30%)CH3OH/O2混合气中HO2主要反应速率比Fig.7 The forward and backward reactions ratios of the HO2 main reactions at 650 K,5×104 Pa under C3H8/O2 and C3H8/(30%)CH3OH/O2 mixtures
2.4 反应路径分析
为进一步确定甲醇对C3H8/O2混合气第二爆炸极限内氧化进程的影响,如图8所示,分别针对C3H8/O2以及C3H8/(30%)CH3OH/O2混合气的冷焰以及热焰极限内典型特征点(650 K,5×104Pa)、(650 K,1×105Pa)的氧化反应路径进行分析,其中反应路径分析工况点温度为700 K。图8中蓝色为700 K,5×104Pa下C3H8/O2混合气的反应路径;红色为700 K,5×104Pa下C3H8/(30%)CH3OH/O2混合气的反应路径;绿色为700 K,1×105Pa下C3H8/O2混合气的反应路径;紫色为700 K,1×105Pa下C3H8/(30%)CH3OH/O2混合气的反应路径。图中仅标注出反应量超过1%(相对于总反应量)的反应路径。H2O28定义为H2O2经过反应式(1)在壁面上吸附的失效产物。从图8可见,丙烷主要有两条平行反应路径,即丙烷通过与OH和HO2活性基团完成脱氢反应生成i-C3H7和n-C3H7,其中n-C3H7通过加氧反应生成n-C3H7O2,n-C3H7O2主要有三条反应路径;i-C3H7通过加氧反应生成i-C3H7O2,i-C3H7O2主要有两条反应路径。对比蓝色与红色反应路径可知,添加30%的甲醇时,丙烷的两条主要平行反应路径没有发生变化,C3H8/O2以及C3H8/(30%)CH3OH/O2混合气中丙烷的相对脱氢总反应量分别为95.7%和95.5%,在C3H8/O2混合气中丙烷的脱氢反应主要通过与OH的反应进行(比例为88.3%),然而混合气中甲醇摩尔分数的增加促进了丙烷与HO2的脱氢反应(比例为31.2%)的进行,丙烷与OH反应比例有所降低。但是混合气中甲醇摩尔分数的增加会导致整体的反应进程减缓,相较于C3H8/(30%)CH3OH/O2混合气,C3H8/O2中的i-C3H7O2进一步反应生成C3H6OOH2-1,C3H6OOH2-1与HO2反应生成C3H6;C3H8/O2中的n-C3H7O2进一步反应生成C3H6OOH1-3。然而,在C3H8/(30%)CH3OH/O2混合气中,增加了丙烷与HO2反应生成H2O2的反应路径,H2O2在壁面上的吸附进程有所体现。对比绿色与紫色反应路径可知,混合气中甲醇摩尔分数的增加轻微促进了丙烷以及i-C3H7O2、n-C3H7、n-C3H7O2分别与HO2的反应,相较于5×104Pa,高压1×105Pa下促进与HO2的反应的作用有所降低。这个结果与图6中分析结果保持一致,均证实了甲醇促进了HO2的生成,从而改变C3H8/O2的中温反应路径。

图8 反应路径分析:(700 K,5×104 Pa)工况点下,蓝色为C3H8/O2混合气,红色为C3H8/(30%)CH3OH/O2混合气;(700 K,1×105 Pa)工况点下,绿色为C3H8/O2混合气,紫色为C3H8/(30%)CH3OH/O2混合气Fig.8 The reaction pathway analysis of C3H8/O2 mixtures(Blue symbols)and with 30%CH3OH addition of C3H8/O2 mixtures(Red symbols)at(700 K,5×104 Pa)condition and,C3H8/O2 mixtures(Green symbols)and with 30%CH3OH addition of C3H8/O2 mixtures(Violet symbols)at(700 K,1×105 Pa)condition
2.5 NTC拐点敏感性分析
为确定控制爆炸极限曲线拐点的主要反应,对爆炸极限拐点进行了敏感性分析。敏感性系数表示拐点的温度和压力对化学动力学模型中主要基元反应的依赖程度。其中,敏感性系数的计算方法是将各基元反应速率的前置因子A施加50%的扰动,然后根据式(3)可以计算出归一化敏感性系数。

式中,Ai是第i个反应的反应速率系数的A因子;X是拐点的温度或压力。
采用0.5 K的步长搜索拐点的温度,并添加50%的速率系数扰动以保证拐点温度的变化。如图9所示为甲醇摩尔分数为0、30%和50%的C3H8/O2混合气NTC下拐点的主要基元反应归一化敏感性系数。其中,反应最敏感的有丙烷与羟基(OH)反应引起的C3H8脱氢反应,C3H7O2的异构化生成C3H6OOH。C3H8的其他低温链分支反应进程主要包括:C3H8分别与OH、HO2和CH3CO3进行脱氢反应;C3H7O2的异构化生成C3H6OOH;C3H6OOH的加氧反应生成过渡态环状的C3H6OOHO2;C3H6OOHO2的进一步分解生成C3-ket ohy droperoxide酮基过氧化物(C3ket,C3ket21、C3ket13、C3ket12为同分异构体)与OH;C3ket再分解生成OH自由基和CH2O。此外,在甲醇摩尔分数为30%和50%时,CH3OH开始分别与OH自由基和H离子进行反应,与C3H8和OH的脱氢反应形成竞争,引起下拐点的压力变化。这表明,下拐点主要由C3H8的低温链分支反应所控制。
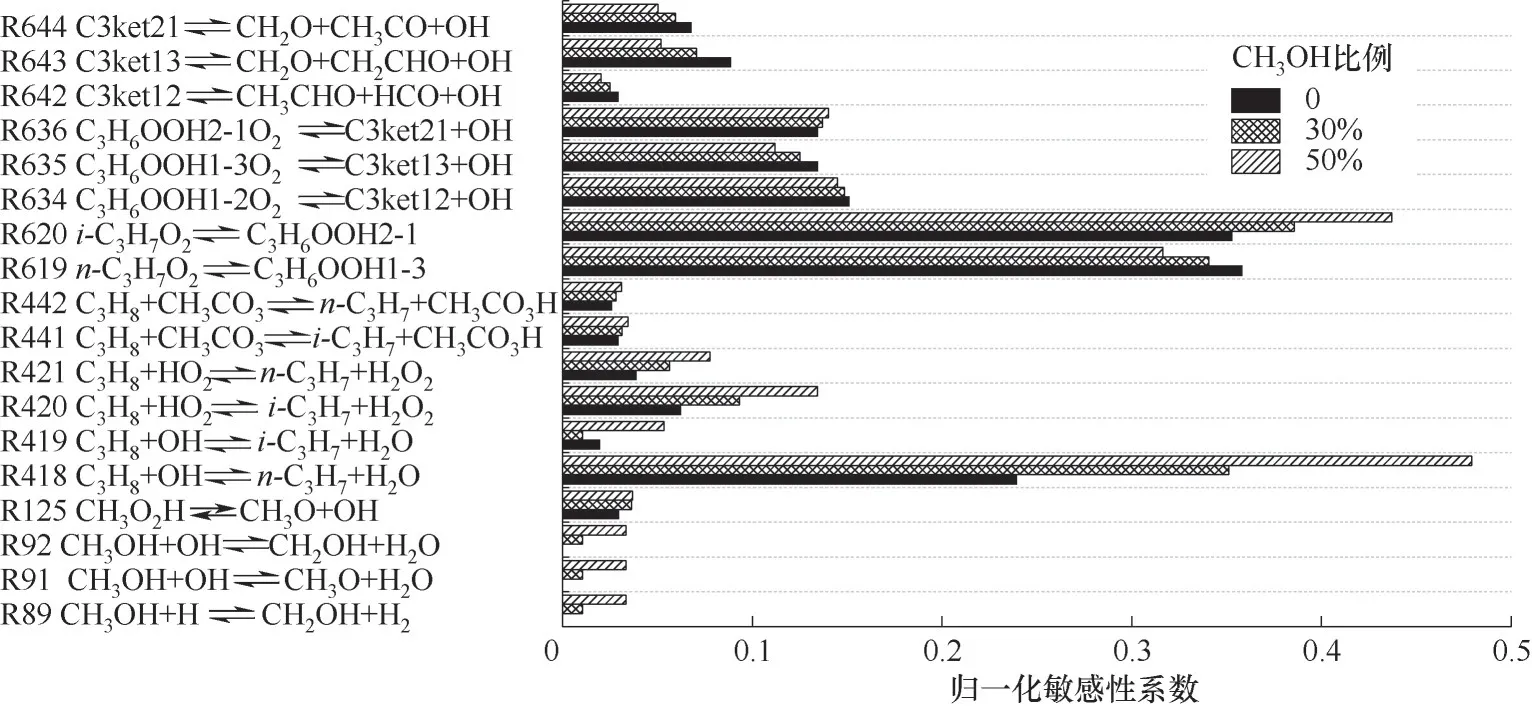
图9 C3H8/CH3OH/O2混合气下拐点的主要反应的敏感性Fig.9 Thesensitivity of the main reactions on the lower turnover point for C3H8/CH3OH/O2 mixtures
上拐点的主要基元反应的敏感性系数如图10所示。其中,对于上拐点影响较大的反应主要有C3H7O2的异构化生成C3H6OOH,C3H6OOH的加氧反应,以及C3H7O2和C3H6OOH一系列产生HO2的分解反应。由于温度升高,混合气的整体反应进程加快,分解反应比O2加成反应更活跃,导致上、下拐点的敏感性存在差异。因此,上拐点是由O2的加入来控制产生HO2自由基进而控制上拐点的敏感性。
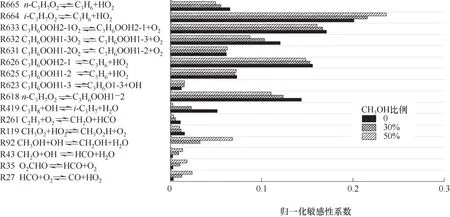
图10 C3H8/CH3OH/O2混合气上拐点的主要反应的敏感性Fig.10 The sensitivity of the main reactions on the upper turnover point for C3H8/CH3OH/O2 mixtures
3 结 论
本文对C3H8/CH3OH/O2混合气在爆炸极限(温度-压力)下NTC特性进行了理论和计算分析,得出主要结论如下。
(1)在NTC区域,随着混合气中CH3OH摩尔分数的增加,下拐点的压力逐渐向高压区域移动,但下拐点的温度保持不变。而在C3H8/O2混合气中添加CH3OH对上拐点的位置变化没有影响。随着混合气中CH3OH摩尔分数的增加,C3H8/O2混合气的NTC区域是不断减小的。
(2)热焰工况下的温度和压力曲线具有典型的两段着火特性。在冷焰和热焰工况下,C3H8低温反应路径上的反应为主要放热反应,包括C3H8与OH自由基的脱氢反应、i-C3H7O2的分解反应以及n-C3H7O2的异构化反应。此外,CH3OH链传递反应促进HO2的生成,加快了丙烷与HO2脱氢反应的进程。
(3)敏感性分析表明,下拐点主要由C3H8的低温链分支反应所控制。上拐点是由O2的加入来控制产生HO2自由基从而控制上拐点的敏感性。
本文计算的C3H8/CH3OH/O2混合气的爆炸极限界定了混合气的慢速反应与快速反应区域,为开发新型燃烧模式提供了参考依据,有利于丙烷/甲醇新型替代燃料在压燃式及点燃式发动机中的应用。此外,混合气NTC特性的控制点与主要控制反应为简化化学动力学机理提供了理论支撑。
